漸凍癥(ALS)是一種進(jìn)行性神經(jīng)元疾病,患者的運(yùn)動(dòng)神經(jīng)元逐漸受損甚至死亡,導(dǎo)致肌肉萎縮、行動(dòng)受限、言語(yǔ)和吞咽困難,最終可能影響呼吸。確診后,目前還沒(méi)有根治的方法,患者多數(shù)只能依靠康復(fù)訓(xùn)練和對(duì)癥支持來(lái)維持生活質(zhì)量,病程發(fā)展快,生活壓力極大。
近年來(lái),隨著干細(xì)胞技術(shù)的發(fā)展,科學(xué)家們看到了新的希望。不過(guò),從全球來(lái)看,這一領(lǐng)域的發(fā)展并不均衡。不同國(guó)家在技術(shù)成熟度、臨床試驗(yàn)規(guī)模和應(yīng)用落地方面存在差距,這直接影響患者能否盡快獲益。
那么,同樣是研究干細(xì)胞治療漸凍癥,2025年了,國(guó)內(nèi)外技術(shù)到底誰(shuí)更靠譜?咱們是跟國(guó)外差一大截,還是偷偷彎道超車了變成我們領(lǐng)先了?接下來(lái)我們就從雙方的最新的臨床研究進(jìn)展和突破,來(lái)看看各方的現(xiàn)狀和潛力。

全球視角:2025國(guó)內(nèi)外干細(xì)胞治療漸凍癥技術(shù)進(jìn)展對(duì)比
一、國(guó)際前沿:2025全球ALS干細(xì)胞治療技術(shù)進(jìn)展
1.1 美國(guó):NurOwn? 3b期臨床試驗(yàn),延長(zhǎng)ALS患者生存期的突破性探索
2025年5月19日,美國(guó)BrainStorm Cell Therapeutics Inc.?公司宣布,美國(guó)食品藥品監(jiān)督管理局 (FDA) 已批準(zhǔn)該公司啟動(dòng)NurOwn?(自體MSC-NTF細(xì)胞)治療肌萎縮側(cè)索硬化癥 (ALS) 的3b期臨床試驗(yàn)。?[1]

之前納入的10名患者均已完成公司III期臨床試驗(yàn)數(shù)據(jù)顯示:
干細(xì)胞治療后90%的參與者(9/10)在出現(xiàn)ALS癥狀后存活超過(guò)五年,而現(xiàn)在已發(fā)表的傳統(tǒng)治療方法數(shù)據(jù),只有約有10%的ALS患者存活超過(guò)五年。
該隊(duì)列的中位生存期從癥狀出現(xiàn)起達(dá)6.8年(范圍6-7年),該隊(duì)列中唯一一例死亡病例發(fā)生在選擇性安樂(lè)死之后。
若以已發(fā)表的傳統(tǒng)治療數(shù)據(jù)估計(jì)約10%的 ALS 患者可存活超過(guò)五年,那么在獨(dú)立隨機(jī)抽樣的假設(shè)下,觀察到9/10這類結(jié)果的概率非常極小——約為9.1×10??(約 0.00000091%),這說(shuō)明單純由隨機(jī)波動(dòng)導(dǎo)致如此高比例的可能性幾乎可以忽略不計(jì)。
BrainStorm Cell Therapeutics 總裁兼首席執(zhí)行官Chaim Lebovits表示:“這些生存數(shù)據(jù)為接受NurOwn擴(kuò)大可及性治療的ALS患者的長(zhǎng)期療效提供了令人鼓舞的真實(shí)洞察。我們相信,這些發(fā)現(xiàn)為開(kāi)展的NurOwn?3b期臨床試驗(yàn)提供了進(jìn)一步的證據(jù),該試驗(yàn)將根據(jù)FDA特殊方案評(píng)估 (SPA) 進(jìn)行。我們的目標(biāo)仍然是生成高質(zhì)量、確鑿的數(shù)據(jù),以證明NurOwn對(duì)ALS患者的益處。”
作為BrainStorm公司的核心項(xiàng)目,NurOwn?已獲得FDA與EMA的孤兒藥資格,若啟動(dòng)的3b期試驗(yàn)數(shù)據(jù)理想,有望通過(guò)加速審批通道提前上市。
1.2 韓國(guó):Neuronata-R? Ⅲ期試驗(yàn),劑量依賴性療效顯著改善ALS功能與呼吸能力
2025年5月29日,韓國(guó)Corestemchemon公司宣布其研發(fā)的干細(xì)胞療法Neuronata-R(lenzumestrocel)在Ⅲ期治療漸凍癥的臨床試驗(yàn)中取得關(guān)鍵進(jìn)展。[2]

Neuronata-R?(商品名:lenzumestrocel)是韓國(guó)生物科技公司CorestemChemon研發(fā)的自體骨髓間充質(zhì)干細(xì)胞(MSC)療法,專為治療肌萎縮側(cè)索硬化癥(ALS)(俗稱“漸凍癥”)設(shè)計(jì),旨在利用自體MSC的治療潛力來(lái)解決該疾病復(fù)雜的病理機(jī)制。
該療法通過(guò)提取患者自身骨髓中的MSCs,在實(shí)驗(yàn)室中擴(kuò)增并誘導(dǎo)其分泌神經(jīng)營(yíng)養(yǎng)因子,最終通過(guò)鞘內(nèi)注射回輸至患者體內(nèi),旨在修復(fù)受損運(yùn)動(dòng)神經(jīng)元、延緩疾病進(jìn)展并改善患者生活質(zhì)量。
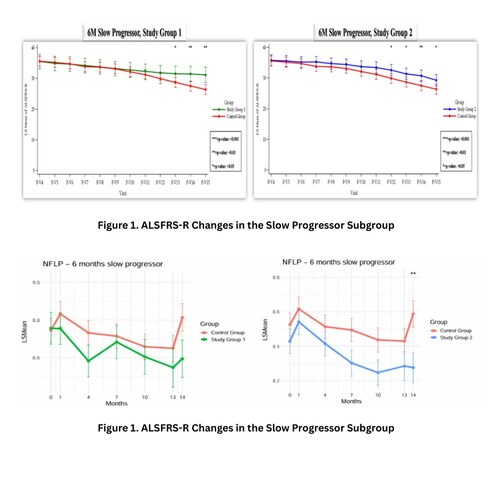
Neuronata-R?在Ⅲ期臨床試驗(yàn)中對(duì)疾病進(jìn)展緩慢的ALS患者展現(xiàn)出顯著療效。根據(jù)最終臨床研究報(bào)告(CSR):
1.關(guān)鍵療效指標(biāo)改善
CAFS(功能與生存綜合評(píng)估):
- 兩劑量組(第1組)在治療第6個(gè)月時(shí)CAFS評(píng)分顯著優(yōu)于安慰劑(20.95vs13.66);
- 五劑量組(第2組)改善更顯著(24.78vs17.92)。
ALSFRS-R功能評(píng)分:五劑量組在第9個(gè)月即實(shí)現(xiàn)統(tǒng)計(jì)學(xué)顯著改善,較兩劑量組(第10個(gè)月)提前一個(gè)月。
2.呼吸功能(SVC)顯著提升:五劑量組在治療第8個(gè)月起SVC評(píng)分顯著優(yōu)于對(duì)照組,提示可能延緩呼吸功能衰退。
3.劑量依賴性效應(yīng):五劑量組的NfL水平(神經(jīng)絲輕鏈)在第4個(gè)月和第10個(gè)月均顯著低于安慰劑組,進(jìn)一步支持其劑量依賴性療效。
4.首次披露的深度分析:CSR首次全面解析了CAFS和SVC數(shù)據(jù),其中SVC作為ALS呼吸功能衰退的臨床關(guān)鍵指標(biāo),其改善意義重大。
總結(jié):Neuronata-R?在進(jìn)展緩慢型ALS患者中展現(xiàn)出明確的劑量依賴性療效,核心指標(biāo)(CAFS、SVC、NfL)均支持其通過(guò)生物標(biāo)志物驅(qū)動(dòng)的加速審批路徑。
1.3 沙特阿拉伯:臍血干細(xì)胞療法,可規(guī)模化生產(chǎn)的創(chuàng)新ALS治療模式
2025年5月,德克薩斯A&M大學(xué)的一位教授與沙特阿拉伯簽署了美國(guó)首個(gè)醫(yī)學(xué)臨床試驗(yàn)協(xié)議,推進(jìn)了治療再生障礙性貧血、肌萎縮側(cè)索硬化癥和其他疾病的潛在突破性細(xì)胞療法的研究。[3]

德克薩斯農(nóng)工大學(xué)系統(tǒng)官員上周宣布,Cellenkos將在利雅得的醫(yī)療中心開(kāi)展兩項(xiàng)針對(duì)再生障礙性貧血和移植物抗宿主病的臨床試驗(yàn)。隨后,該技術(shù)還將開(kāi)展針對(duì)肌萎縮側(cè)索硬化癥 (ALS) 和心血管疾病的試驗(yàn)。
該技術(shù)利用從臍帶血中提取的特殊細(xì)胞來(lái)治療炎癥,而且這種療法可以大規(guī)模生產(chǎn),無(wú)需個(gè)體化供體匹配。
臨床數(shù)據(jù)方面,該團(tuán)隊(duì)已用該技術(shù)治療80余名患者,涵蓋ALS、再生障礙性貧血、骨髓纖維化等疾病,證實(shí)療法安全有效。其中,F(xiàn)DA通過(guò) “同情用藥” 批準(zhǔn)治療6名ALS患者,部分患者已接受22次每月輸液;后續(xù)又批準(zhǔn)對(duì)另外6名患者開(kāi)展試驗(yàn)。
2025年4月,《新英格蘭醫(yī)學(xué)雜志證據(jù)》(NEJM Evidence)刊發(fā)文章,記錄患者病情在穩(wěn)定方面的改善;另有期刊文章提及,再生障礙性貧血患者經(jīng)一次輸液后,最長(zhǎng)3.5年無(wú)需輸血和血小板。
德克薩斯A&M大學(xué)創(chuàng)新顧問(wèn)委員會(huì)主席喬?坎寧安評(píng)價(jià):“這是前景光明的技術(shù),早期跡象顯示對(duì)ALS等疾病患者療效良好,我們期待深入研究。”
1.4 格魯吉亞:MSC移植病例研究,功能改善與病情穩(wěn)定的新證據(jù)
2025年3月29日,格魯吉亞第比利斯解剖學(xué)研究與技能中心在《PREMIER JOURNAL OF CASE REPORTS》雜志上發(fā)表了一篇名為《自體間充質(zhì)干細(xì)胞移植治療肌萎縮側(cè)索硬化癥:一例病例報(bào)告》的研究成果。[4]
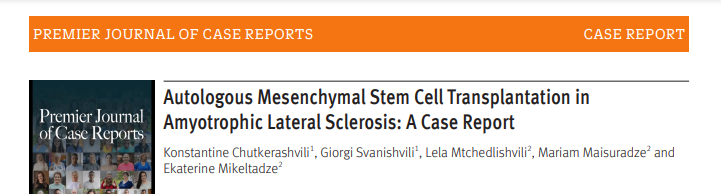
本研究評(píng)估了MSC移植對(duì)一名52歲ALS患者的安全性和治療潛力,并評(píng)估了患者功能變化和病情進(jìn)展。患者接受了兩次 MSC移植,分別通過(guò)鞘內(nèi)和靜脈給藥。治療后5個(gè)月內(nèi)進(jìn)行了臨床評(píng)估、肌電圖 (EMG) 和ALS功能評(píng)定量表修訂版 (ALSFRS-R) 評(píng)估。
移植后患者運(yùn)動(dòng)功能得到改善,肢體活動(dòng)能力增強(qiáng),吞咽功能改善。ALSFRS-R評(píng)分(ALS患者通常會(huì)下降)顯示
提高了15%,提示病情可能穩(wěn)定。肌電圖顯示,盡管運(yùn)動(dòng)神經(jīng)元持續(xù)退化,但感覺(jué)纖維仍得以保留。未觀察到嚴(yán)重的不良反應(yīng)。
這些發(fā)現(xiàn)表明,間充質(zhì)干細(xì)胞(MSC)可能對(duì)ALS患者具有疾病修飾作用,帶來(lái)功能和情緒方面的益處。
二、國(guó)內(nèi)前沿:2025年國(guó)內(nèi)干細(xì)胞治療技術(shù)進(jìn)展
2.1 iPSC-MNP干細(xì)胞藥物獲中美雙重認(rèn)可:邁入ALS臨床研究新階段
2025年2月,來(lái)自中國(guó)的生物制藥公司士澤生物自主研發(fā)的干細(xì)胞治療藥物獲得了美國(guó)食品藥品監(jiān)督管理局(FDA)的正式批準(zhǔn),將在美國(guó)開(kāi)展針對(duì)肌萎縮側(cè)索硬化癥(ALS),即漸凍癥的注冊(cè)臨床試驗(yàn)。
并且該藥物已經(jīng)同步獲得我國(guó)國(guó)家藥品監(jiān)督管理局(NMPA)的正式受理,意味著國(guó)內(nèi)患者未來(lái)也有望受益于這一前沿療法。(中國(guó)注冊(cè)臨床I/II期及美國(guó)注冊(cè)臨床I期)
3月,該產(chǎn)品我國(guó)臨床試驗(yàn)患者已成功入組,為后續(xù)大規(guī)模研究奠定基礎(chǔ)。[5]
此次獲批的干細(xì)胞新藥,核心技術(shù)來(lái)源于誘導(dǎo)多能干細(xì)胞(iPSC)。iPSC技術(shù)可以將普通體細(xì)胞(如皮膚細(xì)胞)“逆轉(zhuǎn)”為具有多能性的干細(xì)胞,再定向誘導(dǎo)其分化為神經(jīng)前體細(xì)胞,用于修復(fù)受損神經(jīng)元。
iPSC治療漸凍癥的核心原理:1.修復(fù)受損神經(jīng)元,幫助恢復(fù)運(yùn)動(dòng)功能;2.延緩疾病進(jìn)展,提高患者生存質(zhì)量;3.從根源上改善病情,而非僅僅緩解癥狀。
該款藥物的臨床前研究和初步試驗(yàn)顯示,安全性和有效性方面取得了令人鼓舞的結(jié)果,在超過(guò)12個(gè)月的臨床隨訪表明在延緩病情發(fā)展上展現(xiàn)出了巨大潛力。
2.2 第三屆細(xì)胞治療臨床研究研討會(huì):ALS臨床數(shù)據(jù)首次披露,療效可期
2025年9月5日至7日,由中國(guó)醫(yī)藥生物技術(shù)協(xié)會(huì)主辦,再生醫(yī)學(xué)專委會(huì)、臨床研究專委會(huì)和醫(yī)藥生物技術(shù)臨床應(yīng)用專委會(huì)承辦的第三屆細(xì)胞治療臨床研究研討會(huì)在北戴河新區(qū)順利召開(kāi)。[6]
來(lái)自全國(guó)三甲醫(yī)院、科研院所及生物醫(yī)藥企業(yè)的50多位頂尖專家帶來(lái)了30余項(xiàng)首次披露的人體臨床數(shù)據(jù),繞細(xì)胞治療政策環(huán)境、臨床研究進(jìn)展、技術(shù)創(chuàng)新與轉(zhuǎn)化應(yīng)用等前沿議題展開(kāi)深入研討。

在這次會(huì)議上,公布的干細(xì)胞成果涵蓋了從糖尿病、心臟病到帕金森、漸凍癥,甚至膝關(guān)節(jié)炎、潰瘍性結(jié)腸炎、慢性腎病、缺血性腦卒中等多個(gè)難治性疾病的最新臨床數(shù)據(jù)。
其中關(guān)于漸凍癥方面的,士澤生物XS228注射液(iPSC-MNP)的早期隨訪(7.5個(gè)月)顯示3例患者呼吸功能下降率得到逆轉(zhuǎn),無(wú)嚴(yán)重毒性并獲孤兒藥資格認(rèn)定,提示潛在療效與可耐受性。
2.3 干細(xì)胞衍生物ALT001獲CDE受理:開(kāi)創(chuàng)無(wú)細(xì)胞ALS治療新范式
2025年9月12日,CDE官網(wǎng)顯示,達(dá)爾文起點(diǎn)(北京)生物制藥有限責(zé)任公司(達(dá)爾文細(xì)胞生物科技有限公司的全資子公司)自主研發(fā)的1類生物新藥“注射用經(jīng)應(yīng)激誘導(dǎo)的間充質(zhì)干細(xì)胞衍生物”(推測(cè)管線代號(hào):ALT001)已正式獲得國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心(CDE)的臨床試驗(yàn)申請(qǐng)受理。[7]
該藥物擬用于治療肌萎縮側(cè)索硬化(ALS,俗稱“漸凍癥”),標(biāo)志著國(guó)內(nèi)首款基于“應(yīng)激間充質(zhì)干細(xì)胞衍生物(PDSSCs)”技術(shù)平臺(tái)的新藥邁入臨床開(kāi)發(fā)階段。
此次獲批受理的ALT001依托達(dá)爾文生物自主創(chuàng)新的PDSSCs技術(shù)平臺(tái)。該技術(shù)通過(guò)模擬特定生理或病理應(yīng)激環(huán)境,激活間充質(zhì)干細(xì)胞分泌多種具有神經(jīng)修復(fù)功能的活性蛋白與外泌體,再經(jīng)精密純化工藝制備成“無(wú)細(xì)胞”的注射制劑。這一突破性路徑擺脫了傳統(tǒng)活細(xì)胞移植的局限,開(kāi)創(chuàng)了“無(wú)細(xì)胞治療”的新范式。
三大核心價(jià)值凸顯創(chuàng)新優(yōu)勢(shì):
填補(bǔ)臨床治療空白:目前針對(duì)ALS、阿爾茨海默病(AD)等神經(jīng)退行性疾病尚無(wú)根治手段,現(xiàn)有療法多以延緩疾病進(jìn)展為主。ALT001憑借“多靶點(diǎn)協(xié)同修復(fù)神經(jīng)網(wǎng)絡(luò)”的作用機(jī)制,有望實(shí)現(xiàn)對(duì)已損傷神經(jīng)功能的逆轉(zhuǎn),為患者帶來(lái)全新希望。
推動(dòng)無(wú)細(xì)胞療法產(chǎn)業(yè)化落地:PDSSCs技術(shù)將干細(xì)胞治療從“活細(xì)胞產(chǎn)品”升級(jí)為“標(biāo)準(zhǔn)化分泌型蛋白藥物”,有效規(guī)避了細(xì)胞療法在規(guī)模化生產(chǎn)、長(zhǎng)期穩(wěn)定儲(chǔ)存、冷鏈運(yùn)輸以及潛在致瘤風(fēng)險(xiǎn)等方面的行業(yè)難題,顯著提升了治療產(chǎn)品的可及性與商業(yè)化潛力。
獲資本與技術(shù)雙重認(rèn)可:從A輪到C輪,企業(yè)累計(jì)融資超5億元,其中2025年,達(dá)爾文生物完成超2億元C輪融資,由國(guó)家中小企業(yè)發(fā)展基金領(lǐng)投。此次融資不僅為ALT001的臨床推進(jìn)提供堅(jiān)實(shí)支持,更反映出資本市場(chǎng)對(duì)“細(xì)胞衍生物藥物”這一前沿賽道的高度認(rèn)可與長(zhǎng)期信心。
三、技術(shù)與產(chǎn)業(yè)的全方位對(duì)比
以下是基于當(dāng)前公開(kāi)信息和臨床研究進(jìn)展的干細(xì)胞治療漸凍癥(ALS)的國(guó)內(nèi)外對(duì)比分析,主要聚焦于技術(shù)與產(chǎn)業(yè)層面的差距與特點(diǎn):
| ??對(duì)比維度?? | ??國(guó)際前沿 ? | ??國(guó)內(nèi)進(jìn)展 ? |
|---|---|---|
| ??技術(shù)路線?? | ??多元化探索??:包括間充質(zhì)干細(xì)胞、臍血干細(xì)胞、??自體干細(xì)胞等方面。 | ??快速跟進(jìn)與聚焦創(chuàng)新??:以??異體通用型iPSC衍生亞型神經(jīng)前體細(xì)胞??為主,技術(shù)路徑相對(duì)集中,但已在特定領(lǐng)域形成自身特色和優(yōu)勢(shì)。 |
| ??臨床進(jìn)展階段?? | ??領(lǐng)先且進(jìn)入后期??:如美國(guó)BrainStorm公司MSC療法NurOwn已完成Ⅲ期試驗(yàn)(未達(dá)主要終點(diǎn),已重啟ⅢB期) | ??突破與追趕??:士澤生物全球首款iPSC衍生細(xì)胞藥XS228注射液用于治療漸凍癥,于2025年相繼獲??美國(guó)FDA和中國(guó)NMPA批準(zhǔn)開(kāi)展注冊(cè)臨床試驗(yàn)??(I/II期),并已完成包括全球首例患者治療在內(nèi)的臨床研究。 |
| ??監(jiān)管與審批體系?? | ??路徑清晰成熟??:美國(guó)FDA對(duì)細(xì)胞治療產(chǎn)品有相對(duì)成熟的評(píng)審?fù)ǖ溃ㄈ绻聝核庂Y格認(rèn)定、RMAT通道等),審批流程可預(yù)測(cè)性較強(qiáng)。 | ??快速完善中??:中國(guó)NMPA審批在加速,如士澤生物產(chǎn)品同期獲NMPA受理乃至批準(zhǔn),但整體監(jiān)管框架和審評(píng)經(jīng)驗(yàn)仍在持續(xù)積累和探索階段。 |
| ??產(chǎn)業(yè)化與資本推動(dòng)?? | ??資本強(qiáng)力驅(qū)動(dòng)??:由大型藥企或獲得充足風(fēng)險(xiǎn)投資的生物技術(shù)公司主導(dǎo)(如BrainStorm上市融資),投入巨大,目標(biāo)明確指向全球市場(chǎng)上市。 | ??科研與資本結(jié)合驅(qū)動(dòng)??:主要依靠頂尖高校、研究機(jī)構(gòu)與企業(yè)協(xié)同推動(dòng),資本投入規(guī)模和產(chǎn)業(yè)鏈整合能力與國(guó)際巨頭相比仍有差距,但近年來(lái)市場(chǎng)化融資活躍。 |
| ??創(chuàng)新策略與解決方案?? | 前瞻性布局:關(guān)注細(xì)胞替代和免疫豁免策略,旨在徹底解決免疫排斥問(wèn)題。 | ??聚焦細(xì)胞制備:創(chuàng)新主要集中在干細(xì)胞來(lái)源與分化技術(shù),綜合免疫調(diào)控方案布局較少。 |
| ??國(guó)際合作與影響力?? | ??高度全球化??:大型臨床試驗(yàn)(如NurOwn、西達(dá)賽奈)多為全球多中心研究,數(shù)據(jù)具有全球代表性,并與各國(guó)監(jiān)管機(jī)構(gòu)密切溝通,旨在滿足全球標(biāo)準(zhǔn)。 | ??以國(guó)內(nèi)研究為主,國(guó)際化步伐加快??:重大進(jìn)展目前主要基于國(guó)內(nèi)團(tuán)隊(duì)和國(guó)內(nèi)患者,但士澤生物產(chǎn)品獲??FDA孤兒藥資格??并獲批在美臨床,標(biāo)志著國(guó)際化布局開(kāi)啟。 |
四、追趕與超越:我國(guó)的機(jī)遇與挑戰(zhàn)
綜上所述,雖然在干細(xì)胞治療漸凍癥領(lǐng)域,美國(guó)和韓國(guó)兩項(xiàng)Ⅲ期臨床試驗(yàn)進(jìn)展上仍保持階段性領(lǐng)先,但國(guó)內(nèi)差距并不大。
技術(shù)方面,國(guó)內(nèi)以iPSC及干細(xì)胞衍生物為代表的創(chuàng)新路線,能夠規(guī)避傳統(tǒng)干細(xì)胞技術(shù)的一些局限;政策方面,海南博鰲樂(lè)城先行先試經(jīng)驗(yàn)正在逐步向全國(guó)推廣,臨床審批流程有望進(jìn)一步提速。
因此,短期內(nèi)我國(guó)更像是在“快速追趕并打好基礎(chǔ)”。要實(shí)現(xiàn)真正的超越,需要把握三大關(guān)鍵環(huán)節(jié):
- 技術(shù)標(biāo)準(zhǔn)化與放大生產(chǎn):確保干細(xì)胞產(chǎn)品的質(zhì)量穩(wěn)定和可大規(guī)模應(yīng)用。
- 全國(guó)臨床網(wǎng)絡(luò)建設(shè):建立覆蓋多中心、多患者群體的臨床試驗(yàn)體系,以生成高質(zhì)量、可對(duì)比的數(shù)據(jù)。
- 加強(qiáng)國(guó)際合作與數(shù)據(jù)互認(rèn):推動(dòng)國(guó)內(nèi)研究成果與國(guó)際標(biāo)準(zhǔn)接軌,提高全球認(rèn)可度和影響力。
只要這些環(huán)節(jié)落實(shí)到位,我國(guó)在某些技術(shù)路徑上有望實(shí)現(xiàn)“彎道超車”,并讓研究成果更快、更安全地惠及ALS患者。
結(jié)語(yǔ)
對(duì)ALS患者而言,糾結(jié)國(guó)內(nèi)外技術(shù)差距多大意義不大——重要的是全球科學(xué)家都在不斷探索干細(xì)胞療法的可能。無(wú)論美國(guó)、韓國(guó)先一步商業(yè)化,還是國(guó)內(nèi)團(tuán)隊(duì)實(shí)現(xiàn)突破,最終受益的都是那些期待改善運(yùn)動(dòng)能力、延緩病程、提高生活質(zhì)量的患者。每一次技術(shù)進(jìn)步,都在將“改善ALS患者生存和生活”的夢(mèng)想拉近現(xiàn)實(shí)一步。
參考資料:
[1]https://ir.brainstorm-cell.com/2025-05-19-BrainStorm-Receives-FDA-Clearance-to-Initiate-Phase-3b-Trial-of-NurOwn-R-for-ALS?utm_source=chatgpt.com
[2]https://www.prnewswire.com/news-releases/neuronata-r-stem-cell-therapy-shows-promise-in-als-phase-3-subgroup-analysis-moves-toward-fda-accelerated-approval-302468013.html
[3]https://www.houstonchronicle.com/news/houston-texas/education/article/texas-am-saudi-cell-therapy-20347290.php?utm_source=chatgpt.com
[4]https://premierscience.com/wp-content/uploads/2025/04/pjcr-25-812-1.pdf
[5]fda
[6]https://www.sohu.com/a/933359460_121124527
[7]https://mp.weixin.qq.com/s/AmiMmEgnUoYYeNZQsiw3jQ
免責(zé)說(shuō)明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問(wèn),請(qǐng)隨時(shí)聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信