神經退行性疾病(NDs)嚴重影響患者的生活質量,而有效的治療方法仍然有限。由于治療重點在于緩解癥狀,因此通常忽略了問題的根本原因。干細胞具有自我更新和分化成多種細胞系的能力,展現出巨大的潛力,使其成為再生療法(尤其是神經系統疾病)的理想候選者。
間充質干細胞療法在4大神經退行性疾病中的應用:機制、臨床進展與未來展望
2026年1月13日,《Biology and Life Sciences》發表的一篇研究綜述,為間充質干細胞治療神經系統疾病提供了有力證據。該綜述指出,間充質干細胞及其衍生物對多種神經退行性疾病具有疾病修飾作用。在阿爾茨海默病(AD)、帕金森病(PD)、亨廷頓病(HD)和肌萎縮側索硬化癥(ALS)的臨床前研究中,一致觀察到行為學改善、神經炎癥減輕以及神經保護效應。這些作用主要源自MSCs的旁分泌信號,而非直接的細胞替代[1]。
迄今為止的臨床研究一致支持基于MSCs療法的安全性和可行性,但療效信號仍然有限、異質性較高且主要為短期療效,這凸顯了開展更大規模、控制良好的臨床試驗的必要性。
間充質干細胞的顯著優勢與治療基礎
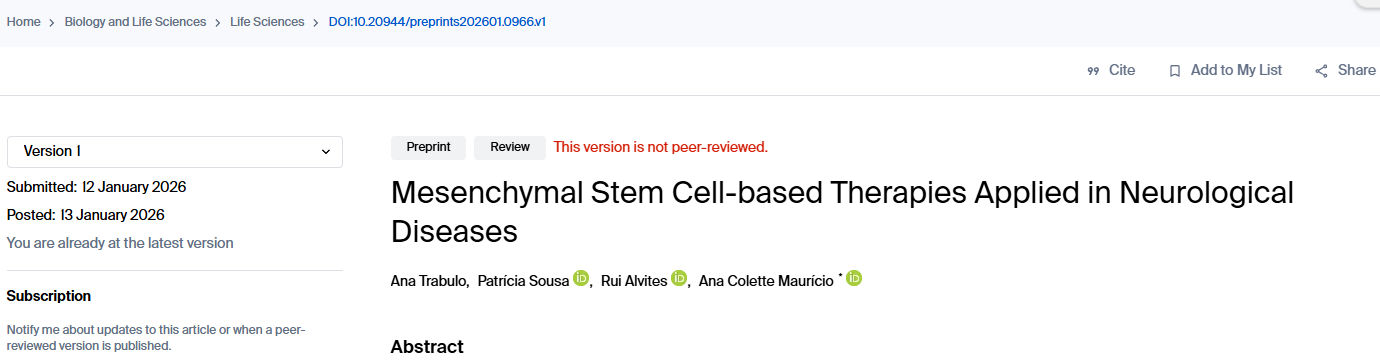
間充質干細胞(MSCs)的核心治療價值在于其三大優勢:來源廣泛且倫理爭議小(可從骨髓、脂肪、臍帶、牙髓等多種組織輕松獲取)、低免疫原性(允許使用異體來源而無需嚴格配型,極大降低了臨床應用門檻)以及作用機制安全高效(圖1)。
其治療作用主要不依賴直接分化替代受損細胞,而是通過強大的旁分泌效應來實現,即分泌一系列生物活性物質(統稱“分泌組”),包括細胞因子(如抗炎因子IL-10)、生長因子(如促進神經生長的BDNF)以及包裹了蛋白質、mRNA和微RNA(miRNA)的細胞外囊泡。這些物質共同起到調節免疫、抑制炎癥、促進血管新生、保護現存細胞并刺激內源性修復的關鍵作用(圖1)。
核心治療載體——細胞外囊泡(EVs)及其靶向遞送優勢
在MSCs的分泌組中,細胞外囊泡(EVs) 因其獨特的納米級囊泡結構,已成為最具前景的“無細胞”治療工具。EVs的核心優勢在于其天然的生物遞送能力:它能夠攜帶母細胞(MSCs)的治療性物質,并有效地穿越體內屏障,尤其是難以逾越的血腦屏障,從而將藥物精準遞送至大腦等中樞神經系統病變部位,解決了傳統大分子藥物難以入腦的難題(圖1)。
然而,EVs的遞送效率并非一成不變,它受到囊泡本身物理特性(如大小、表面電荷)、生化組成(取決于MSCs的來源和培養條件)以及給藥途徑等多種因素的復雜影響,其精確作用機制仍是當前研究的前沿。
在神經退行性疾病中的具體應用機制與前景
基于上述機制,MSCs及其EVs在對抗神經退行性疾病中展現出多方面的治療潛力,其作用因疾病病理特點而有所側重:
- 在阿爾茨海默病(AD)中,主要通過減輕腦內慢性神經炎癥和提供神經營養支持來保護神經元、延緩認知衰退;
- 在帕金森病(PD)中,重點在于釋放神經營養因子(如GDNF),支持殘存的多巴胺能神經元存活并改善其功能;
- 在亨廷頓病(HD)等疾病中,則能激活抗凋亡、抗氧化和神經保護通路。
綜上所述,MSCs及其衍生物(尤其是EVs)集多靶點治療、高安全性、良好遞送潛力及易規模化生產等優點于一身,被視為開發下一代神經退行性疾病療法極具競爭力的候選策略。
下文將根據現有文獻數據,系統討論MSC療法在治療神經退行性疾病中的研究進展、安全性、有效性及相關不良事件。
間充質干細胞針對特定神經系統疾病的療法
由于干細胞具有自我更新、自我復制、再生和分化能力,最近的研究致力于尋找利用干細胞治療神經退行性疾病的有效治療方案。
01、間充質干細胞與阿爾茨海默病(AD)
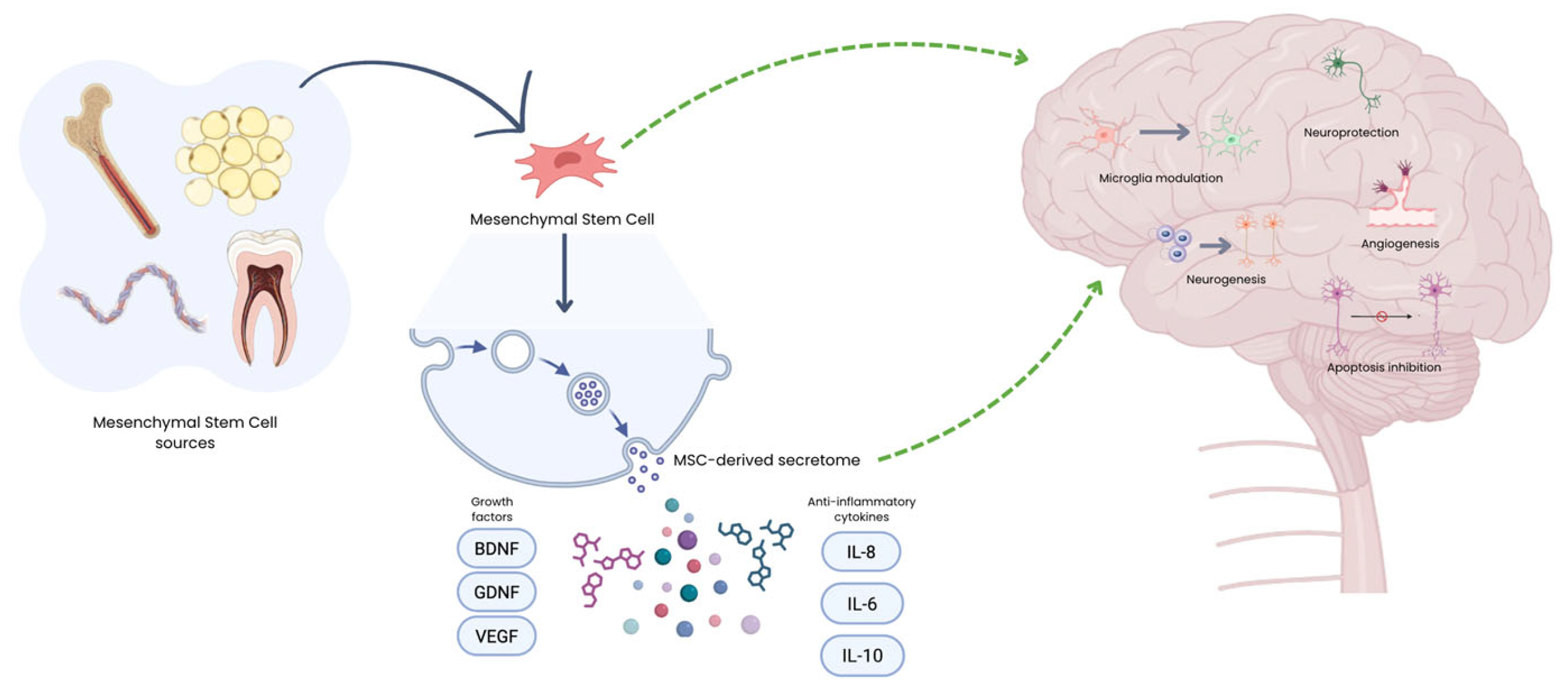
阿爾茨海默病(AD)是神經退行性疾病中最常見的類型之一,主要影響老年人群。臨床上,AD與癡呆癥相關,其特征是進行性記憶喪失和一個或多個認知領域的損害。退行性變主要影響海馬和皮質神經元,包括谷氨酸能和膽堿能神經元群,導致記憶喪失和認知能力下降(圖2) 。
阿爾茨海默病的核心病理機制——一個多層次的惡性循環
阿爾茨海默病的病理核心是β-淀粉樣蛋白(Aβ)和tau蛋白的異常積累,它們通過兩種主要形式造成損害。
第一,不溶性沉積物:Aβ在神經元外形成“老年斑”,tau蛋白在神經元內形成“神經原纖維纏結”,這些固態結構物理性地破壞突觸連接,阻礙神經信號傳遞。
第二,可溶性寡聚體:這些微小、可擴散的Aβ和tau寡聚體毒性更強,能直接嵌入神經元膜,破壞其完整性,干擾線粒體功能,并異常影響神經遞質釋放。
關鍵的是,這兩種形式共同觸發了一個自我強化的“炎癥循環”:它們被大腦的免疫細胞(小膠質細胞和星形膠質細胞)識別,導致其持續過度激活,釋放大量炎癥因子和神經毒性物質,這種慢性神經炎癥反過來又加速了神經元損傷和更多病理性蛋白的生成,形成了驅動疾病進展的核心惡性循環。
傳統療法的困境與間充質干細胞治療的多靶點新策略
針對上述核心病理,傳統的“單一靶點”療法(如直接清除Aβ或tau蛋白的抗體藥物)在大型臨床試驗中均告失敗,凸顯了僅干預疾病鏈條中一個環節的局限性。因此,研究轉向了具有多靶點、多功能特性的間充質干細胞(MSCs)及其衍生物(如外泌體)。
臨床前研究(動物實驗)清楚地揭示了其作用機制
它們并非直接“替換”神經元,而是作為一個生物反應調節系統,通過分泌多種活性因子,同時執行“清除”(促進Aβ降解)、“滅火”(抑制小膠質細胞過度活化,減輕神經炎癥)、“修復”(提供神經營養支持,保護突觸功能)和“調節”(改善細胞自噬與凋亡平衡) 等多重任務,從而從多個環節上打破上述的病理惡性循環。
臨床轉化現狀——從明確的有效性到初步的安全性,未來挑戰明確
目前,MSCs治療AD的轉化醫學證據呈現清晰的兩個階段。在臨床前階段,證據高度一致且積極,多種動物模型均證實MSCs能顯著改善認知并減輕核心病理。
然而,在臨床階段,當前已完成和進行中的早期試驗(I/II期)主要核心結論是證明了多種給藥途徑(如腦室內注射、鼻內給藥)的安全性、可行性和良好耐受性。在療效方面,僅在一些探索性分析中觀察到了令人鼓舞的初步跡象,如特定劑量組出現認知改善減緩、海馬體萎縮減慢等。
因此,結論非常明確:MSCs療法已成功跨越了臨床轉化的第一道關卡(安全性),但其確鑿的臨床療效尚未得到大規模驗證,必須通過設計更嚴謹、規模更大、隨訪期更長的II/III期隨機對照試驗來最終確定其治療價值。
02、間充質干細胞治療帕金森病(PD)
帕金森病的核心病理與診斷困境
帕金森病(PD)是第二常見的神經退行性疾病,其核心病理生理機制是錯誤折疊的α-突觸核蛋白在神經元內異常積聚,形成路易體和路易神經突。這導致以黑質紋狀體通路多巴胺能神經元選擇性喪失,進而引發運動障礙。
值得注意的是,α-突觸核蛋白病理在中樞神經系統內分布廣泛,使得PD具有高度異質性。目前臨床診斷僅為“可能”PD,確診仍需死后腦組織病理檢查,這凸顯了該蛋白在發病中的中心地位及當前診斷手段的局限。
MSCs通過分泌組發揮多靶點疾病修飾作用的臨床前證據
臨床前研究一致表明,間充質干細胞(MSCs)對PD的治療作用主要依賴其旁分泌功能,而非細胞直接替代。其分泌組(含神經營養因子和細胞外囊泡EVs)能發揮多靶點疾病修飾作用:
- 1)對抗核心病理:抑制α-突觸核蛋白的異常聚集,降低其水平;
- 2)神經保護與修復:支持多巴胺能神經元存活,保護黑質和紋狀體神經元;
- 3)免疫調節:調節小膠質細胞的過度激活,減輕神經炎癥。在多種PD動物模型(毒素誘導或α-突觸核蛋白過表達)中,MSC-EV治療能持續改善運動功能、降低炎癥因子水平,且療效可維持數周至數月,為臨床應用提供了堅實的機制與療效基礎。
早期臨床試驗證實安全性并提示潛在療效趨勢
早期臨床研究(多為I/II期試驗)探索了不同來源(骨髓、脂肪)和不同途徑(靜脈、鼻內、腦內/動脈內注射)的MSC移植。綜合現有數據,結論明確分為兩層:
第一,安全性得到廣泛證實——無論是自體還是異體MSCs,多種給藥方式均表現出良好的安全性和耐受性,僅報告輕微或短暫的不良事件,未發現免疫排斥、致瘤性或MRI異常等嚴重問題。
第二,療效呈現積極但初步的趨勢——多項試驗報告了患者運動癥狀(UPDRS評分)的短期改善,部分研究還觀察到左旋多巴用量減少或病情穩定。然而,這些試驗大多樣本量有限,缺乏長期隨訪和嚴格的對照組,因此目前證據主要確立了MSC療法的安全性,其確切的臨床療效仍需通過大規模、隨機雙盲的III期臨床試驗來最終驗證。
03、間充質干細胞治療亨廷頓舞蹈癥(HD)
亨廷頓舞蹈癥的復雜病理機制與MSCs的間接治療策略
亨廷頓舞蹈癥是一種由亨廷頓基因CAG重復異常擴增導致的常染色體顯性遺傳病,致病根源是神經毒性的突變型亨廷頓蛋白。該病主要引起紋狀體GABA能神經元進行性變性,病理生理涉及興奮性毒性、線粒體功能障礙、氧化應激、神經營養因子缺乏及慢性神經炎癥等多重交織的通路。
當前MSCs治療策略并非直接糾正遺傳缺陷,而是旨在全面干預這些下游的共通致病通路,以對抗神經退行性變。
臨床前研究的積極證據與明確的旁分泌作用機制
大量臨床前研究(超過15項嚙齒動物模型實驗)一致表明,移植MSCs(如骨髓或牙髓來源)能帶來顯著的功能和結構性改善。這些益處包括:增加紋狀體體積、減少腦室擴大、以及顯著改善運動協調性等行為學指標,但對認知功能的改善作用有限。
在機制上,MSCs主要通過旁分泌信號發揮作用,而非直接分化為神經元。其分泌的神經營養因子(特別是腦源性神經營養因子BDNF)能上調內源性支持,同時有效抑制細胞凋亡、調節小膠質細胞活性以減輕神經炎癥。
為進一步增強療效,基因工程改造的MSCs(如過表達BDNF的MSC/BDNF) 已顯示出更強大的效果,包括更顯著的神經保護作用和延長模型動物生存期。此外,鼻內給藥作為一種非侵入性方式,已被證實能將MSCs有效靶向遞送至紋狀體,具有重要的轉化應用前景。
臨床轉化處于早期階段,安全性與初步探索并行
目前,MSCs治療HD的臨床轉化仍處于初步探索階段,人體數據非常有限。現有的早期研究主要聚焦于兩個方面:
- 一是為后續細胞治療試驗奠定基礎,如PRE-CELL研究旨在確定合適的臨床和影像學終點;
- 二是評估初步的安全性與可行性,例如巴西正在進行的試驗探索重復全身輸注MSCs的長期安全性及潛在的神經保護作用。
總體而言,現有證據表明該療法具有良好的前景和安全性,但在臨床上尚無確鑿的療效結論。未來方向,特別是利用工程化MSCs進行神經營養因子靶向遞送的策略,正在成為頗具潛力的重點研究領域,但其最終治療價值有待嚴格設計的臨床試驗驗證。
04、間充質干細胞治療肌萎縮側索硬化癥(ALS)
肌萎縮側索硬化癥(ALS)的核心特征與復雜的致病網絡
肌萎縮側索硬化癥是一種致命的進行性神經退行性疾病,核心病理是控制隨意肌的運動神經元選擇性喪失。約90%病例為散發性。其病因不明,涉及一個多因素交織的致病網絡,包括蛋白質異常聚集、RNA代謝失調、興奮性毒性、氧化應激、線粒體功能障礙及慢性神經炎癥等,共同導致運動神經元死亡,臨床表現為進行性肌無力、萎縮、延髓麻痹及最終呼吸衰竭。
MSCs通過旁分泌機制在臨床前研究中展現多靶點神經保護作用
臨床前研究(如SOD1突變小鼠模型)的系統評價表明,間充質干細胞移植能顯著延緩疾病發病、減緩進展并延長生存期。其治療益處主要源于旁分泌作用,而非細胞替代。
MSCs分泌的多種神經營養因子(如BDNF、GDNF、VEGF)和抗炎細胞因子,共同發揮多靶點保護效應:
- 1)直接營養支持:增強運動神經元存活能力;
- 2)免疫調節:抑制小膠質細胞和T細胞的過度活化,減輕神經炎癥;
- 3)抵抗損傷:幫助神經元對抗興奮性毒性和氧化應激,從而在動物模型中有效維持運動功能。
臨床試驗證實安全性,并顯示有限但具提示性的療效信號
早期I/II期臨床試驗(通過鞘內、靜脈或脊髓內途徑)一致證實了MSC移植在ALS患者中的良好安全性和耐受性,未報告嚴重毒性或腫瘤形成。一些研究觀察到治療后肌萎縮側索硬化癥功能評定量表(ALSFRS)下降速度暫時減緩、肺功能穩定等初步積極信號。
然而,一項針對基因工程改造的神經營養因子遞送MSCs(MSC-NTF)的III期隨機對照試驗未能達到主要療效終點。盡管次要終點(如腦脊液中炎癥和神經營養標志物的改善)和疾病較輕亞組的分析顯示了具有名義統計學意義的有限臨床改善,但這證實了其生物學活性,也表明目前的MSC療法在ALS中雖能帶來可測量的病理改善,但轉化為顯著臨床獲益的能力仍然有限,凸顯了進一步優化治療策略的必要性。
結論與未來方向
本綜述系統介紹了間充質干細胞療法在阿爾茨海默病、帕金森病、亨廷頓病和肌萎縮側索硬化癥這四大神經退行性疾病中的治療進展。盡管在早期臨床試驗中取得了顯著進展,尤其是安全性得到初步驗證,但后期關鍵試驗的缺乏凸顯了進一步深入研究的必要性。
新興策略正在積極應對現有挑戰:通過對MSCs進行預處理、基因工程改造和生產工藝標準化,旨在提高其存活率、歸巢能力與分泌活性。同時,對MSC來源的細胞外囊泡的興趣日益濃厚,它作為一種“無細胞”療法,保留了MSCs的旁分泌益處,并可能克服安全性、可擴展性和遞送方面的限制。此外,日益重視生物標志物指導的患者選擇和早期干預,有助于未來試驗更精準地識別潛在獲益人群。
未來的研究應致力于擴大臨床試驗的規模與病種范圍,并著力解決EVs生產的規模化與標準化問題。隨著對EVs療法興趣的增長、相關技術的進步以及對其治療機制的深入理解,神經退行性疾病的治療格局有望迎來革命性發展。這些進展或將推動更精準、高效、微創的治療手段的誕生,最終改善神經退行性疾病患者的臨床預后。
參考資料:
[1]:Trabulo, A.; Sousa, P.; Alvites, R.; Maurício, A. C. Mesenchymal Stem Cell-based Therapies Applied in Neurological Diseases. Preprints 2026, 2026010966. https://doi.org/10.20944/preprints202601.0966.v1
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信