由于神經(jīng)組織再生能力有限,中樞神經(jīng)系統(tǒng) (CNS) 疾病的治療面臨嚴(yán)峻挑戰(zhàn),導(dǎo)致許多患者長(zhǎng)期殘疾。因此,開(kāi)發(fā)新型治療策略刻不容緩。
干細(xì)胞療法憑借其多方面的特性,包括抗凋亡、抗炎、神經(jīng)源性和血管生成作用,在減輕腦損傷和恢復(fù)神經(jīng)連接方面展現(xiàn)出巨大潛力。近期研究還發(fā)現(xiàn),外泌體(由干細(xì)胞分泌的、被脂質(zhì)雙層包裹的小囊泡)是干細(xì)胞療法療效的關(guān)鍵機(jī)制。由于外泌體比干細(xì)胞本身具有更高的穩(wěn)定性和更優(yōu)異的血腦屏障通透性,外泌體已成為治療中樞神經(jīng)系統(tǒng)疾病的一種有前景的替代療法。
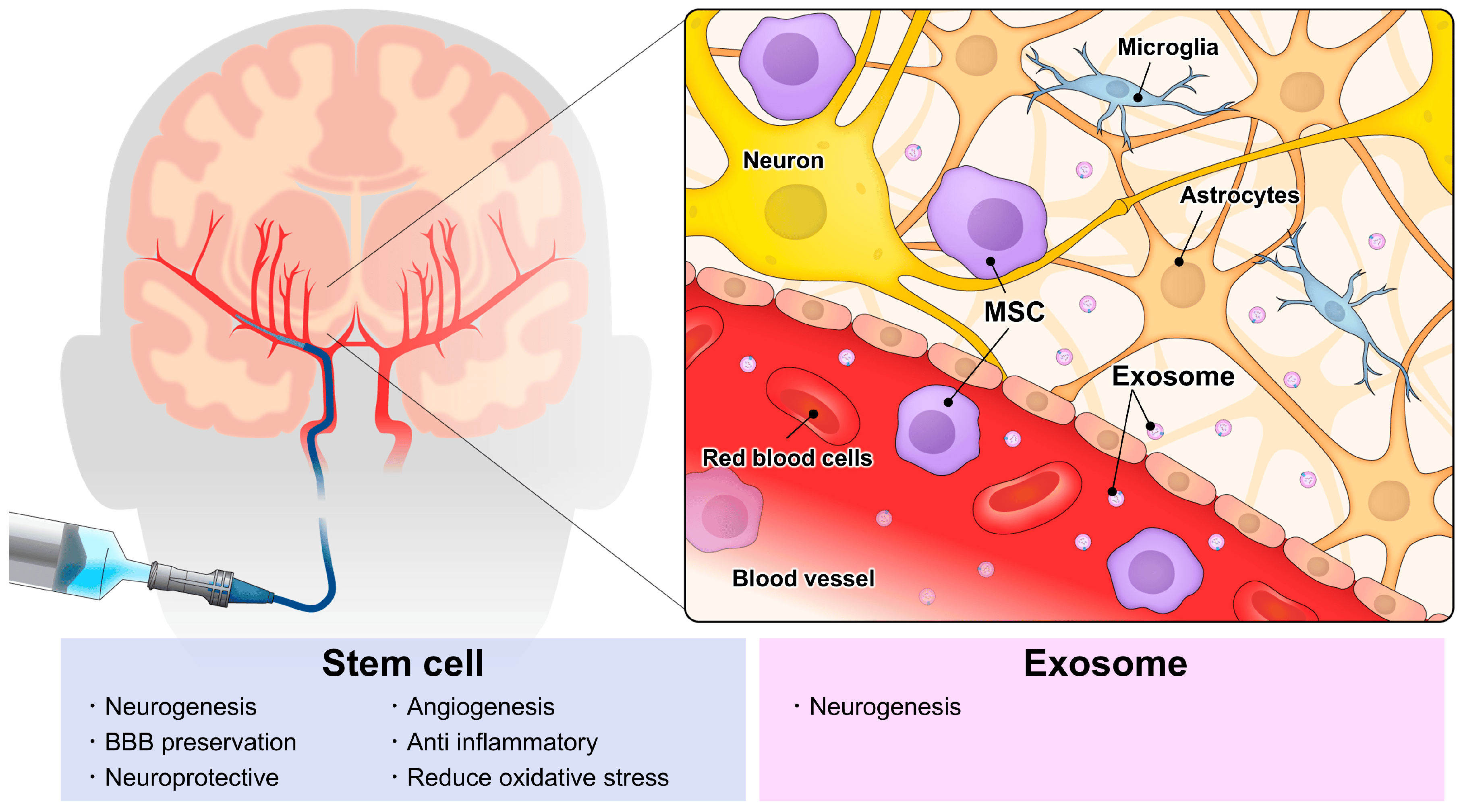
給藥方式的選擇成為關(guān)鍵挑戰(zhàn):干細(xì)胞療法和外泌體療法在中樞神經(jīng)系統(tǒng)疾病中的應(yīng)用面臨的一個(gè)關(guān)鍵挑戰(zhàn)是給藥方式。目前正在研究多種給藥途徑,包括腦內(nèi)、鞘內(nèi)、靜脈內(nèi)、鼻內(nèi)和動(dòng)脈內(nèi)給藥。
腦內(nèi)注射雖能直達(dá)病灶但存在二次損傷風(fēng)險(xiǎn),靜脈移植創(chuàng)傷小卻因血腦屏障限制導(dǎo)致腦部有效劑量不足;而動(dòng)脈內(nèi)移植憑借導(dǎo)管技術(shù)進(jìn)步實(shí)現(xiàn)突破——既能高效輸送足量治療物質(zhì)入腦,又顯著降低侵入性損傷,成為當(dāng)前最具前景的策略。不過(guò),該領(lǐng)域研究仍處早期階段,需進(jìn)一步驗(yàn)證其安全性與療效的優(yōu)化平衡。
動(dòng)脈注射干細(xì)胞&外泌體治療神經(jīng)系統(tǒng)疾病,打多少細(xì)胞合適?什么時(shí)候移植好?
近日,北海道大學(xué)醫(yī)學(xué)研究生院神經(jīng)外科在國(guó)際醫(yī)學(xué)期刊雜志《干細(xì)胞研究:推進(jìn)科學(xué)與醫(yī)學(xué)》上發(fā)表了一篇“動(dòng)脈內(nèi)注射干細(xì)胞和外泌體治療中樞神經(jīng)系統(tǒng)疾病”的研究綜述[1]。

在本綜述中,我們總結(jié)了針對(duì)中樞神經(jīng)系統(tǒng)疾病的干細(xì)胞及其外泌體的動(dòng)脈內(nèi)給藥,重點(diǎn)關(guān)注基礎(chǔ)和臨床研究,以闡明其功效和作用機(jī)制,以及它們的局限性和未來(lái)應(yīng)用。
方法:在PubMed( https://www.ncbi.nlm.nih.gov/pubmed)上進(jìn)行了文獻(xiàn)檢索,以確定關(guān)于中樞神經(jīng)系統(tǒng)疾病動(dòng)脈內(nèi)干細(xì)胞或外泌體給藥的研究文章。搜索使用的關(guān)鍵詞是“動(dòng)脈內(nèi)”、“干細(xì)胞”、“外泌體或細(xì)胞外囊泡”和“腦”。搜索中包含的文章要求用英文撰寫(xiě),與中樞神經(jīng)系統(tǒng)疾病相關(guān),并且特別側(cè)重于干細(xì)胞和外泌體,而其他文章則被排除在外。
此外,我們還查看了初步搜索中選定的論文中引用的參考文獻(xiàn)。文章的選擇和數(shù)據(jù)收集由其中一位作者 (TH) 完成。收集的數(shù)據(jù)涵蓋各種疾病模型、細(xì)胞和外泌體來(lái)源、動(dòng)物模型、劑量、治療持續(xù)時(shí)間和標(biāo)記方法。
干細(xì)胞及外泌體IA移植治療中樞神經(jīng)系統(tǒng)疾病的總體結(jié)果
共選定87篇符合本評(píng)論目標(biāo)的文章;共選取71篇利用干細(xì)胞進(jìn)行動(dòng)脈內(nèi)治療的臨床前研究文章,4篇文章被選為使用外泌體進(jìn)行IA治療的臨床前研究,12篇文章被選為通過(guò)IA治療使用干細(xì)胞的臨床研究。
在所審查的71篇研究中,大多數(shù)(57篇,82%)側(cè)重于缺血性卒中。其余研究探討了創(chuàng)傷性腦損傷、膠質(zhì)瘤、腦出血、阿爾茨海默病、帕金森病以及與動(dòng)脈內(nèi)(IA)移植相關(guān)的并發(fā)癥分析。這種分布是由于腦動(dòng)脈阻塞是缺血性卒中的主要機(jī)制,因此通過(guò)相同的治療途徑同時(shí)治療腦部和血管是合理的。在本小節(jié)中,作者總結(jié)了與每種疾病相關(guān)的臨床前數(shù)據(jù)。
細(xì)胞治療7大中樞神經(jīng)系統(tǒng)疾病的臨床前研究
缺血性中風(fēng)的定義、負(fù)擔(dān)與當(dāng)前治療局限:缺血性中風(fēng)由腦血管閉塞引起,導(dǎo)致腦組織缺氧缺糖,是全球致殘的主因、第三大死因(占死亡10.7%)和第四大DALY損失原因(占5.6%)。標(biāo)準(zhǔn)急性期治療(如4.5小時(shí)內(nèi)溶栓或取栓)旨在恢復(fù)血流、挽救缺血半暗帶,但即使血管成功再通,約50%患者仍遺留神經(jīng)功能缺損。因此,探索動(dòng)脈內(nèi)移植干細(xì)胞或外泌體成為減輕后遺癥的新策略。
干細(xì)胞治療的細(xì)胞來(lái)源多樣性:干細(xì)胞來(lái)源是干細(xì)胞治療的關(guān)鍵因素(圖1)。在分析的57項(xiàng)研究中,51%使用人源細(xì)胞,49%使用動(dòng)物同種異體細(xì)胞。人源細(xì)胞中,骨髓來(lái)源(BMSC/BMMNC)占主導(dǎo)(52%),其次為臍帶(22%)和羊膜(10%)間充質(zhì)干細(xì)胞等。
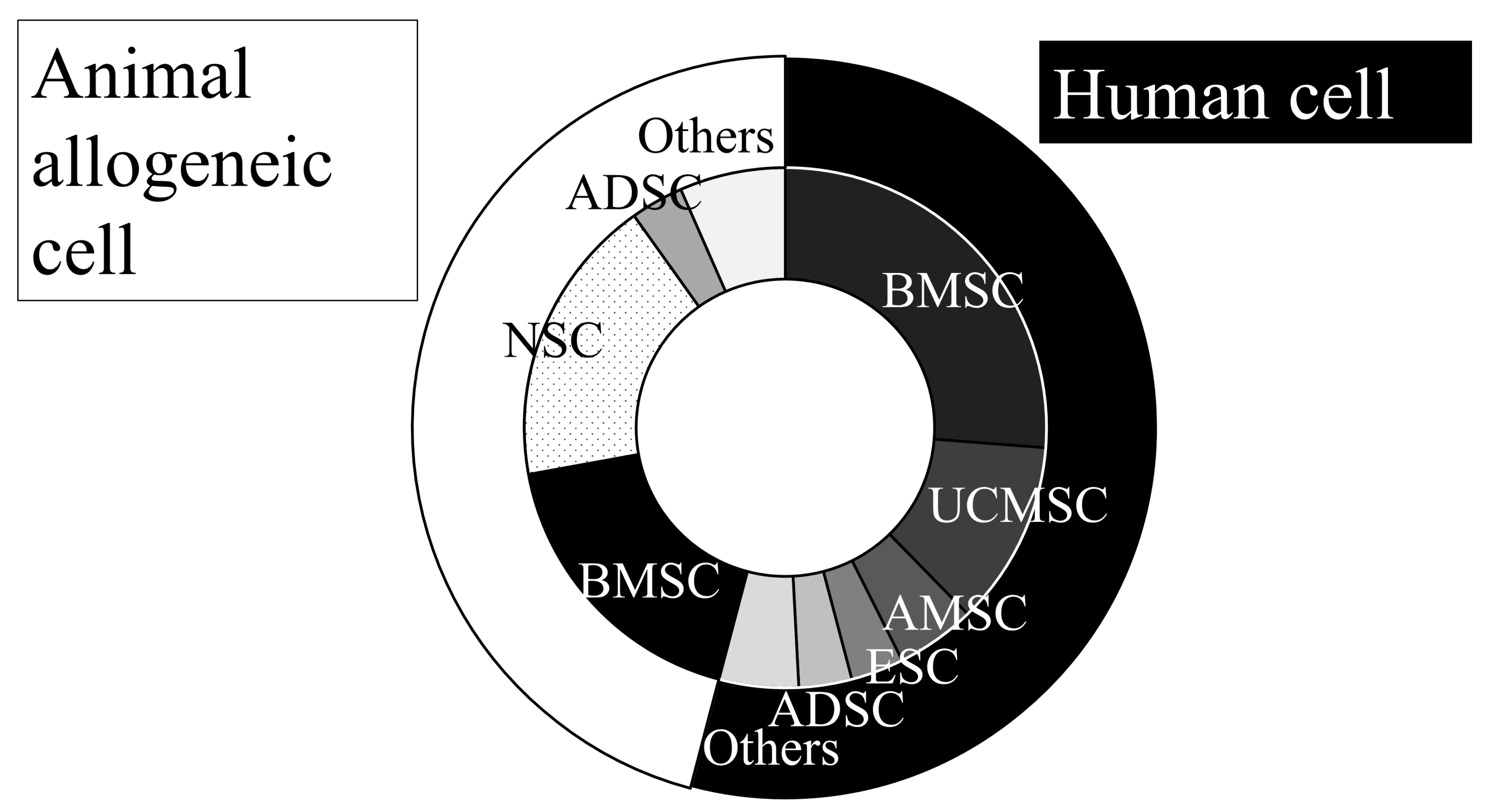
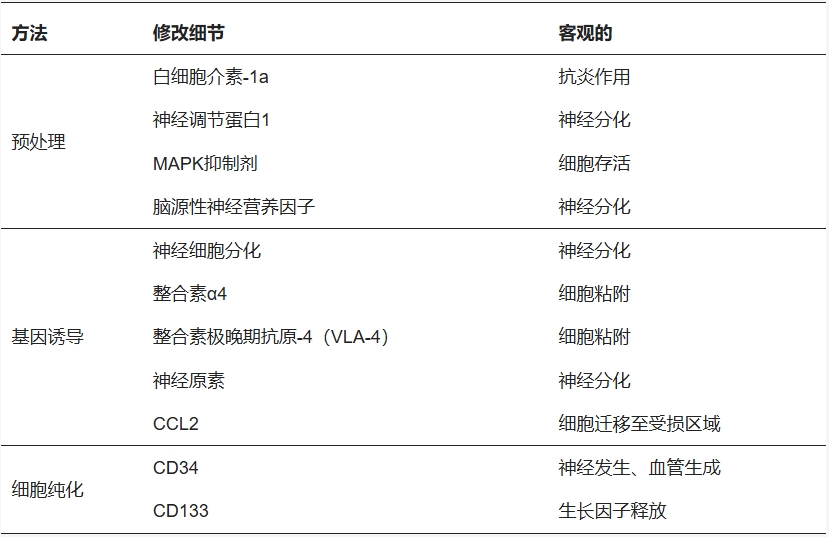
動(dòng)物細(xì)胞中,40%為骨髓來(lái)源,40%為胎兒腦源性神經(jīng)干細(xì)胞(NSC)/神經(jīng)嵴干細(xì)胞(后者獲取困難)。71%研究使用未修飾干細(xì)胞,其余則通過(guò)預(yù)處理、基因改造或純化以增強(qiáng)功效(表1),主要聚焦于:促進(jìn)神經(jīng)分化、改善細(xì)胞遷移/植入、或上調(diào)營(yíng)養(yǎng)因子/抗炎作用,但修飾可能增加成本且臨床價(jià)值待定。
不同細(xì)胞來(lái)源特性的關(guān)鍵比較發(fā)現(xiàn):研究比較了不同細(xì)胞特性:同位素標(biāo)記顯示,人源細(xì)胞在動(dòng)物模型中比動(dòng)物同種異體細(xì)胞清除更快(6小時(shí)內(nèi)放射性顯著下降),提示免疫排斥風(fēng)險(xiǎn),警示動(dòng)物數(shù)據(jù)外推至人需謹(jǐn)慎。
不同細(xì)胞類(lèi)型(如神經(jīng)嵴干細(xì)胞NCSCvsBMSC)表達(dá)獨(dú)特神經(jīng)營(yíng)養(yǎng)因子譜(NCSC高表達(dá)BDNF、巢蛋白等,BMSC表達(dá)GDNF),暗示恢復(fù)機(jī)制差異并需明確最優(yōu)因子組合。此外,供體年齡顯著影響療效,年輕BMSC比年老者更能促進(jìn)神經(jīng)發(fā)生和血管生成。
核心問(wèn)題:打多少細(xì)胞合適?
在缺血性中風(fēng)動(dòng)物模型中,動(dòng)脈內(nèi)注射干細(xì)胞治療時(shí),多少細(xì)胞數(shù)量(劑量)是既安全又有效的? 劑量過(guò)高可能導(dǎo)致血管阻塞,過(guò)低則可能效果不足。
從動(dòng)物實(shí)驗(yàn)里我們看到了啥:劑量亂得很,還有個(gè)“體重反常識(shí)”:不同研究用的劑量差別巨大(從少得可憐的0.4到嚇人的1333×10?個(gè)細(xì)胞/公斤都有)(圖2)。
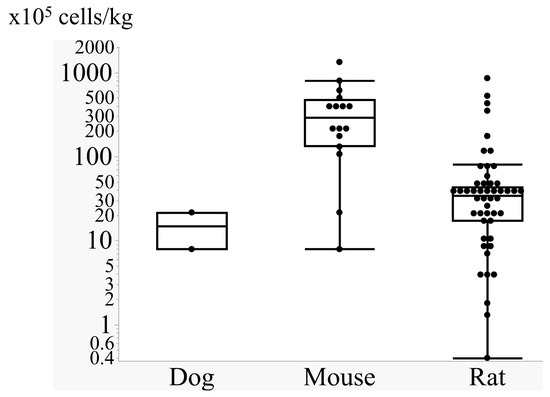
有意思的是,體型越大的動(dòng)物,每公斤體重打的細(xì)胞反而越少! 比如:
- 小鼠:大概200×10?個(gè)細(xì)胞/公斤
- 大鼠:降到50×10?個(gè)細(xì)胞/公斤
- 狗:只要10×10?個(gè)細(xì)胞/公斤
為啥會(huì)這樣:很可能是因?yàn)楹芏鄬?shí)驗(yàn)圖省事,不管動(dòng)物大小,都打一個(gè)固定總數(shù)(比如100萬(wàn)個(gè)細(xì)胞)。結(jié)果大動(dòng)物分?jǐn)傁聛?lái),每公斤的劑量就小了。
打多了真危險(xiǎn)(安全是紅線(xiàn)):好幾項(xiàng)研究都敲警鐘了:劑量一高,血管堵住的風(fēng)險(xiǎn)就蹭蹭漲。
- Fukuda那組發(fā)現(xiàn):給大鼠打高劑量BMSC (36.4×10?個(gè)細(xì)胞/公斤),死亡率 (39%) 比低劑量組 (27%) 和對(duì)照組 (33%) 都高,而且顯微鏡下看到更多微血管堵了。
- Yavagal團(tuán)隊(duì)直接測(cè)腦血流,發(fā)現(xiàn)≤3.5×10?個(gè)細(xì)胞/公斤這個(gè)量,基本不影響血流。超過(guò)這個(gè)數(shù),風(fēng)險(xiǎn)就來(lái)了。
- Cui的實(shí)驗(yàn)也支持:在減少血流下降方面,低劑量 (10×10?) 比高劑量 (20和40×10?) 強(qiáng)。
- 連MRI都拍到了:大劑量 (26×10?) 會(huì)導(dǎo)致動(dòng)脈堵住和腦損傷,小劑量 (1和8×10?) 就沒(méi)事。
結(jié)論很明確:高劑量是安全的主要威脅,微血管阻塞是頭號(hào)敵人。有個(gè)大概的安全上限在3.5×10?個(gè)細(xì)胞/公斤左右(但這不是絕對(duì)的)。
效果呢?矛盾不少(療效窗口難找):低劑量可能有點(diǎn)用,但怕不夠:Fukuda那極低劑量 (0.4×10?) 也比沒(méi)打好,但顯然不是最優(yōu)。
高劑量有時(shí)效果更強(qiáng),但危險(xiǎn)相伴:
- Greggio在圍產(chǎn)期腦損傷模型里發(fā)現(xiàn),超高劑量 (500×10?) 比低劑量 (50×10?) 恢復(fù)更好、損傷更小。
- Yang也看到,高劑量 (300×10?) 比低劑量 (10×10?) 效果好。
- 甚至Wong用特殊處理過(guò)的細(xì)胞,在中等劑量 (40×10?) 下還能短暫提升點(diǎn)血流(可能是細(xì)胞釋放的VEGF起作用)。
怎么解釋這些矛盾:“最佳劑量”可能沒(méi)有標(biāo)準(zhǔn)答案!它高度依賴(lài)你用的是哪種干細(xì)胞、做的是哪種中風(fēng)模型(成年急性vs圍產(chǎn)期)、病得多重、以及你具體看什么恢復(fù)指標(biāo)。
本質(zhì)上是在走鋼絲:劑量太低,效果不顯著;劑量太高,堵塞的風(fēng)險(xiǎn)就把好處全抵消了,甚至更糟。得在安全和有效之間找個(gè)微妙的平衡點(diǎn)。
怎么打也很關(guān)鍵(不只是數(shù)量問(wèn)題):
- 濃度和速度:Cui發(fā)現(xiàn),同樣是20×10?個(gè)細(xì)胞/公斤,用高濃度溶液(0.5mL)還慢慢打(6分鐘),比用低濃度溶液(1mL)快點(diǎn)打(3分鐘)效果差很多。高濃度+慢速更容易讓細(xì)胞堆在一起堵住。
- 保持血流暢通:Chua和Ge都強(qiáng)調(diào),注射時(shí)讓頸動(dòng)脈的血一直流著,比暫時(shí)把血流掐斷,恢復(fù)得更好。
- 細(xì)胞個(gè)頭大小:Ge發(fā)現(xiàn)細(xì)胞大小太關(guān)鍵了!?用>30μm的大細(xì)胞,妥妥地堵血管造成急性損傷;用≤17μm的小細(xì)胞,就安全多了。小細(xì)胞是王道。
總結(jié)一下關(guān)鍵信息:
- 劑量是雙刃劍,安全是底線(xiàn)。微血管阻塞是最大的安全顧慮,高劑量風(fēng)險(xiǎn)顯著(死亡率、血流減少、腦損傷加重)。動(dòng)物數(shù)據(jù)指向≈3.5×10?個(gè)細(xì)胞/公斤可能是個(gè)相對(duì)安全的上限(但非絕對(duì))。
- 效果很“玄學(xué)”。有效劑量范圍很寬,從很低到很高都有報(bào)道有效。但效果特別好的劑量,往往離那個(gè)安全上限很近甚至踩線(xiàn)了,得特別小心。最佳劑量真得看具體情況(細(xì)胞類(lèi)型、模型、目標(biāo))。
- “怎么打”和“打什么”一樣重要!?想安全:優(yōu)先選小細(xì)胞(<17-30μm),把細(xì)胞稀釋開(kāi),打得快一點(diǎn),確保注射時(shí)血流別停。這些操作能大大降低堵血管的風(fēng)險(xiǎn)。
- 人類(lèi)移植干細(xì)胞的量用多少:依據(jù)斯坦福大學(xué)Ⅰ/Ⅱa期試驗(yàn)顯示,2000萬(wàn)劑量組在12個(gè)月時(shí)運(yùn)動(dòng)功能評(píng)分(FMMS)提升最顯著(總分↑12.1分),且影像學(xué)證實(shí)神經(jīng)連接增強(qiáng),安全性良好(僅輕微頭痛等自限性不良事件)。推薦劑量:2000萬(wàn)神經(jīng)干細(xì)胞(NR1)。
- 未來(lái)關(guān)鍵:開(kāi)發(fā)優(yōu)化整個(gè)細(xì)胞輸送方案(包括精確劑量、理想細(xì)胞特性、最佳注射參數(shù)),核心目標(biāo)是最大限度避免動(dòng)脈阻塞,這是改善治療效果和安全性的基石。
簡(jiǎn)而言之:細(xì)胞劑量不是越多越好。必須在“有效劑量”和“安全劑量(避免堵塞)”之間找到精細(xì)的平衡點(diǎn),同時(shí)注射方式(細(xì)胞大小、濃度、速度、血流)的優(yōu)化對(duì)安全性至關(guān)重要。目前尚無(wú)明確答案,但避免阻塞是核心原則。
干細(xì)胞移植治療缺血性腦中風(fēng)的移植時(shí)機(jī)
移植時(shí)機(jī)因研究而異,從血管再通后立即移植到第14天不等(圖3)。最常見(jiàn)的移植時(shí)機(jī)是在第1天,其次是1-6小時(shí)和2-3天。
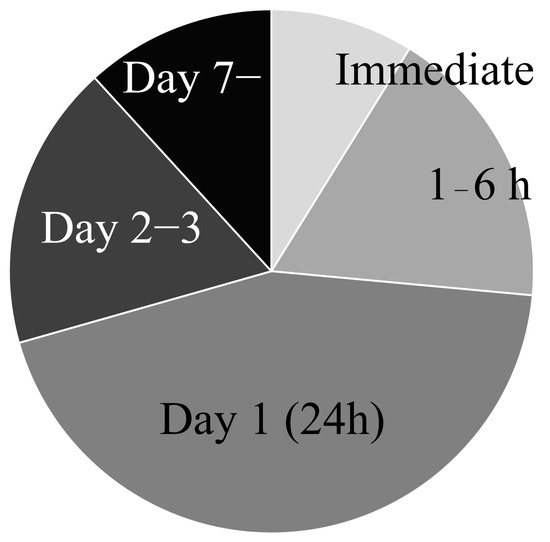
“越快越好”不適用于干細(xì)胞移植:雖然中風(fēng)后血管再通強(qiáng)調(diào)盡早(如血栓切除術(shù)),但干細(xì)胞移植卻并非如此。研究發(fā)現(xiàn),超早期移植(如再通后1-6小時(shí)內(nèi))效果反而較差。Toyoshima等明確指出,再通后24小時(shí)移植比1小時(shí)或6小時(shí)移植能帶來(lái)更好的功能恢復(fù)和更多的腦內(nèi)細(xì)胞植入。這很可能是因?yàn)橹酗L(fēng)后早期(約4小時(shí)內(nèi))血腦屏障功能尚存,阻礙了細(xì)胞進(jìn)入受損腦組織。
其他研究也支持24小時(shí)移植優(yōu)于更早時(shí)間點(diǎn)(如1小時(shí)),并且Rosenblum等觀(guān)察到細(xì)胞植入在第3天達(dá)到峰值,其次是第1天。這些都表明,過(guò)早移植時(shí)不利的腦部環(huán)境限制了干細(xì)胞療效。
亞急性期可能是“黃金窗口”,但具體時(shí)間點(diǎn)存在彈性:綜合多項(xiàng)研究,移植的最佳時(shí)機(jī)窗口可能在再通后24小時(shí)至72小時(shí)(1-3天)左右。這個(gè)亞急性期似乎避開(kāi)了超早期的屏障阻礙,又抓住了恢復(fù)的關(guān)鍵階段。
不過(guò),具體時(shí)間點(diǎn)并非絕對(duì)僵化。Mitkari等發(fā)現(xiàn)第2天和第7天移植都比對(duì)照組好,且第7天還能增強(qiáng)血管生成;而Ishizaka等則顯示較早時(shí)間點(diǎn)(1、4、7天)都有效,且第1天效果優(yōu)于第4天和第7天。這些差異提示最佳時(shí)機(jī)可能受細(xì)胞類(lèi)型、模型等因素影響。
總之,避開(kāi)超早期、選擇再通后1-3天進(jìn)行移植是目前動(dòng)物實(shí)驗(yàn)支持的有效策略,但確切的機(jī)制和最優(yōu)化方案仍需深入研究。
干細(xì)胞移植核心再生機(jī)制:重建受損神經(jīng)與血管網(wǎng)絡(luò)
干細(xì)胞移植主要通過(guò)促進(jìn)神經(jīng)再生和血管新生來(lái)修復(fù)腦損傷(表2)。
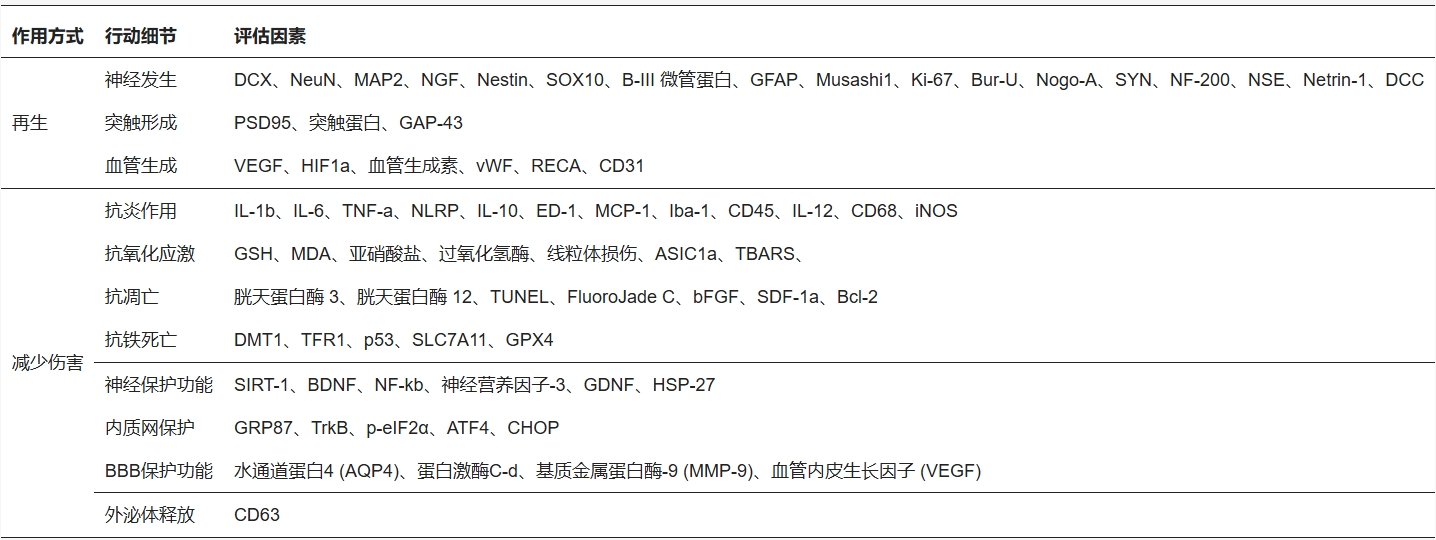
最關(guān)鍵的是神經(jīng)發(fā)生:移植細(xì)胞不僅能直接變成神經(jīng)元,更能加速大腦自身產(chǎn)生新神經(jīng)細(xì)胞的過(guò)程,幫助這些新生細(xì)胞成熟并遷移到損傷區(qū)域。
同時(shí),突觸發(fā)生(形成新的神經(jīng)連接)和血管生成也被顯著促進(jìn)。血管生成尤其重要,它既可以通過(guò)干細(xì)胞直接變成血管細(xì)胞,也能通過(guò)干細(xì)胞釋放的VEGF等因子刺激原有血管生長(zhǎng),從而恢復(fù)局部血流和供氧。有趣的是,不同腦區(qū)(如紋狀體、皮質(zhì)、海馬)對(duì)血管生成的響應(yīng)方式存在差異。
關(guān)鍵減損機(jī)制:保護(hù)腦組織并抑制損傷進(jìn)程:除了重建,干細(xì)胞還能有效減輕和阻止中風(fēng)后的繼發(fā)性損傷。這包括強(qiáng)大的抗炎作用,能平息損傷部位的炎癥風(fēng)暴;以及減少氧化應(yīng)激(有害自由基)、抑制細(xì)胞凋亡(程序性細(xì)胞死亡)和鐵死亡(鐵依賴(lài)的新型細(xì)胞死亡)。此外,干細(xì)胞還提供神經(jīng)保護(hù),防止健康神經(jīng)元進(jìn)一步受損;保護(hù)內(nèi)質(zhì)網(wǎng)功能(細(xì)胞內(nèi)的“蛋白質(zhì)工廠(chǎng)”);以及維護(hù)血腦屏障的完整性(如通過(guò)PKCδ/AQP4通路),防止有害物質(zhì)滲入腦組織。
作用方式與復(fù)雜性:多因子協(xié)同,機(jī)制仍在探索
這些恢復(fù)效果并非干細(xì)胞單打獨(dú)斗。干細(xì)胞通過(guò)釋放多種有益因子(如VEGF促進(jìn)血管、鈣調(diào)神經(jīng)磷酸酶抑制凋亡)以及與宿主環(huán)境相互作用(如通過(guò)VLA-4等分子增強(qiáng)與血管內(nèi)皮細(xì)胞的粘附)來(lái)發(fā)揮作用。值得注意的是,外泌體(干細(xì)胞分泌的小囊泡)的釋放也被觀(guān)察到上調(diào),但其在大腦修復(fù)中的具體角色仍不完全清楚,是未來(lái)研究的重要方向。總之,干細(xì)胞治療通過(guò)再生與保護(hù)雙管齊下、多靶點(diǎn)協(xié)同的復(fù)雜機(jī)制促進(jìn)腦功能恢復(fù)。
干細(xì)胞治療創(chuàng)傷性腦損傷 (TBI) 潛力與動(dòng)脈內(nèi)移植探索
全球每年有超過(guò)5000萬(wàn)人遭受創(chuàng)傷性腦損傷,且許多患者遺留長(zhǎng)期殘疾,現(xiàn)有療法效果有限。干細(xì)胞療法被視為有希望的解決方案,已有大量基礎(chǔ)和臨床研究通過(guò)腦內(nèi)或靜脈注射進(jìn)行。日本甚至已批準(zhǔn)基于腦內(nèi)移植的干細(xì)胞產(chǎn)品。
然而,利用動(dòng)脈內(nèi)途徑移植干細(xì)胞治療TBI的研究目前非常有限(僅有少量研究如補(bǔ)充表S1所列)。這些初步研究使用的細(xì)胞(人/大鼠BMSC或NSC)、劑量(5-25×10?cells/kg)和時(shí)機(jī)(傷后1-14天)與缺血性中風(fēng)研究類(lèi)似,并顯示出有希望的結(jié)果。盡管如此,仍需更多研究來(lái)充分評(píng)估和明確動(dòng)脈內(nèi)干細(xì)胞移植治療TBI的真正潛力和最佳方案。
動(dòng)脈內(nèi)移植干細(xì)胞治療腦出血 (ICH) 的治療需求與稀缺研究
腦出血同樣缺乏有效治療方法,干細(xì)胞移植為其帶來(lái)新希望,但研究焦點(diǎn)也集中在腦內(nèi)和靜脈途徑,目前有數(shù)項(xiàng)臨床試驗(yàn)正在進(jìn)行。
針對(duì)動(dòng)脈內(nèi)移植治療ICH的研究則極其稀少,目前僅發(fā)現(xiàn)一項(xiàng)研究報(bào)道。該研究(Seyfried等)在ICH后一天,通過(guò)動(dòng)脈內(nèi)注射10×10?cells/kg的人BMSC并聯(lián)合使用甘露醇,成功減輕了神經(jīng)功能障礙,其機(jī)制與促進(jìn)神經(jīng)發(fā)生有關(guān)。這一孤例雖然提供了初步證據(jù),但凸顯了該領(lǐng)域研究的匱乏,亟需更多探索來(lái)驗(yàn)證動(dòng)脈內(nèi)途徑在ICH治療中的效果和可行性。
膠質(zhì)瘤:干細(xì)胞作為靶向“病毒工廠(chǎng)”的潛力
惡性膠質(zhì)瘤是最常見(jiàn)且致命的原發(fā)性腦癌,傳統(tǒng)治療效果有限(平均生存期約14個(gè)月)。利用間充質(zhì)干細(xì)胞(MSC)能趨向炎癥/腫瘤部位的特性,將其作為攜帶溶瘤病毒的載體進(jìn)行動(dòng)脈內(nèi)移植,成為一種有前景的策略。
四項(xiàng)關(guān)鍵研究表明,經(jīng)頸動(dòng)脈注射的、裝載溶瘤病毒的MSC能精準(zhǔn)聚集在膠質(zhì)瘤組織(而非健康腦組織),有效抑制腫瘤生長(zhǎng)并延長(zhǎng)動(dòng)物生存期。相比之下,單純讓MSC過(guò)表達(dá)干擾素γ等蛋白質(zhì)則無(wú)效,這提示攜帶可復(fù)制病毒(而非單純分泌蛋白)是發(fā)揮抗腫瘤作用的關(guān)鍵。
動(dòng)脈內(nèi)移植干細(xì)胞治療阿爾茨海默病的挑戰(zhàn)與探索方向
阿爾茨海默病(AD)影響全球超5500萬(wàn)人,目前療法僅能緩解癥狀,無(wú)法治愈。動(dòng)脈內(nèi)干細(xì)胞移植治療AD的研究極其匱乏,僅有一項(xiàng)已發(fā)表的嘗試且結(jié)果不佳。一個(gè)核心挑戰(zhàn)在于,與中風(fēng)或腦損傷不同,AD患者的血腦屏障(BBB)相對(duì)完整,阻礙了干細(xì)胞進(jìn)入腦部。未來(lái)研究應(yīng)考慮結(jié)合使用甘露醇等BBB開(kāi)放劑來(lái)促進(jìn)細(xì)胞穿透。此外,鑒于A(yíng)D是慢性進(jìn)展性疾病,多次注射干細(xì)胞或其分泌的外泌體可能比單次治療更具潛力。
帕金森病:有限的穿透與療效之謎
帕金森病(PD)以運(yùn)動(dòng)障礙為特征,全球患者約1000萬(wàn),同樣缺乏根治手段。一項(xiàng)研究嘗試通過(guò)動(dòng)脈內(nèi)移植甘露醇預(yù)處理的MSC治療PD模型。雖然觀(guān)察到一定程度的功能恢復(fù),但令人意外的是,并未檢測(cè)到受損腦區(qū)(紋狀體、黑質(zhì))的細(xì)胞結(jié)構(gòu)發(fā)生明顯改變。這表明觀(guān)察到的改善可能源于其他保護(hù)性或調(diào)節(jié)性機(jī)制,而非直接的細(xì)胞替換或顯著修復(fù),同時(shí)也突顯了干細(xì)胞有效到達(dá)并作用于深部腦區(qū)(如黑質(zhì))的困難。
動(dòng)脈移植干細(xì)胞的安全問(wèn)題
動(dòng)脈內(nèi)干細(xì)胞移植的主要安全問(wèn)題聚焦于血管阻塞風(fēng)險(xiǎn),核心因素包括細(xì)胞劑量、輸注速度和細(xì)胞物理特性:Cui等發(fā)現(xiàn)高劑量+緩慢注射易形成微血栓,導(dǎo)致功能恢復(fù)惡化,強(qiáng)調(diào)需優(yōu)化細(xì)胞分散性;Ge等證實(shí)細(xì)胞尺寸是關(guān)鍵——小細(xì)胞(12-18μm)比大細(xì)胞(30μm)顯著減少血管阻塞并改善療效,而3D培養(yǎng)可縮小細(xì)胞尺寸。
此外,細(xì)胞衰老(增大細(xì)胞體積)亦影響安全,采用人血小板裂解物替代胎牛血清培養(yǎng)可延緩衰老、維持較小細(xì)胞形態(tài),為提升安全性提供新策略。
外泌體治療神經(jīng)系統(tǒng)疾病的臨床前研究
外泌體的獨(dú)特優(yōu)勢(shì)與治療潛力干細(xì)胞來(lái)源的外泌體作為一種新興的納米級(jí)治療載體(40-200 nm),憑借其高效穿透血腦屏障的能力、極低免疫原性、穩(wěn)定易保存的特性,以及攜帶多種生物活性分子(如DNA、mRNA、miRNA、蛋白質(zhì))的“分子武器庫(kù)”,成為替代傳統(tǒng)干細(xì)胞療法的突破性策略。其核心優(yōu)勢(shì)在于可直接將治療性物質(zhì)遞送至靶細(xì)胞,規(guī)避了活細(xì)胞移植的安全風(fēng)險(xiǎn),同時(shí)在神經(jīng)修復(fù)(如促進(jìn)神經(jīng)突生長(zhǎng))和抗炎調(diào)控中展現(xiàn)出顯著潛力。
疾病模型中的實(shí)證效果與工程化突破:在動(dòng)物模型中,動(dòng)脈內(nèi)外泌體已證實(shí)其治療價(jià)值:
- 中風(fēng)治療:過(guò)表達(dá)miR-133b的BMSC外泌體(3×1011顆粒/次)顯著促進(jìn)神經(jīng)血管再生并改善功能恢復(fù);
- 腦損傷修復(fù):人BMSC外泌體(1.3×10?顆粒)抗炎效果甚至優(yōu)于干細(xì)胞本身;
這些研究雖處于起步階段,但共同指向:工程化修飾可大幅提升外泌體靶向性與療效,為腦部疾病的精準(zhǔn)治療開(kāi)辟新路徑。
通過(guò)動(dòng)脈內(nèi)移植干細(xì)胞和外泌體治療中樞神經(jīng)系統(tǒng)疾病的臨床試驗(yàn)
有12篇文章研究了動(dòng)脈內(nèi)干細(xì)胞移植,但尚未發(fā)表關(guān)于動(dòng)脈內(nèi)外泌體移植的臨床試驗(yàn)。詳細(xì)數(shù)據(jù)如表3所示。
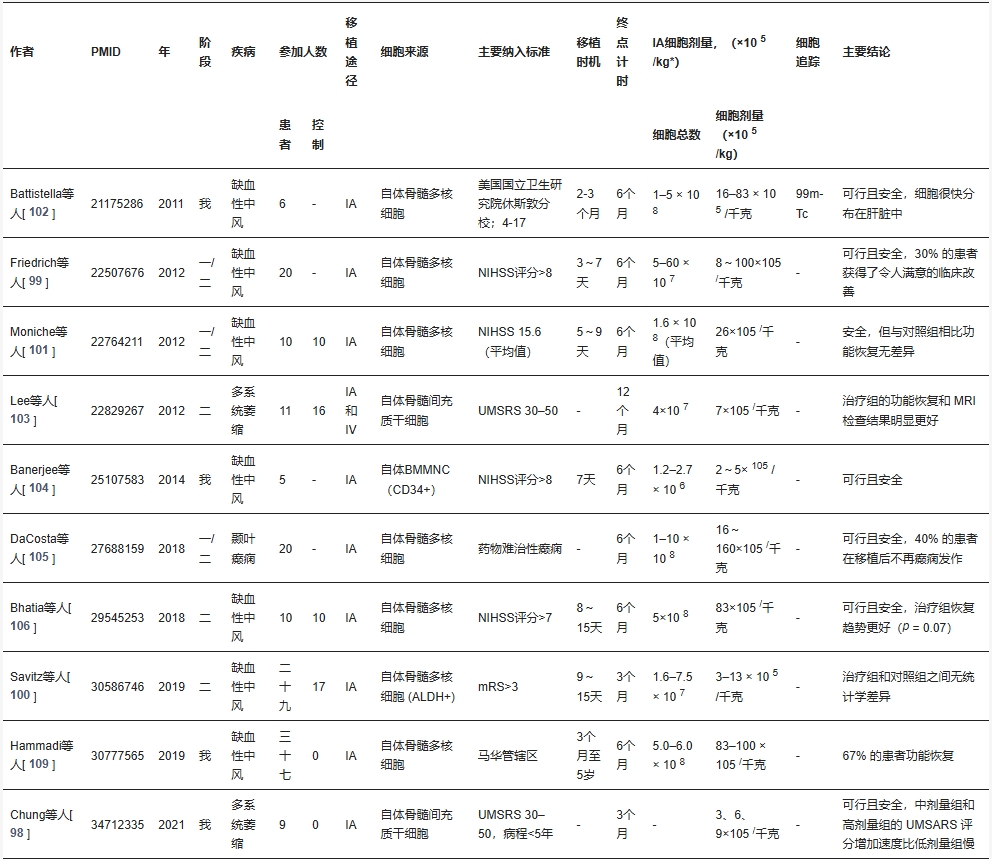
臨床研究格局與安全性評(píng)估:目前針對(duì)動(dòng)脈內(nèi)移植的臨床研究集中于干細(xì)胞(尤其是自體骨髓單核細(xì)胞BMMNC和間充質(zhì)干細(xì)胞BMSC),尚無(wú)動(dòng)脈內(nèi)外泌體移植的臨床試驗(yàn)報(bào)告。在12項(xiàng)已開(kāi)展的干細(xì)胞臨床試驗(yàn)中,缺血性中風(fēng)是主要適應(yīng)癥(占比最高),其次為難治性疾病如多系統(tǒng)萎縮、癲癇等。
細(xì)胞來(lái)源以自體細(xì)胞為主導(dǎo)(BMMNC最常見(jiàn),其次為BMSC),這主要源于早期對(duì)同種異體細(xì)胞安全性的顧慮;但為實(shí)現(xiàn)療法的廣泛可及性,同種異體細(xì)胞仍是未來(lái)關(guān)鍵方向。細(xì)胞劑量范圍較大(3–160×10?cells/kg),與動(dòng)物實(shí)驗(yàn)數(shù)據(jù)基本一致。安全性方面,多數(shù)試驗(yàn)未報(bào)告嚴(yán)重不良事件,但Giordano等研究中85%患者(6/7)出現(xiàn)無(wú)癥狀缺血體征,提示微血管阻塞風(fēng)險(xiǎn)仍需警惕。
療效矛盾與優(yōu)化方向:療效結(jié)果呈現(xiàn)疾病依賴(lài)性差異:
- 缺血性中風(fēng):早期單組試驗(yàn)顯示功能改善,但大型隨機(jī)試驗(yàn)未達(dá)到統(tǒng)計(jì)學(xué)顯著恢復(fù)(如Bhatia等僅觀(guān)察到邊際趨勢(shì),p=0.07)。值得注意的是,Bhatia試驗(yàn)中高劑量組(83×10?cells/kg)的潛在療效優(yōu)于低劑量組,提示BMMNC可能需要更高劑量窗口。
- 多系統(tǒng)萎縮:Lee與Chung的研究顯示,中高劑量BMSC(6-9×10?cells/kg)顯著延緩疾病進(jìn)展,優(yōu)于低劑量組(3×10?cells/kg),這對(duì)缺乏有效療法的疾病具有臨床意義。
然而,多系統(tǒng)萎縮等疾病的試驗(yàn)缺乏動(dòng)物模型基礎(chǔ)驗(yàn)證,且干細(xì)胞移植對(duì)罕見(jiàn)病的機(jī)制研究不足。當(dāng)前動(dòng)脈內(nèi)移植的臨床試驗(yàn)仍處于早期階段,亟需通過(guò)優(yōu)化劑量策略、結(jié)合外泌體遞送技術(shù)(其血腦屏障穿透性?xún)?yōu)于細(xì)胞),并加強(qiáng)臨床前轉(zhuǎn)化研究,以提升療效可重復(fù)性。
結(jié)論和未來(lái)方向
動(dòng)脈內(nèi)干細(xì)胞/外泌體移植相比其他移植方法具有諸多優(yōu)勢(shì)。導(dǎo)管技術(shù)和方法的進(jìn)步將提高該方法的安全性,而對(duì)干細(xì)胞和外泌體特性的深入了解將有助于改善中樞神經(jīng)系統(tǒng)疾病的功能預(yù)后。進(jìn)一步評(píng)估最佳細(xì)胞來(lái)源、劑量、時(shí)機(jī)、追蹤方法和潛在機(jī)制對(duì)于開(kāi)發(fā)新型治療模式至關(guān)重要。
參考資料:
[1]:Honda, T.; Kawabori, M.; Fujimura, M. Intra-Arterial Administration of Stem Cells and Exosomes for Central Nervous System Disease. Int. J. Mol. Sci. 2025, 26, 7405. https://doi.org/10.3390/ijms26157405
免責(zé)說(shuō)明:本文僅用于傳播科普知識(shí),分享行業(yè)觀(guān)點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專(zhuān)業(yè)建議。如有版權(quán)等疑問(wèn),請(qǐng)隨時(shí)聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信