7月29日,中國解放軍總醫(yī)院第五醫(yī)學(xué)中心、首都醫(yī)科大學(xué)附屬北京兒童醫(yī)院、上海交通大學(xué)醫(yī)學(xué)院等多家權(quán)威機(jī)構(gòu),在國際權(quán)威期刊雜志《nature》子刊《signal transduction and targeted therapy》上發(fā)表了一項(xiàng)關(guān)于“間充質(zhì)基質(zhì)細(xì)胞治療失代償性肝硬化的劑量遞增的臨床研究結(jié)果[1]。

該研究通過Ia/Ib期臨床試驗(yàn)首次建立間充質(zhì)基質(zhì)細(xì)胞(MSC)治療失代償性肝硬化(DLC)的劑量-效應(yīng)關(guān)系,并揭示MX1?單核細(xì)胞的核心調(diào)節(jié)機(jī)制,為臨床轉(zhuǎn)化提供關(guān)鍵依據(jù)。
失代償性肝硬化的免疫困境:CAID的雙面挑戰(zhàn)與間充質(zhì)干細(xì)胞療法的希望
失代償性肝硬化 (DLC) 是肝硬化的晚期階段,伴隨嚴(yán)重的肝功能衰竭和致命并發(fā)癥(如腹水、出血、腦病),顯著增加全球死亡風(fēng)險(xiǎn)。此時(shí),肝臟功能衰退導(dǎo)致肝硬化相關(guān)免疫功能障礙 (CAID),表現(xiàn)為矛盾的系統(tǒng)性炎癥加劇(由促炎物質(zhì)如細(xì)胞因子和內(nèi)毒素驅(qū)動(dòng))與免疫缺陷(免疫細(xì)胞功能受損)并存。
這種雙重打擊不僅直接造成組織損傷,還使患者極易發(fā)生嚴(yán)重感染和細(xì)菌易位,進(jìn)一步惡化肝損傷,引發(fā)多器官衰竭,導(dǎo)致預(yù)后極差。
破解失代償性肝硬化免疫困局:間充質(zhì)干細(xì)胞療法的新希望與標(biāo)準(zhǔn)化挑戰(zhàn)
雖然肝移植是唯一根治DLC的方法,但其應(yīng)用受限于供體短缺等問題。治療CAID面臨挑戰(zhàn),因?yàn)橐种蒲装Y可能增加感染風(fēng)險(xiǎn),而刺激免疫又可能加重?fù)p傷。因此,調(diào)節(jié)而非抑制或過度刺激免疫的策略至關(guān)重要。
間充質(zhì)基質(zhì)細(xì)胞 (MSC) 憑借其易獲取性、低免疫原性和強(qiáng)大的免疫調(diào)節(jié)能力,成為有前景的DLC/CAID治療候選。一些臨床研究(包括作者團(tuán)隊(duì)的工作)顯示MSC輸注可改善肝功能指標(biāo),但整體臨床結(jié)果好壞參半,療效差異可能源于MSC劑量、治療方案和患者選擇標(biāo)準(zhǔn)的不統(tǒng)一,突顯了標(biāo)準(zhǔn)化治療的迫切需求。
為此,研究團(tuán)隊(duì)設(shè)計(jì)兩階段臨床試驗(yàn),旨在明確MSC的安全窗口、劑量效應(yīng)及作用機(jī)制。
研究設(shè)計(jì)
從2022年3月到2024年3月,共篩選了186名DLC患者。如圖1所示,該研究分為兩個(gè)階段(Ia期和Ib期)。
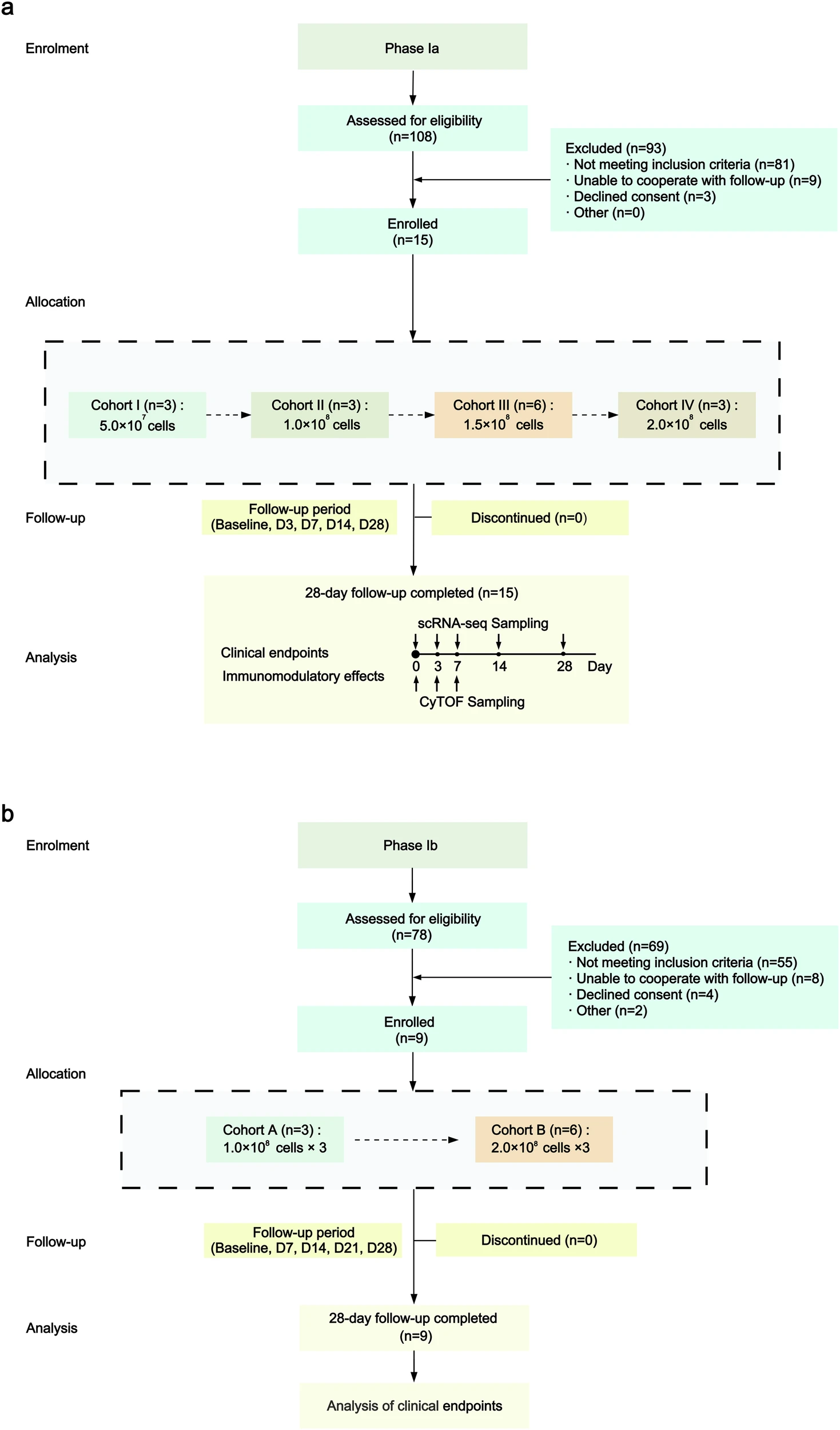
我們采用單組劑量遞增設(shè)計(jì)進(jìn)行了Ia/Ib期序貫臨床試驗(yàn),分為單劑量(Ia期)和多劑量(Ib期)兩階段,納入了24例失代償性肝硬化患者。以評估MSC療法在DLC患者中的安全性和耐受性,同時(shí)探索其免疫調(diào)節(jié)作用并收集初步治療信號。
在Ia期臨床試驗(yàn)中(15名患者者),四個(gè)劑量組分別接受單劑量 MSC:5.0×10?、1.0×10?、1.5×10?和2.0×10?細(xì)胞。患者于第3、7、14和28天接受隨訪。研究人員進(jìn)行了多組學(xué)分析,包括單細(xì)胞RNA測序和飛行時(shí)間流式細(xì)胞術(shù),以進(jìn)行探索性機(jī)制分析,探究免疫細(xì)胞動(dòng)力學(xué)和劑量依賴性反應(yīng)。
基于這些發(fā)現(xiàn),Ib期研究納入了兩個(gè)劑量組(9名患者),每個(gè)劑量組接受三劑MSC,間隔一周:每劑1.0×10?和2.0×10?細(xì)胞。患者于第7、14、21和28天接受隨訪,以進(jìn)一步評估多劑量方案的安全性和可行性。這些試驗(yàn)已在ClinicalTrials.gov注冊(NCT05227846和NCT05984303)。
主要結(jié)果發(fā)現(xiàn)
MSC輸注展現(xiàn)出良好的安全性與耐受性:在輸注過程中及結(jié)束后30分鐘內(nèi),未觀察到任何不良的血流動(dòng)力學(xué)或呼吸系統(tǒng)變化。整個(gè)28天的觀察期內(nèi),Ia期和Ib期試驗(yàn)共報(bào)告了10例不良事件(AE),大多數(shù)被評估為與MSC治療“不太可能相關(guān)”。
雖然其中4例AE(包括皮疹、上呼吸道感染和發(fā)熱)因發(fā)生時(shí)間與輸注接近而被判定為“可能相關(guān)”,但這些事件也可能由患者本身的失代償性肝硬化(DLC)基礎(chǔ)疾病或同時(shí)使用的其他藥物引起,而非直接歸因于MSC治療。
未發(fā)生嚴(yán)重安全性事件:至關(guān)重要的是,在整個(gè)研究期間,沒有出現(xiàn)任何劑量限制性毒性(DLT)、導(dǎo)致治療中止的AE、因AE而退出研究的病例、嚴(yán)重不良事件(SAE)或可疑非預(yù)期嚴(yán)重不良反應(yīng)(SUSAR)。這明確表明,在試驗(yàn)設(shè)定的劑量方案和28天觀察期內(nèi),MSC輸注沒有引發(fā)嚴(yán)重的、危及生命的或?qū)е轮委熤袛嗟陌踩詥栴}。
初步療效信號
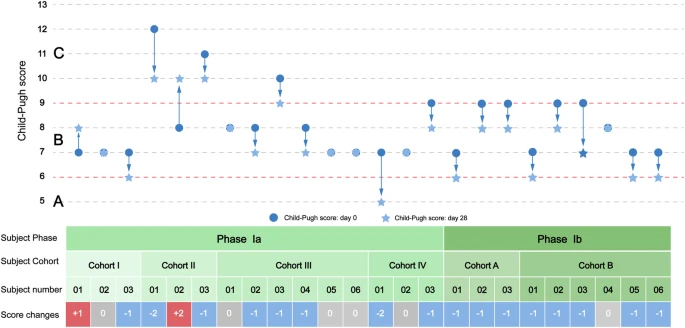
關(guān)鍵臨床評分顯示改善趨勢,高劑量效果更佳:在治療第28天,Child-Pugh評分(評估肝硬化嚴(yán)重程度)在Ia期53.3%的參與者中下降(但13.3%在低劑量隊(duì)列上升),而在Ib期88.9%的參與者中下降且無上升病例。
MELD評分(評估肝病嚴(yán)重程度和等待移植優(yōu)先級)在Ia期33.3%和Ib期44.4%的參與者中下降,其中Ib期高劑量隊(duì)列(B組)表現(xiàn)更好(3例下降且無增加)。整體數(shù)據(jù)顯示,接受更高劑量MSC的組別在兩個(gè)評分上改善更顯著(圖2)。
營養(yǎng)、肝臟合成功能及生活質(zhì)量指標(biāo)呈現(xiàn)積極變化:反映營養(yǎng)狀況和肝臟合成功能的白蛋白、前白蛋白、膽堿酯酶水平和凝血酶原活性在相當(dāng)一部分參與者中得到改善,改善率在Ia期為53.3%-73.3%,在Ib期更高,為66.7%-88.9%(白蛋白改善率最高)。
生活質(zhì)量方面,使用CLDQ和EQ-5D問卷評估,Ib期參與者改善更明顯(CLDQ 88.9%, EQ-5D 55.6%),特別是Ib期高劑量組(B組)所有參與者CLDQ評分均有改善,66.7%EQ-5D評分改善,提示更高劑量或多劑量可能更有效提升生活質(zhì)量。
治療期內(nèi)未發(fā)生嚴(yán)重肝硬化并發(fā)癥:在整個(gè)28天的觀察期內(nèi),任何接受MSC治療的隊(duì)列中均未報(bào)告發(fā)生肝衰竭、新發(fā)肝細(xì)胞癌(HCC)或死亡病例。
間充質(zhì)干細(xì)胞治療后PBMC的動(dòng)態(tài)單細(xì)胞圖譜
研究揭示了MSC治療后PBMC免疫譜系的動(dòng)態(tài)變化:通過對肝硬化患者進(jìn)行多時(shí)間點(diǎn)(基線至D28)的單細(xì)胞RNA測序(scRNA-seq)分析,并結(jié)合健康供體數(shù)據(jù)對比,研究發(fā)現(xiàn)患者基線時(shí)存在免疫失調(diào)(單核細(xì)胞和B細(xì)胞比例升高,T細(xì)胞和NK細(xì)胞比例降低)(圖3)。

MSC輸注后,這些免疫細(xì)胞譜系的比例開始向健康狀態(tài)恢復(fù),其中第7天(D7)的變化最為顯著。使用飛行時(shí)間質(zhì)譜流式細(xì)胞術(shù)(CyTOF)在另一組患者中也驗(yàn)證了T/NK細(xì)胞增加和B細(xì)胞減少的趨勢,但發(fā)現(xiàn)單核細(xì)胞在D3短暫升高后于D7下降,提示其亞群可能經(jīng)歷復(fù)雜變化。
單核細(xì)胞被識別為關(guān)鍵靶點(diǎn)及潛在作用機(jī)制:分析顯示,在肝硬化患者的所有免疫細(xì)胞亞群中,單核細(xì)胞與健康個(gè)體相比差異最為顯著。更重要的是,MSC治療主要影響了單核細(xì)胞的比例和動(dòng)態(tài)(表現(xiàn)為早期升高后下降),而對其他譜系比例的影響相對較小。
這強(qiáng)烈提示單核細(xì)胞可能是MSC發(fā)揮免疫調(diào)節(jié)作用的核心靶細(xì)胞,其比例和功能的改變可能是MSC改善肝硬化免疫功能障礙(CAID)的主要機(jī)制之一,這也與其在肝硬化進(jìn)展中的已知重要作用相符。因此,深入研究單核細(xì)胞亞群的變化成為后續(xù)重點(diǎn)。
干細(xì)胞治療失代償性肝硬化的免疫調(diào)節(jié)新機(jī)制
MX1+單核細(xì)胞作為免疫調(diào)節(jié)的核心執(zhí)行者
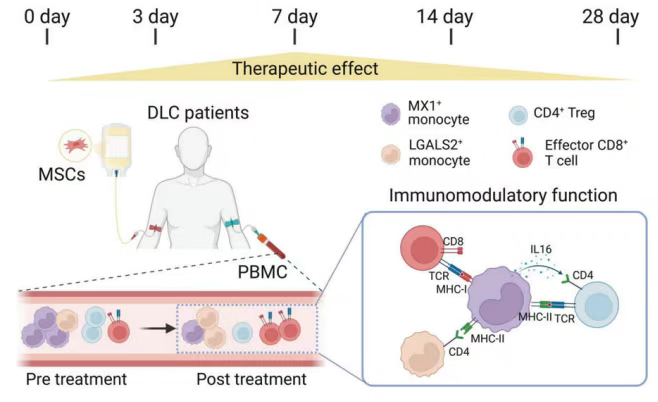
研究發(fā)現(xiàn),MX1+單核細(xì)胞在MSC治療肝硬化中扮演中樞性調(diào)節(jié)角色:MX1+單核細(xì)胞是細(xì)胞間通訊的主要信號發(fā)射器,通過關(guān)鍵通路(如半乳糖凝集素、抵抗素)動(dòng)態(tài)調(diào)控免疫應(yīng)答。治療前,其介導(dǎo)的促炎信號(如ICAM1介導(dǎo)的免疫細(xì)胞遷移、APP-CD74軸)增強(qiáng),促進(jìn)Treg和效應(yīng)T細(xì)胞活化;MSC輸注后,其趨化活性降低但抗原呈遞能力增強(qiáng),推動(dòng)免疫狀態(tài)向穩(wěn)態(tài)轉(zhuǎn)變(圖4)。
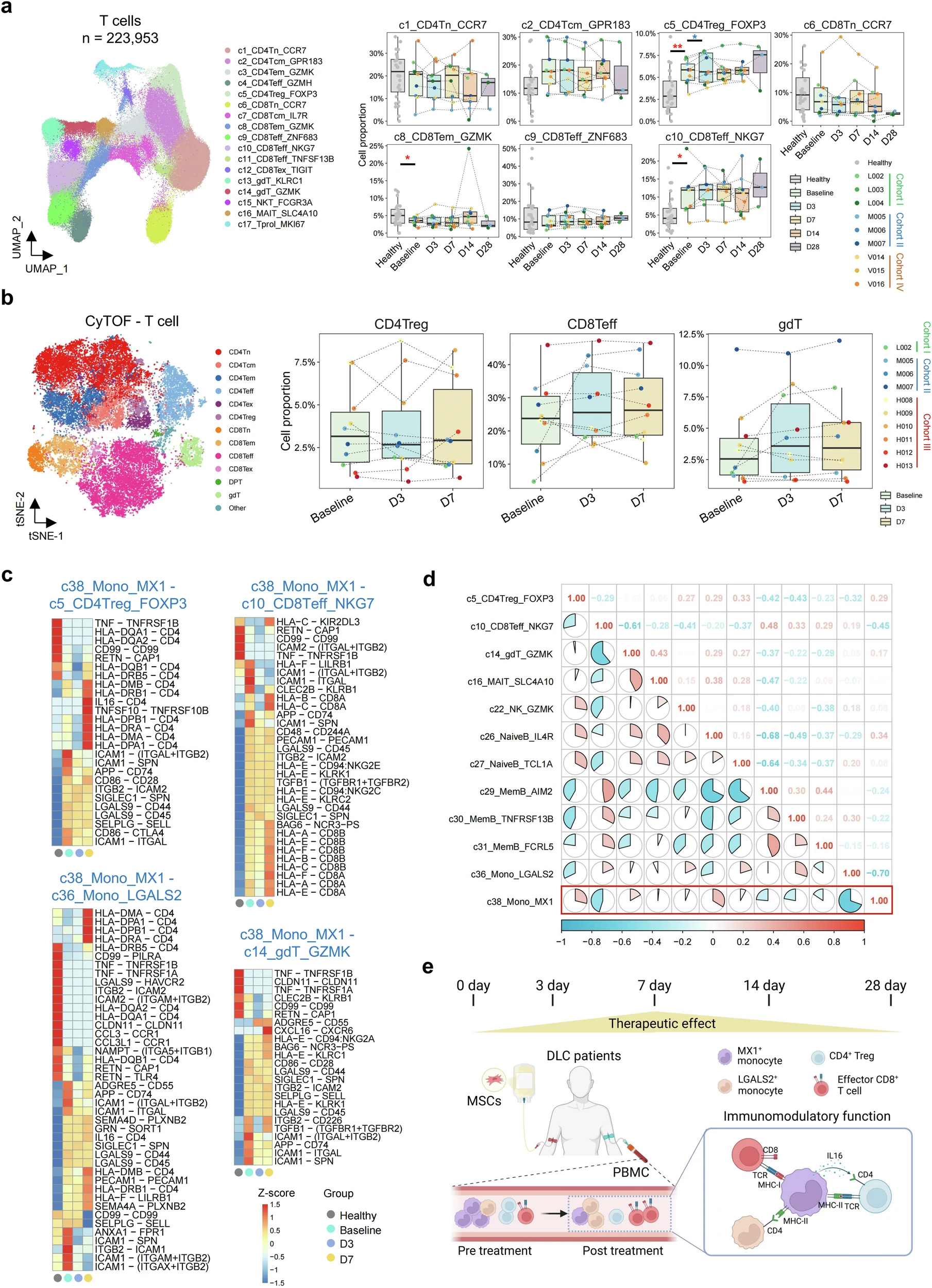
靶向調(diào)控關(guān)鍵免疫細(xì)胞:
- 抑制過度免疫激活:通過CD86-CTLA4軸增強(qiáng)Treg抑制功能,并降低CD4Treg比例(D3/D7下降);
- 協(xié)調(diào)效應(yīng)免疫:與CD8Teff呈負(fù)相關(guān),間接限制其過度增殖;
- 重塑B細(xì)胞池:與幼稚B細(xì)胞正相關(guān)、記憶B細(xì)胞負(fù)相關(guān),促使B細(xì)胞向靜息表型轉(zhuǎn)化。
動(dòng)態(tài)網(wǎng)絡(luò)調(diào)控與治療意義
MX1+單核細(xì)胞通過多維度交互網(wǎng)絡(luò)實(shí)現(xiàn)MSC的免疫平衡作用:
配體-受體重編程:治療后下調(diào)促遷移分子(如ICAM1),減少T細(xì)胞和單核細(xì)胞浸潤;上調(diào)IL16-CD4等通路,精細(xì)調(diào)控Treg功能;通過ANXA1增強(qiáng)LGALS2+單核細(xì)胞的吞噬功能,促進(jìn)病原清除。
雙相調(diào)節(jié)能力:
- 早期(D3):短暫升高單核細(xì)胞比例,啟動(dòng)炎癥緩解;
- 晚期(D7后):驅(qū)動(dòng)單核細(xì)胞亞群向修復(fù)表型分化,同時(shí)抑制慢性炎癥(如半乳糖凝集素通路下調(diào))。
臨床關(guān)聯(lián)性:MX1+單核細(xì)胞的比例與功能異常是肝硬化免疫缺陷(CAID)的關(guān)鍵因素,其修復(fù)程度直接關(guān)聯(lián)Treg正常化、B細(xì)胞穩(wěn)態(tài)重建及感染風(fēng)險(xiǎn)降低,為MSC療法的核心機(jī)制提供新靶點(diǎn)。
總結(jié):MX1+單核細(xì)胞通過重塑免疫細(xì)胞互作網(wǎng)絡(luò)(尤其靶向Treg、CD8Teff及B細(xì)胞),并動(dòng)態(tài)調(diào)整分泌通路(半乳糖凝集素/抵抗素)和表面分子(ICAM1/CD86),介導(dǎo)MSC的雙向免疫調(diào)節(jié)——既抑制過度炎癥,又增強(qiáng)病原清除能力,為肝硬化治療提供新機(jī)制依據(jù)。
這項(xiàng)研究為干細(xì)胞在治療肝硬化方面作出哪些重要貢獻(xiàn)?
這項(xiàng)研究為干細(xì)胞治療肝硬化提供了兩項(xiàng)突破性貢獻(xiàn),通過建立精準(zhǔn)治療框架和發(fā)現(xiàn)關(guān)鍵免疫介質(zhì),推動(dòng)了臨床轉(zhuǎn)化:
一、確立劑量依賴性治療范式,優(yōu)化臨床方案
首創(chuàng)MSC劑量-效應(yīng)關(guān)系證據(jù)鏈:首次證實(shí)高劑量MSC可誘導(dǎo)更強(qiáng)、更持久的免疫調(diào)節(jié)(如單核細(xì)胞亞群調(diào)控),其中MX1?單核細(xì)胞作為核心介質(zhì)呈現(xiàn)顯著劑量依賴性——高劑量組治療后第7天該細(xì)胞比例與功能變化最顯著(第14天減弱),為臨床劑量選擇(如多次輸注)提供直接依據(jù)。
提出”時(shí)間窗”治療策略:發(fā)現(xiàn)免疫調(diào)節(jié)峰值出現(xiàn)在D7,揭示療效維持需間隔優(yōu)化(如每7天強(qiáng)化輸注),突破傳統(tǒng)給藥模式盲區(qū)。
二、鑒定MX1?單核細(xì)胞的雙重臨床價(jià)值
關(guān)鍵治療靶點(diǎn):明確MX1?單核細(xì)胞(特征:高表達(dá)干擾素刺激基因/CCR)是MSC調(diào)控先天免疫的核心樞紐,其功能修復(fù)直接關(guān)聯(lián)免疫穩(wěn)態(tài)重建。
首推動(dòng)態(tài)監(jiān)測生物標(biāo)志物:
- 機(jī)制關(guān)聯(lián)性:MX1?單核細(xì)胞比例變化與Child-Pugh評分改善同步(評分下降幅度大的患者該細(xì)胞持續(xù)低水平);
- 疾病普適性:該類單核細(xì)胞此前已被證實(shí)為多種疾病(纖維化、自身免疫病)的生物標(biāo)志物,本研究進(jìn)一步確立其在肝硬化治療反應(yīng)監(jiān)測中的特異性價(jià)值。
轉(zhuǎn)化意義:該發(fā)現(xiàn)不僅深化對MSC作用機(jī)制的理解,更構(gòu)建了”劑量優(yōu)化-靶向調(diào)控-動(dòng)態(tài)監(jiān)測”的閉環(huán)治療體系,為肝硬化及類風(fēng)濕性關(guān)節(jié)炎等免疫失調(diào)疾病提供可推廣的精準(zhǔn)治療范式。
總結(jié)
綜上所述,這項(xiàng)1期臨床試驗(yàn)證明了間充質(zhì)干細(xì)胞療法在失代償性肝硬化治療中的安全性、耐受性和潛在的治療信號,并對其免疫調(diào)節(jié)作用提供了深刻見解。所進(jìn)行的多組學(xué)分析首次揭示了MSC療法在失代償性肝硬化治療中的劑量-效應(yīng)關(guān)系和最佳給藥間隔。MX1+單核細(xì)胞被鑒定為介導(dǎo)MSC誘導(dǎo)免疫調(diào)節(jié)的關(guān)鍵亞群,為MSC療法在CAID中的治療提供了新的機(jī)制見解。
值得注意的是,MX1?單核細(xì)胞可能在未來的試驗(yàn)中作為評估MSC治療反應(yīng)的預(yù)測性生物標(biāo)志物,從而指導(dǎo)患者分層和治療優(yōu)化。這些結(jié)果不僅加深了我們對MSC療法潛在免疫機(jī)制的理解,也為設(shè)計(jì)未來試驗(yàn)以優(yōu)化失代償性肝硬化患者基于MSC的治療策略奠定了重要基礎(chǔ)。需要開展設(shè)計(jì)精良、樣本量更大的II期臨床試驗(yàn),以驗(yàn)證MSC療法的安全性和有效性,最終推進(jìn)其臨床轉(zhuǎn)化。
參考資料:[1]:Shi, L., Zhang, Z., Mei, S. et al. Dose-escalation studies of mesenchymal stromal cell therapy for decompensated liver cirrhosis: phase Ia/Ib results and immune modulation insights. Sig Transduct Target Ther 10, 238 (2025). https://doi.org/10.1038/s41392-025-02318-4
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時(shí)聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信