定義、病理與分類:視網(wǎng)膜變性疾病 (RDD) 是一組導致眼球后方感光神經(jīng)組織——視網(wǎng)膜進行性損傷的疾病,最終引發(fā)視力障礙或失明。
其發(fā)病機制復雜,涉及遺傳、分子、細胞及環(huán)境等多因素相互作用,導致感光細胞 (視桿/視錐細胞)、視網(wǎng)膜色素上皮細胞和視網(wǎng)膜神經(jīng)節(jié)細胞等關鍵細胞逐漸喪失和退化。這些疾病既包括遺傳性的(如視網(wǎng)膜色素變性、Stargardt病、Leber先天性黑蒙),也包括后天獲得性的(如年齡相關性黃斑變性、青光眼、糖尿病視網(wǎng)膜病變)。
治療現(xiàn)狀與前景:由于視網(wǎng)膜自身再生能力有限,且目前缺乏能夠根治RDD的療法,開發(fā)有效策略以延緩退化或替換丟失細胞成為迫切臨床需求。
盡管尚無成熟的臨床治療方法,但基因療法和干細胞療法等新興領域的最新進展,為恢復視網(wǎng)膜結(jié)構(gòu)和功能提供了極具希望的途徑;臨床前和早期臨床研究已顯示出令人鼓舞的安全性和有效性初步結(jié)果,支持其在應對各類遺傳性與獲得性RDD方面的巨大潛力。
視力拯救進行時:基因與干細胞療法突破視網(wǎng)膜退化困境 | 最新臨床進展盤點
近日,美國華盛頓特區(qū)喬治城大學醫(yī)學中心眼科的研究人員在國際醫(yī)學期刊雜志《Stem Cell Reviews and Reports》發(fā)表了一篇“基于基因和干細胞的視網(wǎng)膜退行性疾病治療:進展、挑戰(zhàn)和未來方向”的研究綜述。

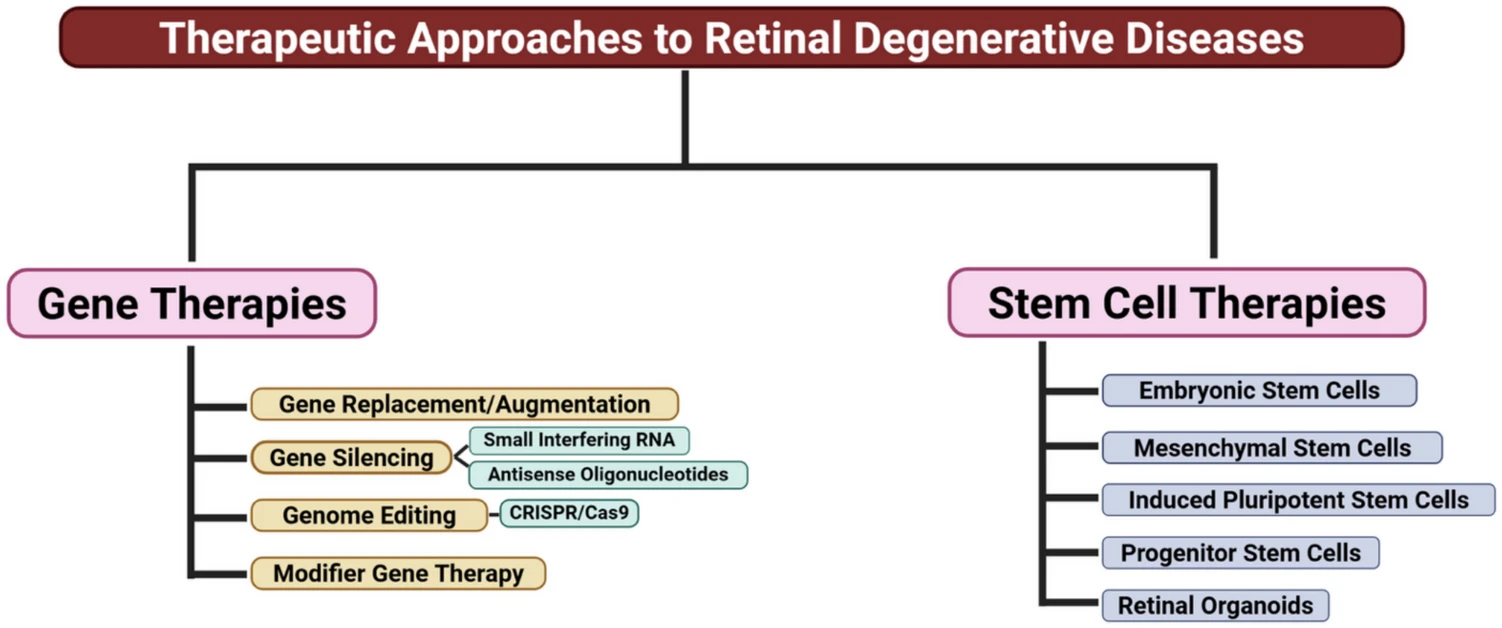
本綜述重點介紹了新興的治療方法,包括基因療法和干細胞療法(圖1)。我們還概述了這些治療面臨的挑戰(zhàn),同時強調(diào)了可能改變治療干預格局的未來方向。
基因療法治療視網(wǎng)膜退行性疾病
基因治療為治療遺傳性或獲得性視網(wǎng)膜疾病 (RDD) 提供了一種革命性的方法,特別是對于治療選擇有限或沒有治療選擇的患者。通過針對遺傳根本原因,它為以前沒有治療選擇的患者帶來了長期且可能治愈的希望。
視網(wǎng)膜基因治療根據(jù)所涉及的突變類型采用各種技術。這些方法包括基因置換或增強、基因編輯、沉默突變基因或引入調(diào)節(jié)受突變影響的上游或下游通路的基因以增強細胞功能(修飾基因治療)。
為了將治療基因遞送至靶細胞,視網(wǎng)膜基因治療采用多種病毒載體,包括腺病毒、腺相關病毒 (AAV) 和慢病毒,以及不同的給藥途徑(玻璃體內(nèi)、視網(wǎng)膜下、脈絡膜上腔、靜脈內(nèi)、眼球筋膜下和局部)(圖2)。選擇合適的載體對于基因治療的成功至關重要。
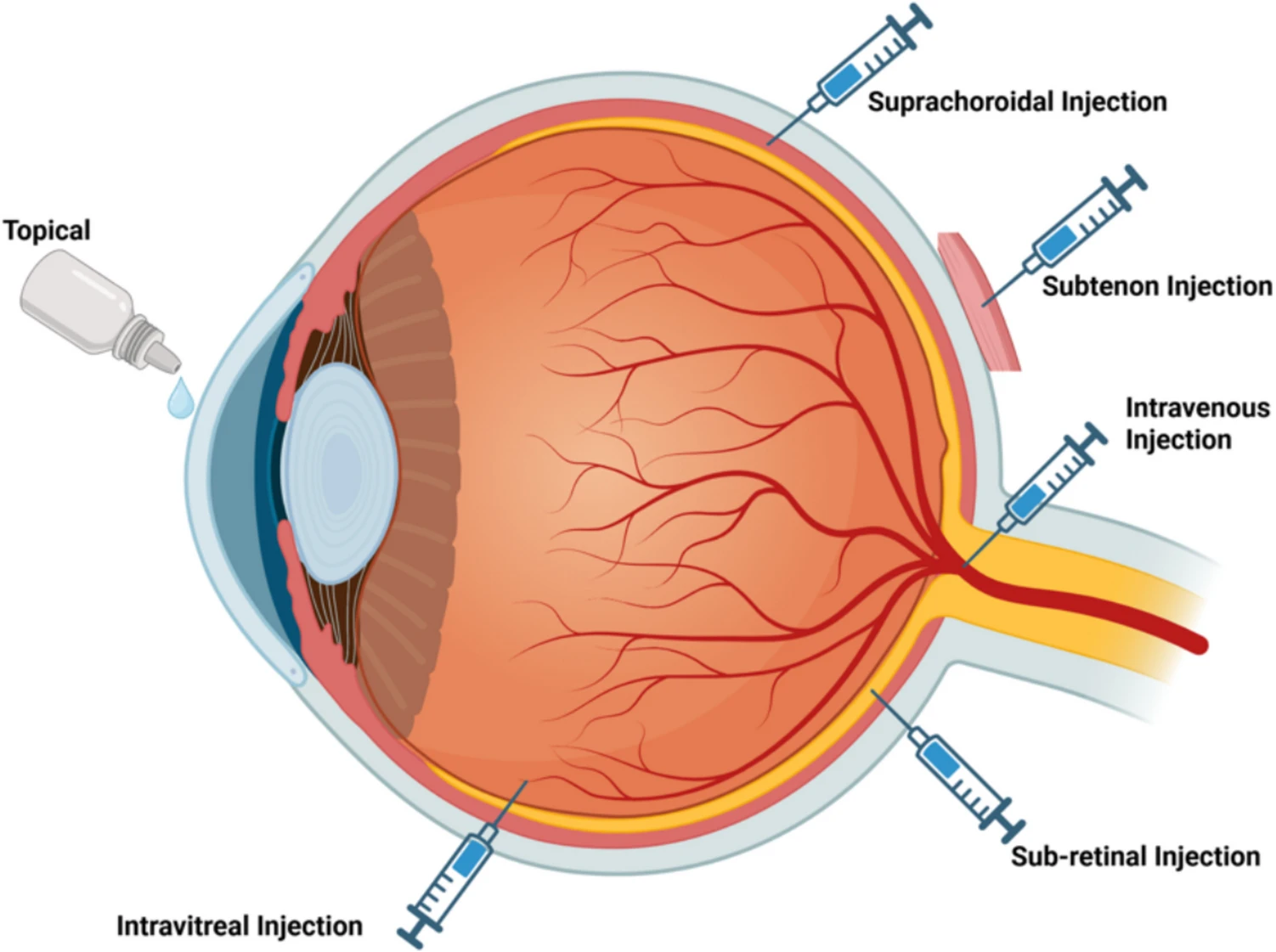
然而,選擇最佳載體可能頗具挑戰(zhàn)性,尤其對于AAV而言,由于其4.7千堿基(kb)的包裝限制,這通常會限制其在遞送與某些RDD相關的較大基因方面的應用。
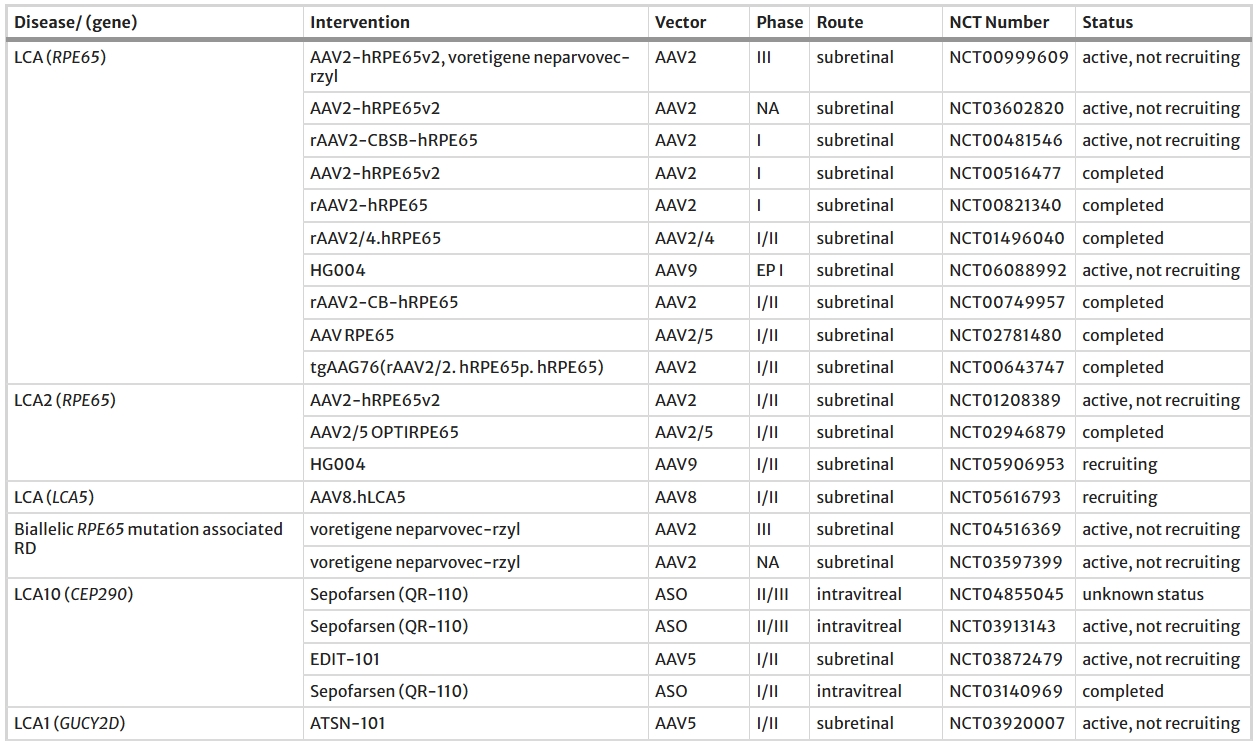
本節(jié)概述了主要眼部疾病(AMD、青光眼、DR、RP、STGD、LCA、USH、CHM、ACHM、LHON、BCD和XLRS),以及它們的相關基因(圖3)和相關臨床試驗(表1),展現(xiàn)了基因療法在多種疾病中的探索。
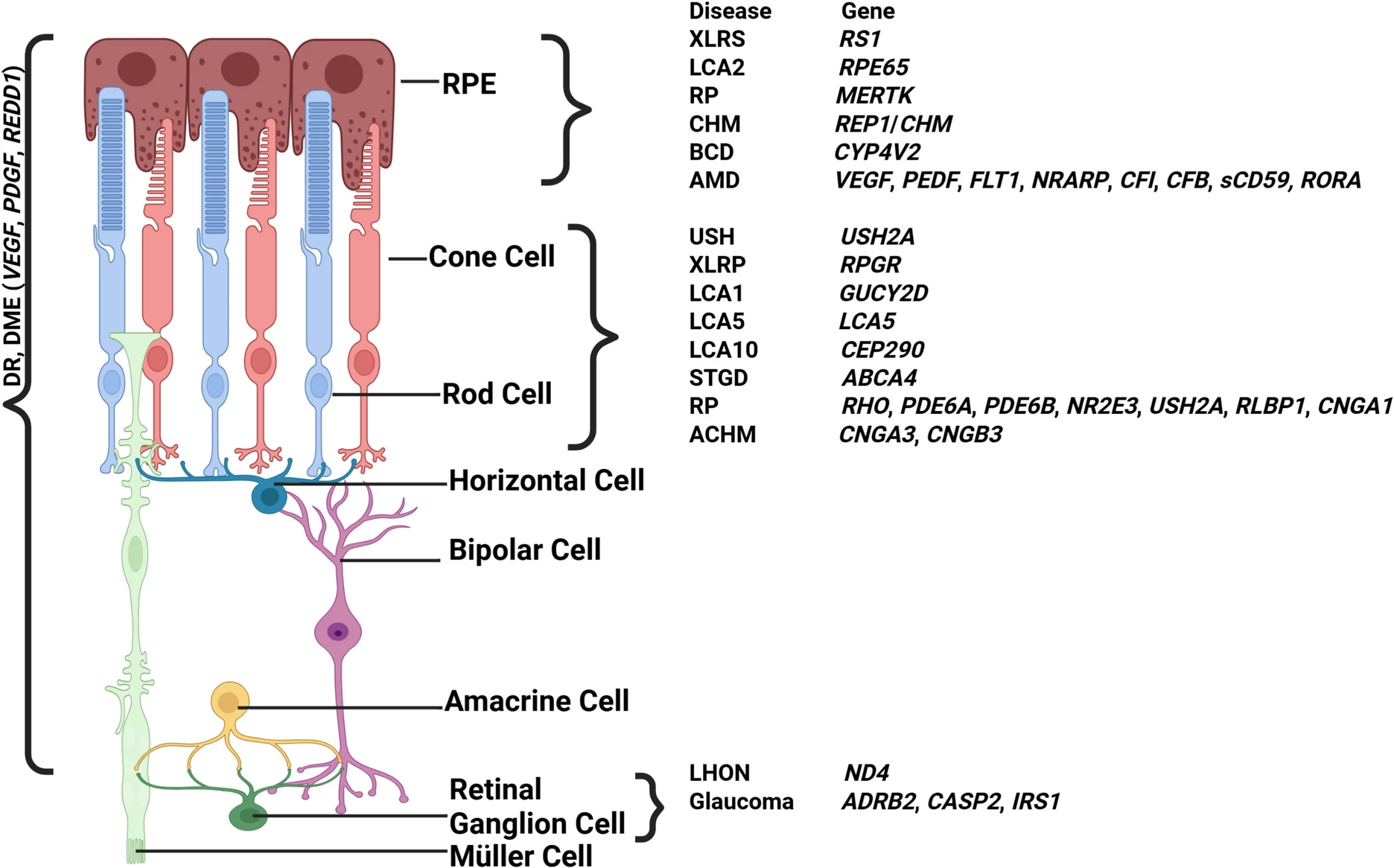
RPE:視網(wǎng)膜色素上皮;DR:糖尿病視網(wǎng)膜病變;DME:糖尿病性黃斑水腫;XLRS:X連鎖視網(wǎng)膜劈裂癥;LCA:萊伯氏先天性黑蒙;RP:視網(wǎng)膜色素變性;CHM:脈絡膜視網(wǎng)膜病變;BCD:比埃蒂晶體營養(yǎng)不良癥;AMD:老年性黃斑變性;USH:烏謝爾綜合征;XLRP:X連鎖視網(wǎng)膜色素變性;STGD:斯塔加特病;ACHM:全色盲。LHON:萊伯氏遺傳性視神經(jīng)病變
截至今日,研究人員正在研究多種有望推進視網(wǎng)膜疾病基因治療的策略,旨在提高安全性和有效性。其中一個關鍵的關注領域是開發(fā)先進的視網(wǎng)膜成像技術,例如自適應光學、微視野測量和OCT血管造影,這些技術有助于識別疾病發(fā)生和進展的早期臨床生物標志物,從而能夠及時干預并保護視覺功能。
干細胞治療視網(wǎng)膜退行性疾病的研究進展
干細胞療法是再生醫(yī)學,尤其是眼科領域中最令人興奮的研究方向之一,為治療 RDDs提供了巨大潛力。
基本原理與細胞來源:干細胞具有無限自我更新和分化為多種細胞類型的獨特能力。
干細胞療法旨在通過移植外源性干細胞或激活內(nèi)源性干細胞來替換或修復功能失調(diào)的視網(wǎng)膜細胞(如感光細胞PR、視網(wǎng)膜色素上皮RPE、視網(wǎng)膜神經(jīng)節(jié)細胞RGC),從而恢復視力。
此外,干細胞還能分泌具有神經(jīng)營養(yǎng)、免疫調(diào)節(jié)和抗血管生成特性的生物活性因子,創(chuàng)造支持性微環(huán)境促進修復。
用于RDD治療的細胞類型多樣,包括:
- 人類胚胎干細胞 (hESC)
- 人誘導多能干細胞 (iPSC)
- 間充質(zhì)干細胞 (MSC) -來源廣泛(骨髓、臍帶、脂肪等)
- 神經(jīng)干/祖細胞 (NSC/NPC)
- 視網(wǎng)膜干/祖細胞 (RSC/RPC)
人類胚胎干細胞(hESC)治療視網(wǎng)膜退行性疾病
基礎研究與分化潛力:hESC因其強大的自我更新和多向分化能力被視為關鍵資源。研究證實,hESC能成功分化為多種視網(wǎng)膜細胞類型,包括視網(wǎng)膜祖細胞(RPC)、感光細胞(PR)前體、成熟的PR細胞以及視網(wǎng)膜色素上皮(RPE)細胞。移植到動物模型中的這些分化細胞展現(xiàn)出與天然細胞相似的形態(tài)、特異性標志物表達和功能性特征,為治療視網(wǎng)膜退行性疾病(RDD)提供了潛在的供體細胞來源。
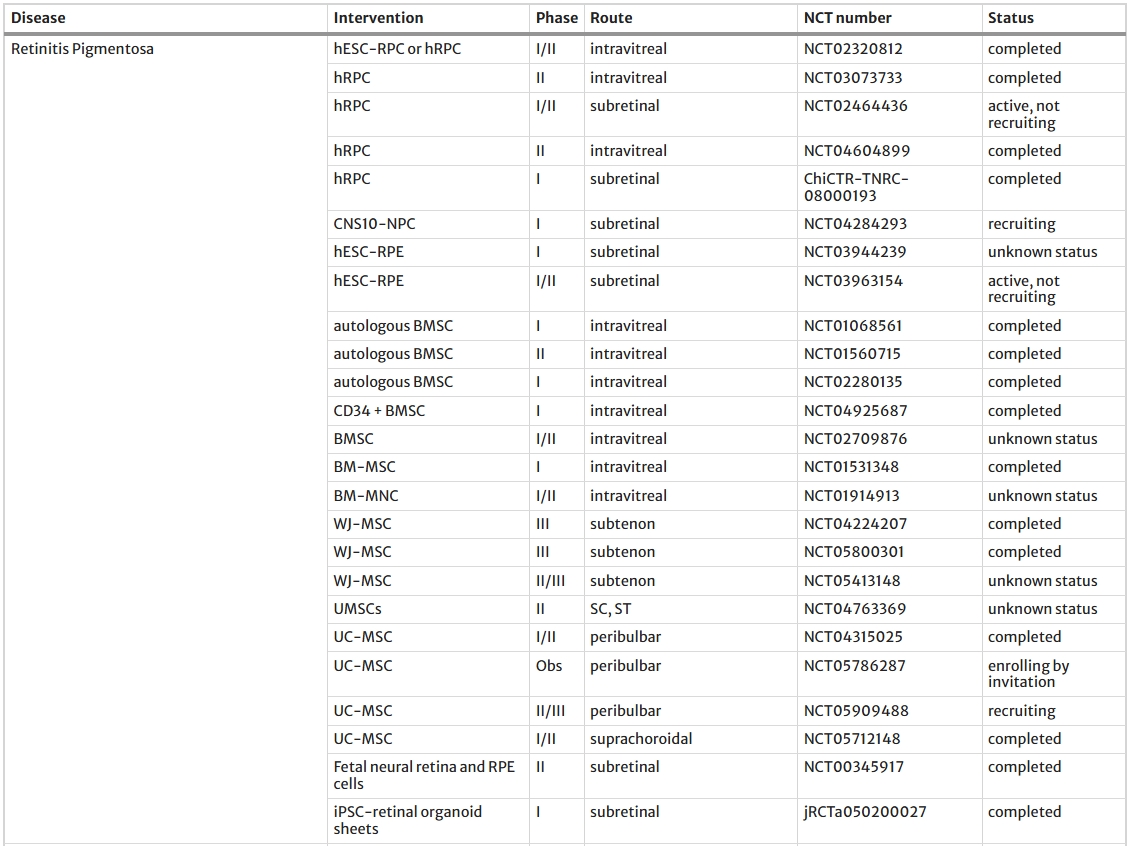
目前,全球大多數(shù)涉及基于干細胞的RDD療法的臨床試驗都圍繞hESC衍生的RPE細胞進行(表2)。
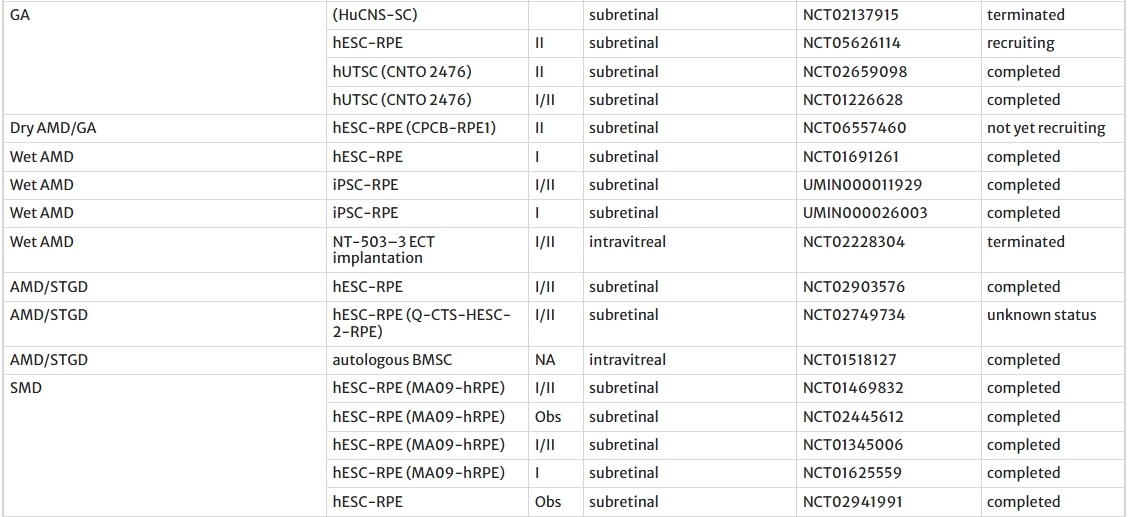
胚胎干細胞衍生的RPE細胞移植治療視網(wǎng)膜退行性疾病
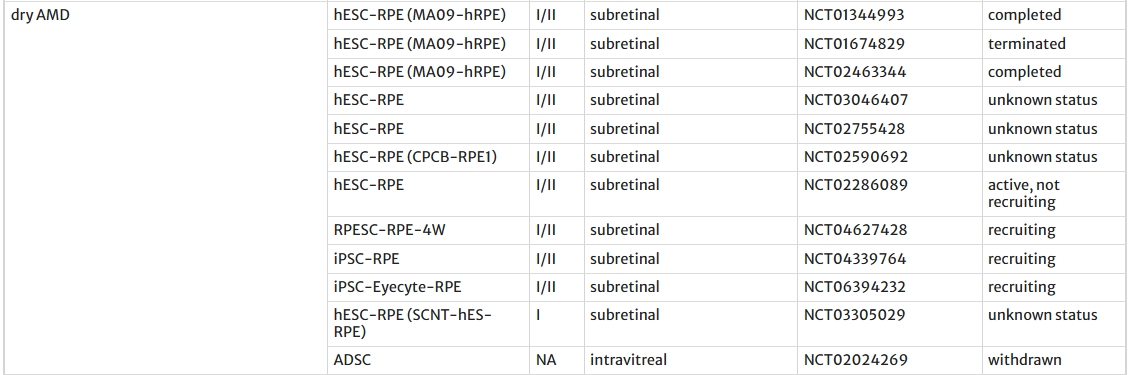
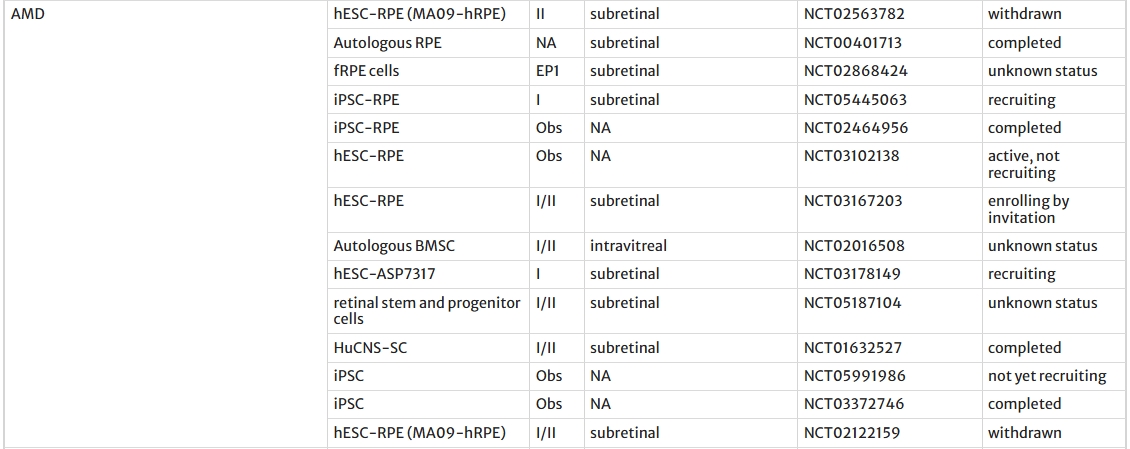
干性黃斑變性(AMD)與斯特格病(STGD):全球超20項臨床試驗進行中(如NCT01344993、NCT02463344)。
2016年,Schwartz等人在安斯泰來的支持下,在美國進行了首批獲得FDA批準的臨床試驗(NCT01344993、NCT01345006),將hESC-RPE細胞移植到AMD和STGD患者體內(nèi)。結(jié)果顯示患者的視覺功能得到改善,確立了hESC衍生細胞的治療潛力。
此外,還進行了其他試驗,以評估hESC-RPE細胞對AMD(NCT02463344、NCT01691261)、STGD(NCT01469832、NCT02445612、NCT01625559、NCT02941991)和AMD/STGD(NCT02903576)的安全性和有效性。
細胞存活長達3年,未報告腫瘤形成或嚴重排異。
視網(wǎng)膜色素變性(RP):法國與中國I/II期試驗(NCT03963154、NCT03944239)初步驗證hESC-RPE單層細胞的安全性。
挑戰(zhàn)與前景:盡管取得顯著進展,hESC臨床應用仍面臨主要挑戰(zhàn),即潛在的免疫排斥風險,通常需要伴隨免疫抑制治療。不過,中國的一項I期試驗 (NCT03566147) 正在研究表明同種異體來源的hESC衍生細胞可能具有較低免疫原性,或可減少對免疫抑制的依賴。
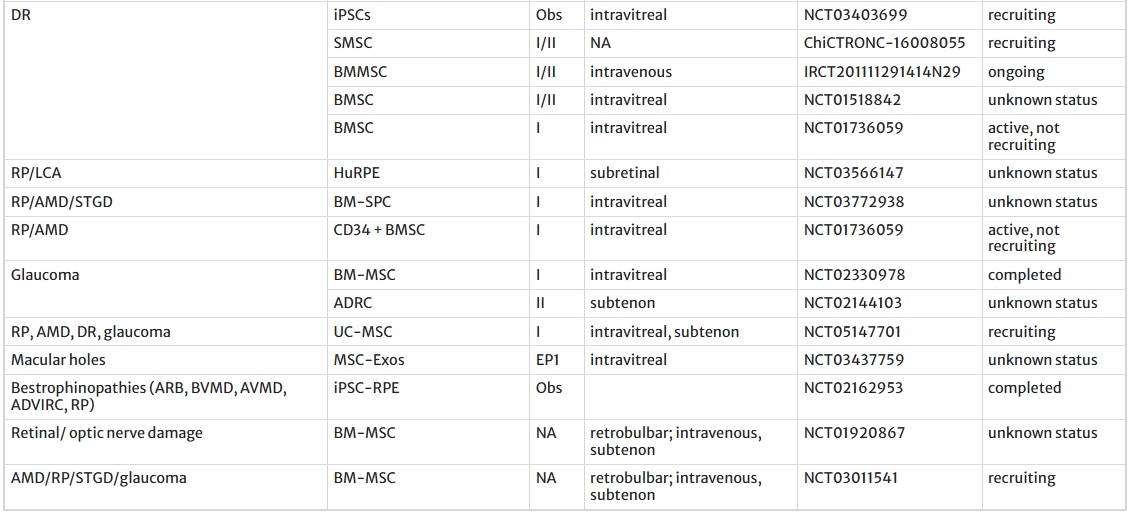
間充質(zhì)干細胞(MSCs)治療視網(wǎng)膜退行性疾病
間充質(zhì)干細胞 (MSC) 具有自我更新能力,是多能干細胞,存在于骨髓、臍帶和脂肪組織等組織中,可分化為各種細胞類型。MSC的顯著優(yōu)勢在于它們不需要免疫抑制,這種獨特的特性使其在視網(wǎng)膜疾病等治療領域具有潛力。此外,MSC還具有抗炎特性,分泌生長因子,并有助于組織再生,使其適用于視網(wǎng)膜退行性細胞治療。
巴西團隊的開拓性研究:巴西Siqueira團隊主導了首項針對視網(wǎng)膜色素變性(RP)的自體骨髓干細胞(BMSC)治療I期臨床試驗(NCT01068561)。該研究在10個月隨訪中證實療法無結(jié)構(gòu)或功能毒性,安全性可靠。
隨后,該團隊進一步將自體BMSC應用擴展至年齡相關性黃斑變性(AMD)和斯特格病(STGD)患者(NCT01518127),并針對RP開展了多項追加試驗(NCT01560715、NCT02280135),為自體干細胞治療奠定了安全基礎。
全球通過多類型干細胞對治療視網(wǎng)膜退行性疾病的臨床探索:除骨髓干細胞外,全球多個團隊正積極評估不同來源干細胞的潛力:
- CD34+骨髓細胞(Park團隊:NCT01736059、NCT04925687)用于AMD/RP;
- 臍帶間充質(zhì)干細胞(UCMSC)(NCT04315025、NCT05712148)與華通氏膠MSC(WJ-MSC)(III期試驗NCT04224207、NCT05800301)治療RP;
- 人臍帶組織干細胞(hUTSC)(NCT01226628、NCT02659098)靶向AMD相關地圖狀萎縮;
- 自體脂肪來源再生細胞(ADRC)(NCT02144103)探索青光眼治療。
多中心項目(如SCOTS/SCOTS2系列試驗NCT01920867、NCT03011541)則系統(tǒng)驗證自體骨髓間充質(zhì)干細胞(BM-MSC) 在RP中的安全性與有效性。
疾病導向的臨床試驗布局:針對糖尿病視網(wǎng)膜病變(DR),五項臨床試驗正推進不同干細胞療法:
- 誘導多能干細胞(iPSC)(NCT03403699);
- 骨髓干細胞(BMSC)(NCT01518842、NCT01736059);
- 骨髓間充質(zhì)干細胞(BM-MSC)(IRCT201111291414N29);
- 滑膜干細胞(SMSC)(ChiCTR-ONC-16008055)。
此外,自體BM-MSC(已完成I期NCT02330978)和臍帶MSC(NCT04763369等四項新試驗)在RP治療中持續(xù)積累安全性與療效數(shù)據(jù)。
關鍵總結(jié):全球臨床試驗網(wǎng)絡正密集探索骨髓、臍帶、脂肪、滑膜等多來源干細胞治療視網(wǎng)膜疾病的潛力,覆蓋RP、AMD/STGD、DR、青光眼等主要致盲性疾病。巴西團隊的自體BMSC研究為安全性樹立標桿,而臍帶與華通氏膠來源干細胞因易獲取、低免疫原性成為III期試驗重點,彰顯干細胞療法向臨床轉(zhuǎn)化加速推進的趨勢。
誘導性多能干細胞 (iPSC)治療視網(wǎng)膜退行性疾病與核心優(yōu)勢
iPSC技術通過重編程體細胞獲得多能性,兼具ESC的分化潛力,并擁有兩大核心優(yōu)勢:來源廣泛(患者自體或HLA配型庫)和低免疫排斥風險。
在視網(wǎng)膜領域,iPSC已成功分化為視網(wǎng)膜色素上皮(RPE)細胞、感光細胞等關鍵類型,為個性化移植療法奠定基礎。例如,日本團隊利用iPSC-RPE細胞治療年齡相關性黃斑變性(AMD),證實其可整合宿主視網(wǎng)膜并維持視力。
全球臨床試驗進展
日本引領了iPSC視網(wǎng)膜治療的臨床轉(zhuǎn)化:
- 自體移植:2013年高橋政代團隊完成首例自體iPSC-RPE片移植治療濕性AMD(UMIN000011929),術后視力穩(wěn)定且無排斥;
- 異體移植:2017年啟動HLA匹配異體iPSC-RPE懸浮液試驗(UMIN000026003),5例患者細胞存活超1年,僅1例出現(xiàn)輕度可控排斥。
歐美亞多國緊隨其后:英國Moorfields眼科醫(yī)院完成10例AMD患者研究(NCT02464956);美國(NCT04339764)、印度(NCT06394232)和中國(NCT05445063)正推進iPSC-RPE治療AMD的安全性與有效性試驗。此外,iPSC療法擴展至糖尿病視網(wǎng)膜病變(DR),如美國試驗NCT03403699探索其修復血管損傷的潛力。
基于祖細胞的療法治療視網(wǎng)膜退行性疾病
核心概念與潛力:基于祖細胞的療法利用比干細胞更特化的神經(jīng)祖細胞 (NPC) 和視網(wǎng)膜祖細胞 (RPC) 來治療視網(wǎng)膜疾病(如視網(wǎng)膜色素變性RP和年齡相關性黃斑變性AMD)。
這些祖細胞保留了分化成特定視網(wǎng)膜細胞類型的能力,旨在替換或修復受損組織、維持視網(wǎng)膜健康,并為治療提供了一種有前景的策略。它們不僅具有分化潛能,還能分泌神經(jīng)營養(yǎng)因子,支持現(xiàn)有細胞的存活和功能。
神經(jīng)祖細胞 (NPC) 的應用:NPC源自神經(jīng)干細胞譜系,具有多能性,可分化為多種神經(jīng)細胞。
臨床前研究和多項臨床試驗(包括II期NCT00345917、I期NCT04284293、I/II期NCT01632527)已評估或正在評估NPC移植(如胎兒神經(jīng)視網(wǎng)膜組織、人NPC、人中樞神經(jīng)系統(tǒng)干細胞)在RP和AMD患者中的安全性和有效性,旨在替換神經(jīng)元、提供神經(jīng)保護、建立保護層并改善視力功能。
視網(wǎng)膜祖細胞 (RPC) 的應用與前景:RPC源自胎兒視網(wǎng)膜,能分化成關鍵細胞(如光感受器PR、視網(wǎng)膜神經(jīng)節(jié)細胞RGC)并整合入視網(wǎng)膜。臨床前研究顯示RPC移植能阻止疾病進展、恢復視力并改善視網(wǎng)膜功能。
多項臨床試驗(如NCT02320812, NCT03073733, NCT04604899, NCT02464436, NCT05187104, ChiCTR-TNRC-08000193)正在評估RPC治療RP和AMD的安全性、耐受性、有效性和視功能改善潛力。
總體而言,NPC和RPC療法展現(xiàn)出恢復視力的重要前景,但仍需持續(xù)研究以驗證其在人類中的長期安全性和治療效果。
結(jié)論
基因療法和干細胞療法正在深刻改變視網(wǎng)膜變性疾病 (RDD) 的治療格局,為傳統(tǒng)療法無效的患者提供了新的希望。基因療法通過精準靶向遺傳性或獲得性RDD的致病基因突變實現(xiàn)干預;干細胞療法則利用細胞的再生潛力,通過替換或支持受損的視網(wǎng)膜細胞來恢復功能。
盡管仍面臨諸多挑戰(zhàn)(如長期安全性、遞送效率、免疫相容性、成本及規(guī)模化生產(chǎn)),載體設計、基因組編輯(如CRISPR)、生物材料和成像技術等領域的持續(xù)創(chuàng)新正不斷推動該領域向前發(fā)展。隨著越來越多的臨床試驗進入后期階段,這些前沿療法有望為RDD患者帶來視力恢復和生活質(zhì)量提升的實質(zhì)性益處。
參考資料:[1]:Bhat, M.A., Goyal, S. Gene and Stem Cell-Based Therapies for Retinal Degenerative Diseases: Update, Challenges, and Future Directions. Stem Cell Rev and Rep (2025). https://doi.org/10.1007/s12015-025-10927-3
免責說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構(gòu)成任何臨床診斷建議!杭吉干細胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信