腎移植是終末期腎病(ESKD)的首選治療方式,但慢性活動(dòng)性抗體介導(dǎo)排斥反應(yīng)(cABMR)仍是導(dǎo)致移植腎長(zhǎng)期失功的核心因素,約占移植1年后移植物失功病例的65%。
其病理機(jī)制以供體特異性抗體(DSA)觸發(fā)補(bǔ)體活化、內(nèi)皮損傷及微血管炎癥為特征,而現(xiàn)行療法(如RTX/IVIg)對(duì)重度蛋白尿患者療效有限且作用短暫。間充質(zhì)干細(xì)胞(MSCs)憑借獨(dú)特的免疫調(diào)節(jié)功能(如促進(jìn)調(diào)節(jié)性T細(xì)胞增殖、抑制Th1通路),為重構(gòu)免疫耐受提供了新路徑。然而,針對(duì)cABMR的臨床證據(jù)匱乏,其安全劑量窗口與長(zhǎng)期療效仍需系統(tǒng)驗(yàn)證。
腎移植后慢性排斥有救了?間充質(zhì)干細(xì)胞療法安全穩(wěn)定腎功能
近期,國(guó)際權(quán)威期刊雜志《Cytotherapy》發(fā)表了一項(xiàng)“評(píng)估人骨髓異體間充質(zhì)干細(xì)胞療法對(duì)腎移植受者慢性活動(dòng)性抗體介導(dǎo)排斥反應(yīng)的安全性和有效性的臨床試驗(yàn)”[1]。

結(jié)果表明:同種異體人骨髓間充質(zhì)干細(xì)胞 (hBM-MSC) 療法對(duì)伴有cABMR的腎移植接受者 (KTR) 患者總體耐受性良好,并表現(xiàn)出良好的免疫調(diào)節(jié)作用。此外在完成治療的患者中,治療前后6個(gè)月內(nèi)eGFR下降率從16.6%變?yōu)?2.4%,表明eGFR下降趨于穩(wěn)定,蛋白尿顯著降低。
本研究目標(biāo)與創(chuàng)新設(shè)計(jì)
本研究旨在評(píng)估hBM-MSC治療cABMR的安全性和有效性,重點(diǎn)分析其對(duì)移植物功能(如腎功能指標(biāo))及同種免疫應(yīng)答(第三方供體特異性ELISPOT、淋巴細(xì)胞亞群)的影響。創(chuàng)新性地采用傾向評(píng)分匹配法,將hBM-MSC組與既往接受RTX/IVIg標(biāo)準(zhǔn)治療的cABMR患者進(jìn)行對(duì)照,比較移植物存活率及無(wú)感染存活率差異。
通過(guò)整合第三方供體來(lái)源的hBM-MSCs(現(xiàn)成、可擴(kuò)展方案)與深度免疫機(jī)制探索,本研究不僅闡明其調(diào)節(jié)同種免疫的機(jī)制,更為cABMR這一臨床難題提供一種新型、可行的細(xì)胞治療策略。
研究隊(duì)列特征與治療方案
方法:七例cABMR患者接受了四次hBM-MSC(1×10?細(xì)胞/kg)輸注,每?jī)芍芤淮巍?/p>
主要結(jié)局指標(biāo):為臨床安全性,重點(diǎn)關(guān)注短期不良事件。
次要結(jié)局指標(biāo)包括:同種異體移植物功能變化、供體特異性抗人白細(xì)胞抗原抗體 (HLA-DSA) 的平均熒光強(qiáng)度 (MFI)、ELISPOT測(cè)定的同種異體免疫應(yīng)答、淋巴細(xì)胞亞群分析、無(wú)感染生存率,以及通過(guò)傾向評(píng)分匹配與18例歷史對(duì)照者進(jìn)行比較的移植物生存率。
安全性評(píng)估結(jié)果
hBM-MSC輸注后即時(shí)不良反應(yīng)(包括感染、疼痛、水腫、血腫、瘢痕、發(fā)熱等)均未發(fā)生。但1例嚴(yán)重不良事件需關(guān)注:患者#2在完成第四次輸注3周后罹患耶氏肺孢子菌肺炎(PJP),雖經(jīng)抗菌治療,仍于治療后6周(透析期間)死亡。該事件為研究中唯一致死性并發(fā)癥,未發(fā)現(xiàn)其他治療相關(guān)感染或不良反應(yīng),提示hBM-MSC療法整體安全性可控。
hBM-MSC治療的腎功能與免疫指標(biāo)變化
完成4個(gè)周期hBM-MSC治療后,對(duì)6名完成全部治療的患者進(jìn)行了eGFR、血清肌酐 (Cr)、蛋白尿和抗HLA抗體MFI值的變化評(píng)估,并與治療前后6個(gè)月的歷史RTX/IVIg對(duì)照組進(jìn)行了比較。
結(jié)果表明:6例完成全療程的cABMR患者接受hBM-MSC治療后,腎功能惡化顯著減緩(圖1)。
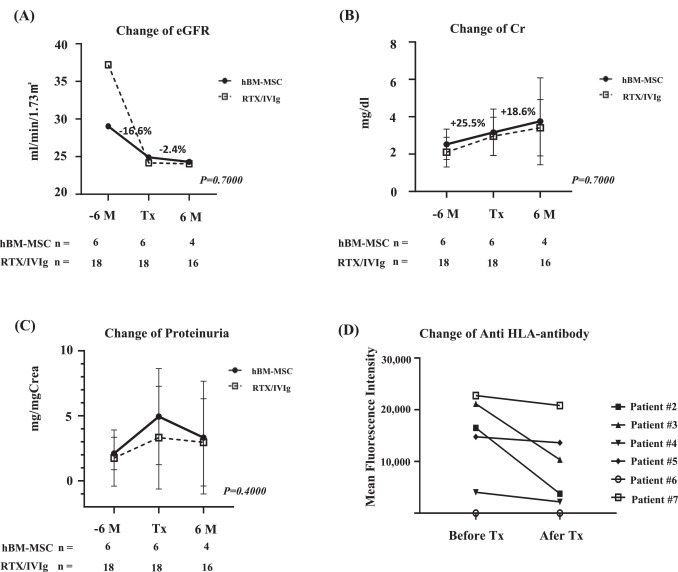
治療前6個(gè)月內(nèi)eGFR急劇下降16.6%,而治療后6個(gè)月僅下降2.4%(24.3±15.1mL/min/1.73m2),表明腎功能趨于穩(wěn)。
血清肌酐(Cr)增幅從治療前25.5%(2.523±0.814→3.167±1.241mg/dL)降至治療后18.6%(3.755±2.327mg/dL),進(jìn)一步印證腎功能衰退速度的延緩。蛋白尿在治療6個(gè)月內(nèi)持續(xù)下降,抗HLA抗體及HLA-DSA的MFI值亦同步降低(圖1C-D)。
關(guān)鍵提示:hBM-MSC對(duì)腎功能的保護(hù)效應(yīng)與傳統(tǒng)RTX/IVIg治療相當(dāng),但額外獲得體液免疫改善。
細(xì)胞免疫應(yīng)答與血清因子趨勢(shì)
為評(píng)估hBM-MSC治療的免疫調(diào)節(jié)效應(yīng),第三方供體抗原刺激的T細(xì)胞ELISPOT分析顯示,IFN-γ產(chǎn)生頻率呈下降趨勢(shì)(圖2A),提示同種免疫反應(yīng)潛在抑制,但未達(dá)統(tǒng)計(jì)學(xué)意義。
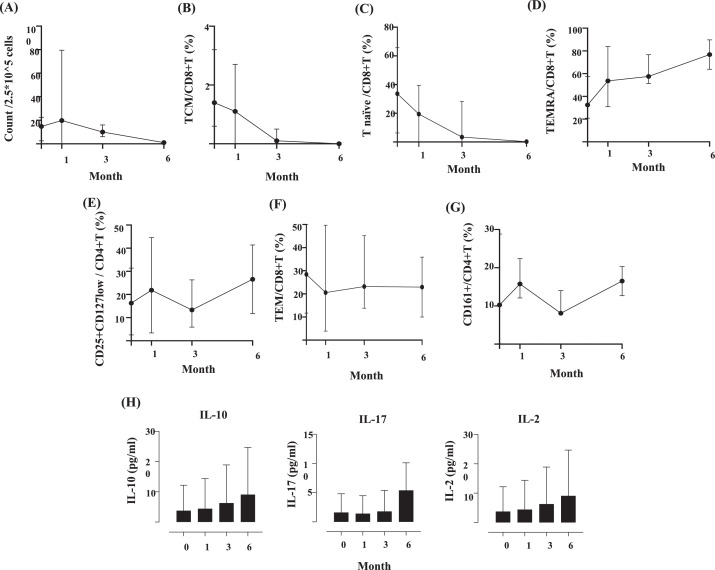
流式細(xì)胞術(shù)動(dòng)態(tài)監(jiān)測(cè)發(fā)現(xiàn):
- T細(xì)胞亞群動(dòng)態(tài):中樞記憶T細(xì)胞(TCM)與初始T細(xì)胞比例下降,終末分化效應(yīng)記憶T細(xì)胞(TEMRA)相對(duì)增加(圖2B-D);
- 調(diào)節(jié)性T細(xì)胞:CD4+CD25+CD127lowT細(xì)胞持續(xù)上升(圖2E);
- 細(xì)胞因子:血清IL-10、IL-17、IL-2水平呈上升趨勢(shì)(圖2H)。
需強(qiáng)調(diào):上述變化均未達(dá)統(tǒng)計(jì)學(xué)意義,效應(yīng)記憶CD8+T細(xì)胞(TEM)與CD4+CD161+T細(xì)胞無(wú)一致趨勢(shì)(圖2F-G),反映hBM-MSC可能通過(guò)調(diào)節(jié)T細(xì)胞分化及免疫耐受相關(guān)因子發(fā)揮治療作用。
與標(biāo)準(zhǔn)治療的臨床結(jié)局對(duì)比
通過(guò)傾向評(píng)分匹配,hBM-MSC組與歷史RTX/IVIg對(duì)照組基線特征無(wú)差異。核心發(fā)現(xiàn):
感染控制:hBM-MSC組感染率數(shù)值更低,但12個(gè)月無(wú)感染生存率無(wú)顯著差異(圖3A, p=0.8140);
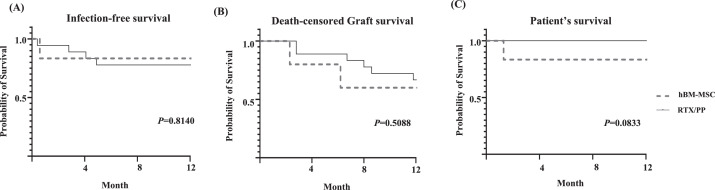
移植物與患者生存:
- 死亡結(jié)尾移植物生存率兩組相當(dāng)(圖3B, p=0.5088);
- 患者生存率差異未達(dá)顯著性(圖3C, p=0.0833),提示hBM-MSC療效不劣于現(xiàn)行標(biāo)準(zhǔn)方案。
研究背景與核心發(fā)現(xiàn)總結(jié)
鑒于當(dāng)前療法對(duì)cABMR的局限性,本研究聚焦hBM-MSC在腎移植受者(KTR)中的治療潛力。既往研究表明MSC可降低移植后感染風(fēng)險(xiǎn)、改善亞臨床排斥及纖維化,但針對(duì)cABMR的研究?jī)H三項(xiàng):Veceric-Haler等報(bào)道無(wú)效,我們前期試驗(yàn)受限于樣本量(n=2)。
本研究創(chuàng)新性地納入6例嚴(yán)重移植物功能障礙的cABMR患者,通過(guò)傾向評(píng)分匹配RTX/IVIg對(duì)照組,系統(tǒng)評(píng)估hBM-MSC的免疫調(diào)節(jié)與臨床療效,為晚期患者提供新治療證據(jù)。
在安全性驗(yàn)證與劑量考量方面
hBM-MSC安全性是臨床轉(zhuǎn)化的核心。本研究基于文獻(xiàn)確定輸注劑量,規(guī)避了低劑量療效不足與高劑量腎損傷/肺栓塞風(fēng)險(xiǎn)。
結(jié)果顯示:無(wú)直接輸注相關(guān)不良反應(yīng)(感染/發(fā)熱/過(guò)敏),且感染率低于RTX/IVIg組。唯一嚴(yán)重事件為1例PJP致死,但歸因于患者基線eGFR重度低下(15mL/min/1.73m2)、免疫抑制狀態(tài)及感染預(yù)防缺失,與hBM-MSC無(wú)直接因果關(guān)聯(lián)。
在有效性方面:腎功能與免疫指標(biāo)改善
hBM-MSC顯著延緩eGFR下降速度(治療前6個(gè)月降幅16.6%→治療后6個(gè)月2.4%),并使蛋白尿降低(圖1A,C)。值得注意的是,治療時(shí)eGFR≤22.65 mL/min/1.73m2的患者仍發(fā)生移植物丟失(補(bǔ)充圖2),提示其難以逆轉(zhuǎn)嚴(yán)重慢性損傷。
免疫學(xué)方面:
- HLA-DSA的MFI值降低,抑制抗體介導(dǎo)損傷;
- 第三方ELISPOT中IFN-γ產(chǎn)生頻率下降,表明同種免疫反應(yīng)受抑。
免疫調(diào)節(jié)機(jī)制關(guān)聯(lián)
hBM-MSC輸注后出現(xiàn)關(guān)鍵免疫表型重塑:
- T細(xì)胞亞群:Tregs(CD4?CD25?CD127)與終末分化TEMRA細(xì)胞增加,初始T細(xì)胞及TCM細(xì)胞減少(圖2B-E);
- 血清因子:IL-10/IL-17/IL-2呈上升趨勢(shì)。
該現(xiàn)象印證了hBM-MSC通過(guò)激活調(diào)節(jié)性免疫、抑制過(guò)度炎癥保護(hù)移植物,且與既往發(fā)現(xiàn)的CD161?CD4?T細(xì)胞減少機(jī)制互補(bǔ)。
臨床意義與研究局限
臨床意義:本研究表明,hBM-MSC治療cABMR安全性可控,且能穩(wěn)定腎功能(eGFR下降率從-16.6%減緩至-2.4%)并降低DSA水平。
其機(jī)制可能與Tregs擴(kuò)增及同種免疫反應(yīng)抑制相關(guān)(如ELISPOT中IFN-γ頻率下降)。值得注意的是,當(dāng)基線eGFR≤22.65mL/min/1.73m2時(shí)療效受限,提示需早期干預(yù)。
研究局限:盡管hBM-MSC組移植物/患者生存率與對(duì)照組無(wú)統(tǒng)計(jì)學(xué)差異(圖3B-C, p>0.05),但其實(shí)現(xiàn)腎功能穩(wěn)定與炎癥標(biāo)志物下降,凸顯調(diào)控cABMR進(jìn)展的潛力。鑒于cABMR涉及復(fù)雜體液/細(xì)胞免疫反應(yīng),且腎小球炎等病理提示不良預(yù)后,未來(lái)需擴(kuò)大樣本、延長(zhǎng)隨訪以驗(yàn)證長(zhǎng)期療效。hBM-MSC作為現(xiàn)成、可擴(kuò)展療法,仍是突破當(dāng)前治療困境的重要方向。
寫(xiě)在最后:hBM-MSC療法在cABMR患者中耐受性良好,并通過(guò)免疫調(diào)節(jié)穩(wěn)定腎功能,尤其為傳統(tǒng)治療應(yīng)答不佳的晚期患者提供了新選擇。第三方供體hBM-MSCs的現(xiàn)成可用性,使其成為具臨床轉(zhuǎn)化潛力的實(shí)用策略。
主要參考資料:
[1]https://www.sciencedirect.com/science/article/abs/pii/S1465324925007224
免責(zé)說(shuō)明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專(zhuān)業(yè)建議。如有版權(quán)等疑問(wèn),請(qǐng)隨時(shí)聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信