自20世紀(jì)60年代起,Carlsson、Hornykiewicz、Cotzias和Yahr發(fā)現(xiàn)帕金森病(PD)患者黑質(zhì)多巴胺缺乏,并引入了多巴胺替代療法以來,大量藥物和神經(jīng)調(diào)控治療已有效緩解運(yùn)動(dòng)癥狀。在再生醫(yī)學(xué)領(lǐng)域,PD一直是細(xì)胞治療的關(guān)鍵目標(biāo),旨在改善癥狀并實(shí)現(xiàn)疾病修飾,過去幾十年里已在臨床上探索了多種方法。
細(xì)胞治療帕金森病的兩大策略:移植與輸注的利弊
PD的干細(xì)胞治療主要遵循兩大策略:細(xì)胞移植和靜脈輸注(IV)。細(xì)胞移植是研究較為廣泛的方法,旨在將干細(xì)胞分化為多巴胺能神經(jīng)元,以直接恢復(fù)神經(jīng)遞質(zhì)傳遞。然而,該方法存在諸多局限,包括細(xì)胞來源的倫理問題、手術(shù)植入的侵入性、潛在的腫瘤形成風(fēng)險(xiǎn)、免疫原性以及移植物誘導(dǎo)的運(yùn)動(dòng)障礙等,這些因素共同限制了其在輕中度PD患者中的應(yīng)用。
相比之下,間充質(zhì)干細(xì)胞(MSCs)的靜脈輸注逐漸成為一種更具前景且安全的治療選擇。這類細(xì)胞因其強(qiáng)大的免疫調(diào)節(jié)功能而受到關(guān)注,能夠通過調(diào)節(jié)外周免疫系統(tǒng)來改善PD的核心病理環(huán)節(jié)——神經(jīng)炎癥。此外,MSCs還具有免疫原性低、致瘤風(fēng)險(xiǎn)小、易于從多種組織中獲取并實(shí)現(xiàn)規(guī)模化生產(chǎn)、倫理爭(zhēng)議較少等綜合優(yōu)勢(shì)。
間充質(zhì)干細(xì)胞治療帕金森病的作用機(jī)制:系統(tǒng)性免疫調(diào)節(jié)與神經(jīng)營養(yǎng)支持
在PD動(dòng)物模型中,MSCs被證明可通過多靶點(diǎn)機(jī)制減少小膠質(zhì)細(xì)胞活化,并促進(jìn)多巴胺神經(jīng)元存活。雖然有研究表明,MSCs可能遷移至黑質(zhì)并通過與多巴胺能細(xì)胞直接相互作用抑制小膠質(zhì)細(xì)胞活化,但由于其直徑(15–30μm)較大,約80%–90%會(huì)被困在肺部狹窄的毛細(xì)血管中,因而直接植入極為罕見且短暫。
其核心作用機(jī)制在于系統(tǒng)性免疫調(diào)節(jié)和神經(jīng)營養(yǎng)支持。目前認(rèn)為,MSCs或其分泌體(如細(xì)胞外囊泡和外泌體)作為“微工廠”發(fā)揮作用,通過釋放抗炎細(xì)胞因子(如TGF-β、IL-10、PGE2)來調(diào)節(jié)全身免疫反應(yīng),并可能降低血腦屏障的通透性。
同時(shí),它們還能分泌多種神經(jīng)營養(yǎng)因子(如BDNF、GDNF、NGF),從而促進(jìn)神經(jīng)元存活、修復(fù)與突觸可塑性。在PD動(dòng)物模型中,MSCs被證實(shí)可通過這些多靶點(diǎn)機(jī)制抑制小膠質(zhì)細(xì)胞活化,并支持多巴胺能神經(jīng)元存活,從而有望干預(yù)疾病的病理進(jìn)程。
從理論到實(shí)踐:I期臨床研究啟示與II期試驗(yàn)設(shè)計(jì)
基于上述理論,美國德克薩斯大學(xué)麥戈文醫(yī)學(xué)院(以下簡(jiǎn)稱“我們”)于2021年開展了一項(xiàng)I期單劑量遞增試驗(yàn),采用來自健康供體的同種異體骨髓來源MSCs(allo-hMSCs)。該策略充分利用了“現(xiàn)成”同種異體細(xì)胞的優(yōu)勢(shì),包括可實(shí)現(xiàn)大規(guī)模生產(chǎn)、無需進(jìn)行患者個(gè)體化的細(xì)胞采集,以及能提供更年輕、活性更高的細(xì)胞,從而減少因供體衰老帶來的潛在風(fēng)險(xiǎn)[1]。

試驗(yàn)結(jié)果顯示,在輕中度PD患者中,單次靜脈輸注1–10×10?allo-MSCs/kg劑量安全且耐受良好,未引發(fā)免疫原性反應(yīng)。探索性分析表明,接受最高劑量(10×10?cells/kg)的患者在輸注后3、12、24及52周的“停藥”狀態(tài)下,其統(tǒng)一帕金森病評(píng)定量表(UPDRS)運(yùn)動(dòng)評(píng)分均顯示改善,并且癥狀獲益隨時(shí)間保持穩(wěn)定。
基于這些鼓舞人心的結(jié)果,并結(jié)合帕金森病慢性進(jìn)展的特性,我們提出假設(shè):反復(fù)輸注最高安全劑量的allo-hMSCs可能會(huì)增強(qiáng)和維持其免疫調(diào)節(jié)效應(yīng),從而帶來更顯著、更持久的臨床癥狀改善。
為驗(yàn)證該假設(shè),我們牽頭開展了一項(xiàng)II期雙盲、隨機(jī)、安慰劑對(duì)照試驗(yàn),旨在評(píng)估重復(fù)allo-hMSC輸注對(duì)改善PD患者運(yùn)動(dòng)及非運(yùn)動(dòng)癥狀的療效。(研究結(jié)果發(fā)表在期刊雜志《運(yùn)動(dòng)障礙主頁》上)[2]。

II期臨床試驗(yàn)概況
研究設(shè)計(jì)與方法:在這項(xiàng)II期隨機(jī)安慰劑對(duì)照試驗(yàn)(2020年11月至2023年7月)中,輕度至中度帕金森病患者接受三次異基因hMSC輸注,一次安慰劑輸注后再進(jìn)行兩次異基因hMSC輸注,或以18周為間隔進(jìn)行三次安慰劑輸注,隨訪持續(xù)88周。
主要結(jié)局指標(biāo)為第62周時(shí),在停藥后運(yùn)動(dòng)障礙協(xié)會(huì)主辦的統(tǒng)一帕金森病評(píng)定量表第三部分修訂版(MDS-UPDRS-III)中,患者比例改善≥5分的后驗(yàn)概率(PP)差異是否大于70%。使用Rv4.2.0進(jìn)行貝葉斯分析。
試驗(yàn)人群:總共有160名患者接受了預(yù)篩選,49名接受了篩選,45名最終入組。其中,16名接受了三次異基因hMSC輸注,14名接受了一次安慰劑輸注,隨后又接受了兩次異基因hMSC輸注,15名接受了三次安慰劑輸注。基線人口統(tǒng)計(jì)學(xué)和臨床特征見表1。
到第62周,42名患者完成了所有輸注和評(píng)估;兩名患者退出,一名患者在被診斷為多系統(tǒng)萎縮(經(jīng)αSyn-SAA證實(shí))后被排除在外。另外兩名患者因不相關(guān)的健康問題停止研究,剩下40名患者完成了88周的隨訪(圖1)。

同種異體骨髓間充質(zhì)干細(xì)胞治療帕金森病的主要結(jié)果
第62周運(yùn)動(dòng)癥狀改善的組間差異
三次輸注在第62周的臨床重要改善:第62周時(shí),三次輸注組中MDS-UPDRS-III運(yùn)動(dòng)評(píng)分改善≥5分的受試者比例與安慰劑組相比有所增加(圖2A)。使用更嚴(yán)格的閾值(≥11分),三次輸注組中改善的受試者比例與安慰劑組相比有所增加(圖2B)。
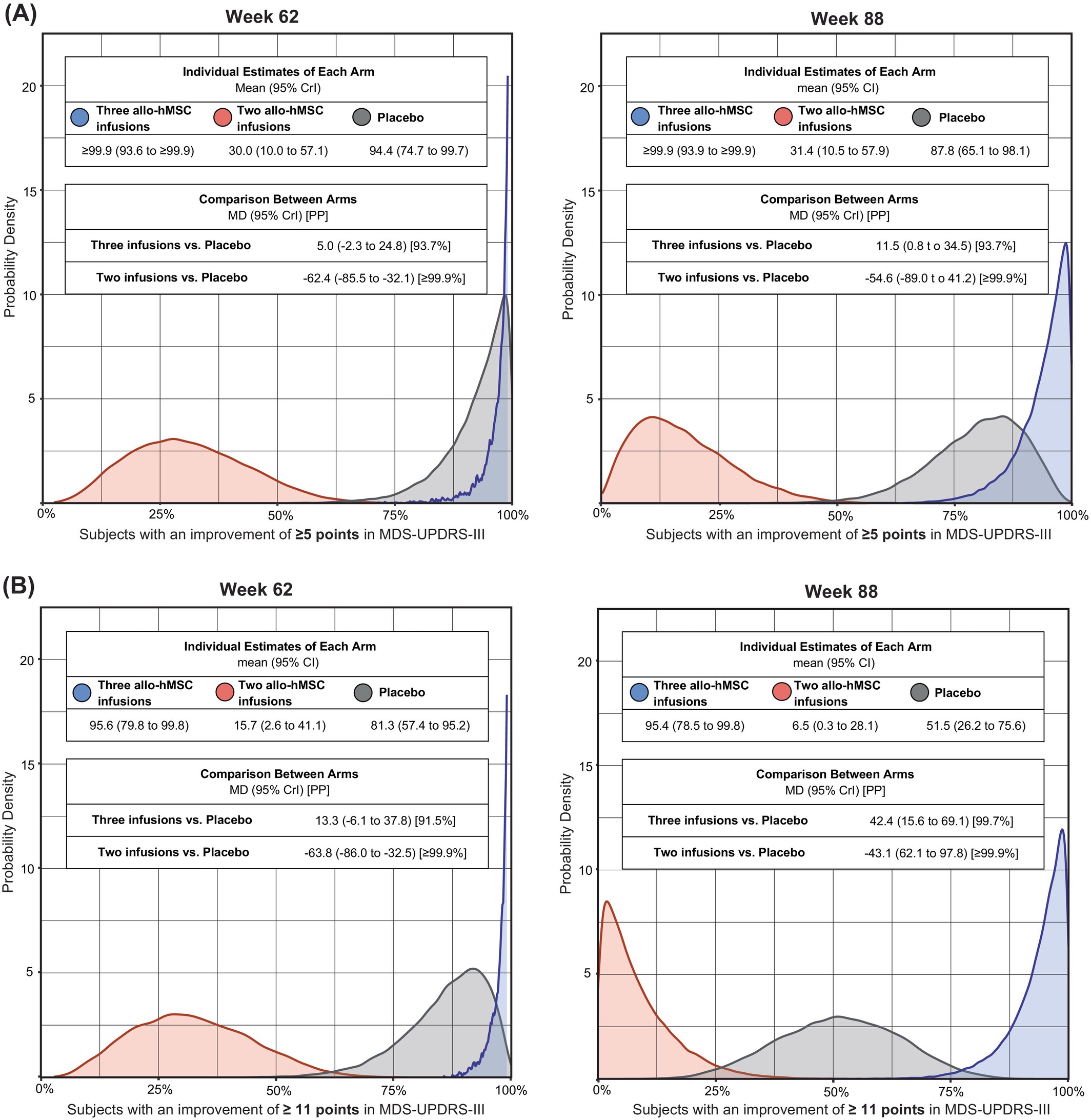
兩次輸注組的負(fù)面療效表現(xiàn):相反,與安慰劑組相比,兩次輸注組中達(dá)到≥5分(圖2A)和≥11分(圖2B)閾值的受試者較少。雖然置信區(qū)間存在一定交叉,但總體趨勢(shì)支持三次輸注方案的潛在獲益。
同種異體骨髓間充質(zhì)干細(xì)胞治療帕金森病的次要結(jié)局
其他次要臨床結(jié)局的結(jié)果,包括從基線起MDS-UPDRS各部分(I、II、III、IV)、總分、PDQ-39以及EQ-5D-5L指數(shù)評(píng)分的變化,見表2。
MDS-UPDRS-III評(píng)分變化趨勢(shì):從基線到第88周
至第62周,三次輸注組評(píng)分較基線改善16.9分,接近安慰劑組的14.6分改善,兩組間差異僅為2.3分。而兩次輸注組僅改善3.9分,顯著劣于安慰劑組(組間差異+20.6分)。這一趨勢(shì)持續(xù)至第88周,三次輸注組優(yōu)勢(shì)擴(kuò)大至3.3分(表2)。各訪視時(shí)平均MDS-UPDRS-III評(píng)分的變化匯總于圖3。
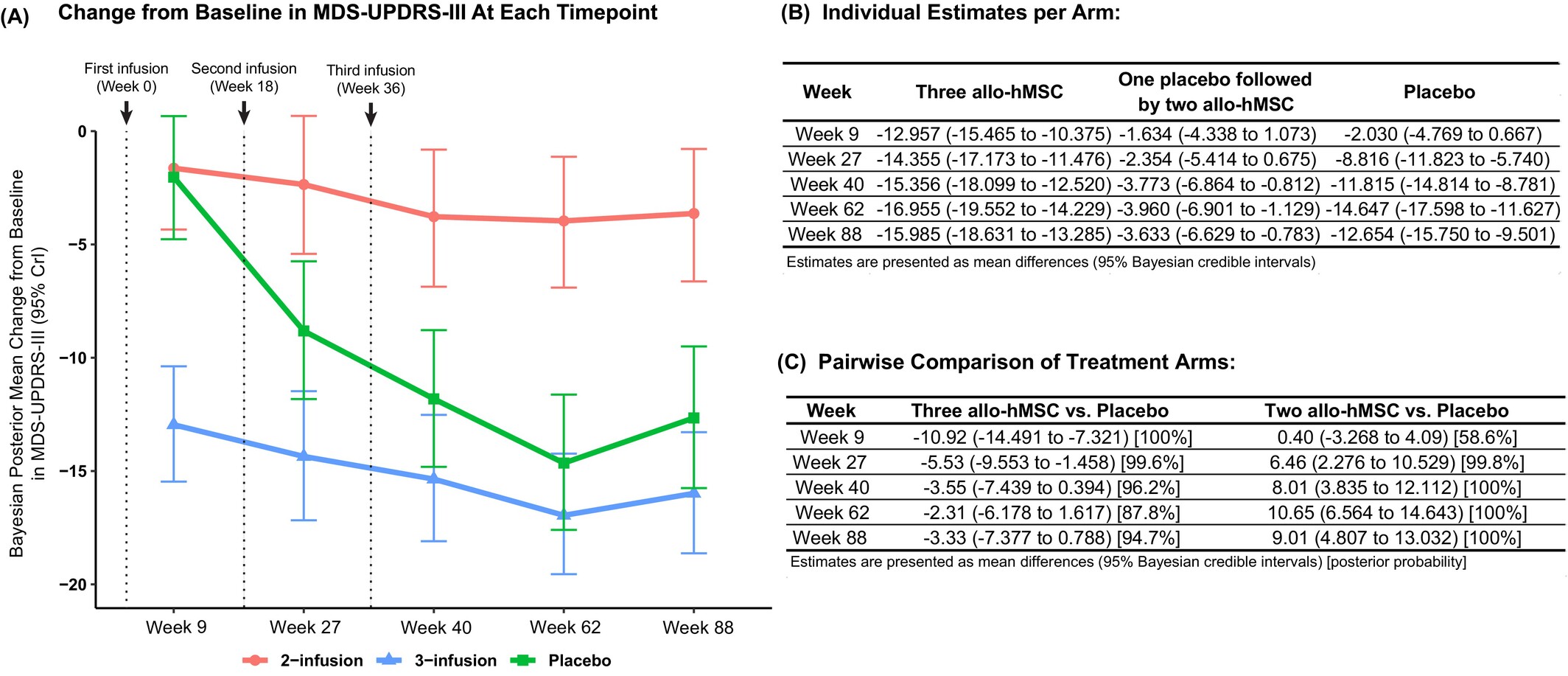
長(zhǎng)期療效:第88周臨床差異持續(xù)擴(kuò)大
在第88周,三次輸注組中更多受試者達(dá)到至少5分改善(組間差異11.5%,后驗(yàn)概率98.4%,圖2A)和11分改善(組間差異42.4%,后驗(yàn)概率≥99.9%,圖2B),均優(yōu)于安慰劑組。
相反,兩次輸注組受試者達(dá)到5分改善(組間差異54.6%,后驗(yàn)概率99.9%,圖2A)和11分改善(MD:?43.1%,95%CrI:?69.8%至 ?13.6%,PP=99.7%;圖2B)的比例均低于安慰劑組。
總體評(píng)估:MDS-UPDRS總分的改善
在總分改善方面,三次輸注組在第62周時(shí)有更多參與者達(dá)到至少12分改善(MD:22.0%,95%CrI:?21.0%至49.4%,PP=96.3%),在第88周改善更為顯著(MD:48.4%,95%CrI:23.9%至74.0%,PP≥99.9%)。
相反,兩次輸注組在第62周(MD:?43.0%,95%CrI:?71.2%至 ?8.3%,PP=99.1%)和第88周(MD?20.8%,95%CrI:?53.1%至14.1%,PP=87.8%)均劣于安慰劑組。
治療安全性與免疫反應(yīng)評(píng)估
安全性結(jié)果是本研究的亮點(diǎn)之一。整個(gè)研究期間:共報(bào)告10例輕微、短暫的治療相關(guān)不良事件,無任何嚴(yán)重不良事件(SAEs)發(fā)生。三次輸注組報(bào)告了個(gè)別不適癥狀(如全身不適、短暫性高血壓)。兩次輸注組報(bào)告的癥狀均為自限性的全身癥狀(如疲勞、流感樣癥狀),均自行緩解。
起初有三例疑似供者特異性抗體(DSA)的反應(yīng),經(jīng)后續(xù)HLA分型確認(rèn)均與治療無關(guān),其中一例實(shí)際來自安慰劑組。
結(jié)果表明,重復(fù)輸注同種異體hMSCs安全且耐受性良好,未引發(fā)顯著的免疫原性或任何致瘤性擔(dān)憂。
綜合討論:療效差異的解讀與啟示
主要療效結(jié)果:三次輸注組顯著優(yōu)于安慰劑
分析顯示,主要療效結(jié)果已達(dá)到。與安慰劑組相比,接受三次輸注的治療組在第62周時(shí)有更高比例的患者實(shí)現(xiàn)MDS-UPDRS-III評(píng)分≥5分(高出5%)和≥11分(高出13.3%)的改善,且該優(yōu)勢(shì)到第88周時(shí)進(jìn)一步擴(kuò)大(分別高出11.5%和42.4%),后驗(yàn)概率均高于91.5%,顯示出強(qiáng)烈的統(tǒng)計(jì)學(xué)意義。
起效時(shí)間與作用機(jī)制推測(cè)
三次輸注組起效迅速,首次輸注后9周即觀察到顯著運(yùn)動(dòng)癥狀改善(降低12.9分),這表明同種異體hMSC可能在給藥后通過快速調(diào)節(jié)免疫微環(huán)境發(fā)揮治療作用。相比之下,兩次輸注組效果延遲且微弱,推測(cè)較晚輸注時(shí)炎癥環(huán)境已改變,可能導(dǎo)致細(xì)胞療效降低。
兩次輸注組療效欠佳的可能解釋
該組療效低于安慰劑的現(xiàn)象值得深入探討,可能原因包括:
強(qiáng)大的安慰劑效應(yīng):安慰劑組顯示了持續(xù)且顯著的改善(改善14.6分),這可能掩蓋了兩次輸注方案帶來的微小獲益。
輸注時(shí)機(jī)與免疫環(huán)境:推測(cè)首次輸注安慰劑時(shí),患者處于更具反應(yīng)性的炎癥狀態(tài),而延遲輸注活性細(xì)胞時(shí),免疫環(huán)境可能已發(fā)生改變,導(dǎo)致細(xì)胞療效降低。
批次間變異性:不同生產(chǎn)批次的MSCs在功能效價(jià)上可能存在差異,影響了治療效果的一致性。
生活質(zhì)量指標(biāo)與多維評(píng)估的重要性
除了運(yùn)動(dòng)評(píng)分,PDQ-39和EQ-5D-5L等生活質(zhì)量指標(biāo)顯示,治療組在患者日常功能和幸福感方面優(yōu)于安慰劑組,且改善持續(xù)更久。這凸顯了運(yùn)動(dòng)評(píng)估(MDS-UPDRS-III)存在局限性,在PD臨床試驗(yàn)中納入患者報(bào)告的生活質(zhì)量等多維終點(diǎn)至關(guān)重要。
結(jié)論
據(jù)我們所知,這是首個(gè)采用三次重復(fù)靜脈注射劑量(每次10×10^6個(gè)異基因人間充質(zhì)干細(xì)胞/千克)的隨機(jī)、安慰劑對(duì)照試驗(yàn)。
該研究達(dá)到了其主要療效終點(diǎn):與安慰劑相比,三次注射劑量(每次10×10 6個(gè)異基因人間充質(zhì)干細(xì)胞/千克)治療有超過70%的可能性改善了輕度至中度帕金森病患者的運(yùn)動(dòng)評(píng)分。安慰劑組患者的運(yùn)動(dòng)評(píng)分顯著改善,而兩次輸注組的改善程度則略遜一籌,這值得進(jìn)一步研究和臨床試驗(yàn)。
該治療耐受性良好,所有報(bào)告的不良事件均為輕微且短暫的。未發(fā)現(xiàn)嚴(yán)重的治療相關(guān)不良事件,也未報(bào)告免疫原性或致瘤性。這些結(jié)果支持了一種非侵入性、可擴(kuò)展且符合倫理道德的帕金森病干細(xì)胞療法的安全性和潛在療效。
未來需要進(jìn)行額外的功能效價(jià)測(cè)定,以確保異基因人間充質(zhì)干細(xì)胞批次的一致性和可靠性。需要進(jìn)一步進(jìn)行大規(guī)模、多中心研究來證明同種異體hMSCs在減輕PD的運(yùn)動(dòng)和非運(yùn)動(dòng)癥狀方面的全部治療潛力。
參考資料:
表1,表2詳細(xì)結(jié)果可后臺(tái)留言獲取
[1]:https://movementdisorders.onlinelibrary.wiley.com/doi/10.1002/mds.28582
[2]:https://movementdisorders.onlinelibrary.wiley.com/doi/10.1002/mds.70028
免責(zé)說明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請(qǐng)隨時(shí)聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信