2023年2月10日/,據CDE官網公示,武漢光谷中源藥業有限公司提交的”VUM02注射液”獲得臨床試驗默示許可,適應癥為失代償肝硬化。據公開資料披露,武漢光谷中源藥業為中源協和細胞基因工程股份有限公司的全資子公司。
中源協和間充質干細胞療法IND獲批,針對失代償肝硬化
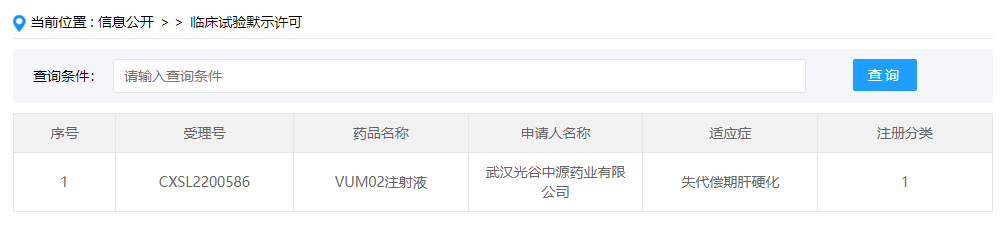
VUM02注射液(人臍帶源間充質干細胞注射液)是其自主研發的冷凍保存型干細胞制劑,是由健康胎兒臍帶組織經體外分離、篩選、擴增后制備的人臍帶源間充質干細胞(UC-MSC)懸液,臨床擬用于治療失代償期肝硬化患者。目前,全球尚未有用于治療失代償期肝硬化的同類細胞藥物上市,研發進展最快的同類藥物處于臨床試驗階段。

中源協和一直在細胞治療領域探索,并致力打造上下游一體的全產業鏈布局。如今,從最上游細胞的存儲,到中游的技術研發,到下游的臨床轉化均有布局。中源協和主營業務覆蓋細胞檢測制備及存儲,體外診斷原料、體外診斷試劑和器械的研產銷,生物基因、蛋白、抗體等科研試劑產品,基因檢測服務,干細胞、免疫細胞臨床應用的研發等“精準醫療”產業鏈,是國家重要的細胞技術產品研發及轉化基地之一。
上游細胞存儲,從中國首批獲得批準成立的天津市臍帶血庫開始到現在,公司已經構建了一個覆蓋整個中國2/3版圖,3/4人口的細胞資源存儲的網絡。中游的藥物研發、轉化上, 中源協和及下屬企業、參股公司已經完成6個干細胞項目備案。參股公司北京三有利和澤生物用于治療慢性牙周炎的干細胞藥物獲得CDE臨床試驗默示許可。參股公司合源生物,適應癥為復發或難治性急性淋巴細胞白血病的CNCT19細胞注射液獲準納入“突破性治療藥物”并進入臨床II期,且已獲批三個適應癥。
下游的臨床應用上,中源協和搶先布局了國內頂尖三甲醫院,近期接連與北京大學第三醫院簽訂《科研合作協議》,與華西精準醫學、華西臨床投資設立成都華西細胞治療研究院有限公司,推動候選藥物進入臨床注冊階段;更快更好地在有資質的醫院開展注冊臨床實驗,更快地推動細胞治療產品的轉化應用與上市。近幾年來,干細胞療法作為一種革命性的治療手段,已經成為我國生物醫藥領域的熱門賽道之一,諸多企業布局了這一賽道。北極星市場研究公司(Polaris Market research)發布的研究報告中指出,2021年,全球間充質干細胞市場估值為24.9億美元,而到了2030年,全球間充質干細胞市場規模預計將達到72.5億美元。
參考資料:1.CDE官網、中源協和官網



 掃碼添加官方微信
掃碼添加官方微信