多能干細胞的自我更新能力及其分化為人體幾乎所有細胞類型的潛力,使其成為制造臨床級細胞療法的寶貴起始材料。神經退行性疾病的特征是神經元結構或功能的逐漸喪失,常導致神經元死亡。由于中樞神經系統的退化,這會導致認知、運動和生理功能的漸進性下降。
在過去二十年中,全面的臨床前有效性(概念驗證)和安全性研究推動了多能干細胞針對多種神經退行性疾病的首次人體I-II期臨床試驗的啟動。
多能干細胞治療逆轉神經退行性疾病:臨床數據揭示神經修復新突破
近日權威期刊雜志《Advanced Drug Delivery Reviews》發表了一項多能干細胞衍生細胞療法在治療神經退行性疾病的臨床研究成果的文章[1]。

研究成果發現多能干細胞治療神經退行性疾病的臨床價值在于其具備自我更新與分化為神經元及膠質細胞的能力,可通過替代受損細胞、分泌神經營養因子修復中樞神經系統。
在這篇綜述中,我們探討了源自多能干細胞的神經干細胞移植治療神經退行性疾病的基本原理和挑戰。
其次,我們還重點介紹了為這些試驗獲得監管部門批準鋪平道路的關鍵臨床前研究。
此外,我們還概述了迄今為止在治療脊髓損傷 (SCI)、帕金森病 (PD) 和肌萎縮側索硬化癥 (ALS) 等神經退行性疾病方面進行的臨床試驗的進展和狀態,這些試驗將為開發針對其他神經系統疾病(包括阿爾茨海默病和癲癇)的新型細胞療法鋪平道路。
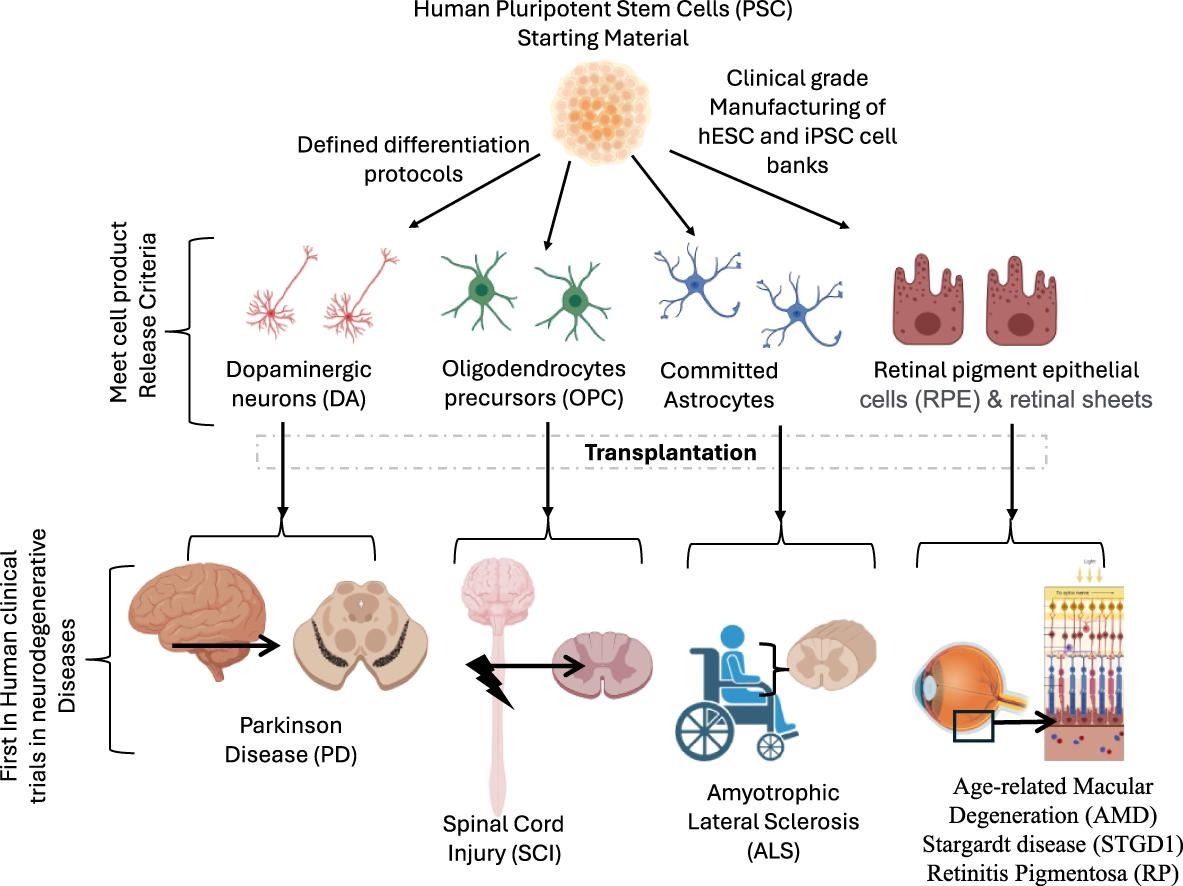
什么多能干細胞
多能干細胞(Pluripotent Stem Cells)是一類具有高度分化潛能的干細胞,能夠分化成幾乎所有類型的體細胞(如神經細胞、心肌細胞、肝細胞等),但無法像全能干細胞(如受精卵)那樣獨立發育成完整的生命體。
多能干細胞是具有兩個主要關鍵特征的幼稚細胞群;
- 分化潛力:多能細胞可以分化為三個胚層(外胚層、內胚層和中胚層),可產生200多種人體細胞類型;
- 自我更新能力:多能干細胞在適當條件下可以無限復制,同時保持其多能性。這些特性使PSC適合用作治療應用所需的大規模細胞制造的起始材料。
PSC有兩個主要來源:胚胎干細胞 (ESC) 和誘導多能干細胞 (iPSC) 。
hPSC作為臨床起始材料的標準化要求
隨著領域發展,人類多能干細胞(hPSC)作為細胞分化起始材料的監管標準化建議正在制定。標準化要求包括全面的質量檢測,以支持向FDA或EMA提交的臨床申請(如IND/CTA)或上市申請(如BLA/MAA)。hPSC批次的放行標準需涵蓋:
- 多能性標志物高表達(如SSEA-3/4、TRA-1-60/81及轉錄因子OCT4/SOX2/NANOG);
- 基因組穩定性驗證(核型分析、NGS/CGH檢測SNP/CNV等亞核型變異);
- 分化潛能評估(體外/體內三胚層分化能力,如畸胎瘤實驗);
- 其他檢測(細胞形態、無菌性、表觀遺傳特征及免疫原性)。
臨床級hPSC是治療神經退行性疾病的神經細胞衍生基礎。
中樞神經系統與神經退行性疾病
中樞神經系統(CNS)由大腦(含視網膜)和脊髓組成,是控制人體功能的核心網絡,CNS的關鍵細胞群包括神經元、星形膠質細胞、少突膠質細胞和小膠質細胞。這些細胞群中的任何一個或多個出現任何功能障礙或損傷都可能導致神經退行性疾病。
神經退行性疾病是一組異質性疾病,其特征是神經元的結構、功能或活力逐漸喪失。這些疾病常常導致嚴重的臨床功能障礙,包括認知能力下降、運動功能障礙和感覺缺陷。神經退行性疾病的發病機制復雜,涉及細胞自主(神經元內部的內在缺陷)和非細胞自主(鄰近細胞受外界因素影響)機制。

神經元丟失通常會導致嚴重的臨床癥狀,包括運動功能障礙,如肌萎縮側索硬化癥 (ALS) 、帕金森病 (PD) 和脊髓損傷 (SCI) 等疾病所見,以及認知能力下降和行為改變。
目前療法(如AD的膽堿酯酶抑制劑、PD的L-DOPA)僅緩解癥狀,亟需能延緩或逆轉疾病進展的修飾療法(DMTs)。
再生醫學的細胞來源與監管框架:多能干細胞療法的多學科協同發展
旨在替代、修復或再生受損細胞和組織以恢復正常功能的再生醫學,可能成為治療神經退行性疾病有效的方式。可移植的人CNS細胞(包括神經元和膠質細胞)來源包括人多能干細胞(hPSC)、人胎兒腦組織、體細胞直接重編程及間充質干細胞向神經譜系的部分轉化。
PSC的獨特性質使其優于其他細胞來源,PSC更易于獲取且能夠無限自我更新,從而可以大規模生產中樞神經系統細胞。這對于滿足每個患者需要數百萬至數十億個細胞的臨床應用需求尤為重要。此外,PSC具有分化成任何神經元亞群(例如多巴胺能神經元、運動神經元等)和神經膠質細胞的潛力。這種多功能性使得能夠針對特定的神經退行性疾病衍生出“量身定制的”細胞類型。這些潛在的細胞療法從臨床試驗到應用非常復雜,需監管機構、臨床醫生、科研界和制藥行業的多學科協作。
隨著該領域的發展,FDA和EMA等監管機構制定了嚴格的監管指南。這為開發用于治療神經退行性疾病和其他適應癥的多能干細胞 (PSC) 衍生細胞療法提供了監管指南。該指南涵蓋了產品開發的幾個關鍵方面,以確保安全性、有效性和質量。
其中涵蓋三大方面:
- 臨床前研究(GLP條件下的毒性、致瘤性、免疫原性評估);
- CMC流程(GMP標準下的原料、工藝及質量控制,如無菌性、細胞純度/活性、核型分析等);
- 臨床試驗設計(終點指標、患者篩選、統計分析等)。
迄今為止,只有有限數量的細胞療法出現并進入監管部門批準的首次人體臨床試驗。在這篇評論中,我們將重點介紹目前正在進行臨床研究的針對神經退行性疾病的關鍵細胞療法,并討論成功開發和臨床轉化所需的基本臨床前和制造考慮因素。
多能干細胞治療脊髓損傷的研究進展
脊髓損傷 (SCI) 是一種由脊髓損傷引起的嚴重疾病,會導致損傷平面以下的運動、感覺和自主神經功能喪失。人們探索了各種干預措施,包括使用糖皮質激素、電壓門控通道調節和四環素類抗生素進行治療。目前,尚無FDA批準的治療方法可以有效逆轉SCI造成的神經功能缺損。
細胞療法是一種有前景的策略:注射能夠與受損脊髓實質相互作用、產生神經營養因子、刺激血管形成并誘導脫落軸突髓鞘再生的神經細胞是一種有前途的SCI治療方法。
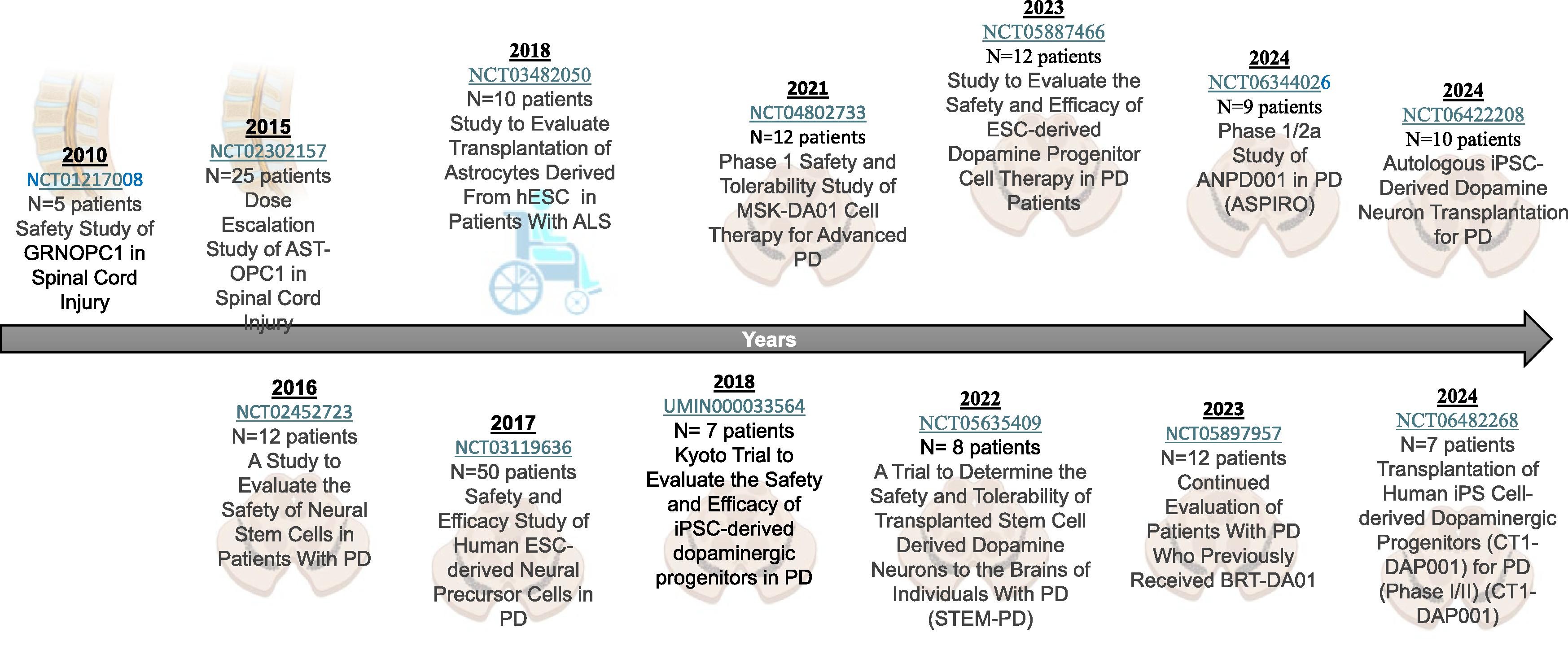
第一個利用人類胚胎來源的靶細胞進行的開創性臨床試驗是由Geron公司于2010年進行的,該試驗基于加州大學Hans Keirstead實驗室的研究成果(NCT01217008)。該技術后來被Lineage細胞治療公司收購,該公司繼續開發基于少突膠質細胞前體細胞 (OPC) 的療法。
在這些臨床前結果的支持下,FDA批準了使用hPSC衍生細胞的首個IND,用于首次人體1期臨床試驗。在該臨床試驗中,評估了在脊髓損傷 (SCI) 患者中移植源自hESC的人類少突膠質細胞祖細胞 (LCTOPC1) 的安全性。該試驗是一項開放標簽、非隨機、非盲、非安慰劑對照研究,旨在確認向腦實質內注射200萬個LCTOPC1細胞的安全性并監測神經功能的變化。
與較短的隨訪時間一致,10年隨訪的結果表明沒有與LCTOPC1細胞療法相關的嚴重不良事件 (SAE)。沒有證據表明腫塊大小或神經系統退化有差異,并且脊髓病變面積沒有擴大。同樣,T2MRI信號變化也表明了損傷部位病變形成的預期變化。作為NCT05919563(一項延伸臨床試驗)的一部分,正在進行長達15年的長期隨訪。
根據安全性臨床結果,啟動了一項有25名患者參與的開放標簽、劑量遞增(1-2千萬個細胞)多中心臨床試驗 (NCT02302157)。一年的隨訪顯示,所有參與者都面臨至少一次不良事件 (AE),報告了29起嚴重AE,其中少數事件與移植手術和免疫抑制有關。
所有參與者的MRI掃描結果均未顯示腫塊、炎癥引起的病變或腦室系統腫塊的變化。一年后,96%接受治療的患者至少一側身體恢復了至少一個水平的神經功能,32%的患者至少一側身體恢復了至少兩個水平的神經功能。近日日本iPS細胞治療脊髓損傷取得重大突破:通過誘導多能干細胞轉換為神經干細胞,日本研究小組稱干細胞治療有助于改善脊髓損傷
這些結果支持LCTOPC1對頸椎SCI后參與者的安全性。作為延伸臨床試驗 (NCT05975424) 的一部分,正在進行長達十年的長期隨訪。圖1總結了針對SCI進行的臨床試驗。
多能干細胞治療帕金森病(PD)的研究進展
帕金森病(PD)是最常見的神經退行性疾病之一,其特征是產生并釋放神經遞質多巴胺的特定神經細胞死亡。這些多巴胺能神經元從中腦黑質投射至紋狀體,負責協調平滑且平衡的肌肉運動。多巴胺能神經元死亡會導致運動癥狀,如靜止性震顫、運動遲緩、肌肉僵直和姿勢不穩;非運動癥狀包括認知改變、情緒障礙、睡眠紊亂及自主神經功能失調。
目前,藥物治療主要通過補充多巴胺或激動劑,或抑制多巴胺降解實現,但僅為對癥治療且效果不持久,無神經保護作用。胚胎細胞移植曾被嘗試但療效不穩定,且存在倫理與技術局限。多能干細胞衍生的多巴胺細胞療法有望突破這些瓶頸,成為更具潛力的治療手段。
首個使用iPSC/hESC來源多巴胺神經元治療帕金森病的臨床試驗
1、日本團隊(iPSC來源神經元)
2018年,日本京都大學Jun Takahashi團隊開展了全球首個使用人誘導多能干細胞(iPSC)分化的多巴胺神經元治療帕金森病(PD)的I/IIa期臨床試驗(UMIN000033564/JMA-IIA00384),獲IRB和日本PMDA批準。其核心技術包括:
- 分化優化:通過分選Corin陽性細胞(底板標志物)提高多巴胺神經元分化效率;
- 臨床前驗證:在6-OHDA損傷大鼠模型中,移植細胞整合入宿主腦部并改善運動功能;免疫缺陷小鼠中未觀察到畸胎瘤或致瘤性;在PD猴模型中,移植細胞存活至少2年。
臨床試驗的目的是“評估將人類iPS細胞衍生的DA祖細胞移植到PD患者殼核中的安全性和有效性”。這是一項對7名患者進行的單組、非隨機、開放的I/II期研究。 每次注射約有200,000個細胞以球體形式注射到大腦的殼核區域(共注射12次,約240萬個細胞)。初步報告顯示,該程序耐受性良好,沒有嚴重不良事件。旨在評估移植細胞存活率及其對運動癥狀影響的后續研究正在進行中。
2、中國團隊(hESC來源神經元)
2017年,中國科學院王等團隊啟動首個人胚胎干細胞(hESC)衍生的神經前體細胞治療PD的I/II期試驗(NCT03119636)。
相關閱讀:《協和新聞》安全有效 | 北京協和醫院“另辟蹊徑”移植神經干細胞治療帕金森病
臨床前研究顯示:MPTP誘導的PD猴模型中,移植后行為改善持續≥2年,且無腫瘤形成;
此外,臨床試驗計劃納入50例患者,通過立體定向紋狀體內單次注射給藥,但迄今未公開后續結果。
Cyto Therapeutics的帕金森病I期臨床試驗(hpSC來源神經干細胞)
2021年6月30日,一家總部位于加利福尼亞州的臨床階段生物技術公司,致力于開發基于干細胞的療法和生物醫學產品,宣布成功完成其劑量遞增1期臨床試驗(ClinicalTrials.gov標識符:NCT02452723),試驗對象為12名患者。評估其主要候選藥物ISC-hpNSC?用于治療帕金森病 (PD) 的安全性、耐受性和初步療效。

臨床試驗設計:開放標簽、劑量遞增研究(30/50/70百萬細胞/劑量,每組4人),隨訪5年(總數據收集6年);細胞通過MRI引導立體定向手術植入尾狀核、殼核和黑質。
中期結果(公司報告):
- 安全性:移植后1年無腫瘤、感染或嚴重不良事件(SAEs);
- 初步療效:6個月時,第二劑量組(50M)在Hauser運動日記、PD生活質量評分和臨床總體印象中優于低劑量組,呈現劑量依賴性改善;
此外,公司新聞稿指出,所有三個劑量組均未發生與ISC-hpNSC?細胞移植相關的嚴重不良反應,顯示至少12個月隨訪后的高安全性。
BlueRock Therapeutics的帕金森病I期臨床試驗(hESC來源多巴胺神經元療法)
2021年,拜爾啟動了針對12名晚期帕金森病(PD)患者的I期臨床試驗,評估其MSK-DA01(BRT-DA01/Bemdaneprocel)細胞療法的安全性與初步療效。該療法采用人胚胎干細胞(hESC,WA09系)分化的中腦多巴胺神經元,經大規模生產后冷凍保存用于臨床。
該項I期臨床試驗 (NCT04802733) 旨在評估MSK-DA01細胞療法治療晚期帕金森病的安全性和耐受性。
在這項研究中,受試者在全身麻醉下接受DA神經元移植到殼核。為患者提供為期一年的免疫抑制治療。在兩年內評估了安全性、細胞存活率(通過MRI和PET掃描)、耐受性和對PD進展的臨床效果。
研究結果發表在該公司的新聞稿中,顯示DA神經元移植對所有12名患者都是安全且耐受性良好的。此外,研究顯示治療后至少一年有細胞存活的證據(經PET掃描證實)。高劑量組患者的運動癥狀改善程度更大。
截止日前,在拜爾官網獲悉的信息得知,該公司2025年1月13日宣布——計劃啟動其帕金森病研究細胞療法bemdaneprocel的III期臨床試驗。這項名為exPDite-2的注冊試驗預計將于2025年上半年開始,將成為神經退行性疾病同種異體細胞療法開發的重要里程碑。

Stem-PD臨床試驗:hESC來源多巴胺細胞治療帕金森病的安全性與劑量探索
研究背景與設計:由瑞典Skane大學醫院主導的STEM-PD試驗(NCT05635409,EudraCT 2021–001366-38)是一項多中心、單臂、劑量遞增的I期研究,旨在評估人胚胎干細胞(RC17 hESC系)分化的多巴胺細胞(STEM-PD產品)經殼核內移植治療帕金森病的安全性與耐受性。
該試驗于2022年啟動,共納入8名患者,分兩個劑量組:
- 低劑量組:每側殼核移植354萬細胞(預估最小治療劑量);
- 高劑量組:劑量加倍(708萬細胞/側)。
臨床終點與評估指標
- 主要終點(移植后12個月):嚴重不良事件(SAEs)發生率;顱腦MRI排除占位性病變。
- 次要終點(移植后36個月):運動功能:MDS-UPDRS III、移植誘導的運動障礙(GIDs);認知與生活質量:MoCA、HVLT-R、PDQ-39等量表;非運動癥狀:PD NMSS(30分標準化量表)。
2024年,申辦方公布,第一次試驗獲得了積極的初步安全結果,從而可以評估下一次臨床劑量。

2023-2024年新增多能干細胞治療帕金森病的臨床試驗概覽
1.Aspen Neuroscience的ANPD001試驗(NCT06344026)
ANPD001(自體iPSC衍生的DA神經元)治療帕金森病的1/2a期研究 (NCT06344026)由Aspen Neuroscience贊助。
該試驗(NCT06344026)是一項開放標簽、劑量遞增的試驗,將ANPD001多巴胺能前體細胞雙側注射到殼核。移植后5年內(通過腦部MRI和PET成像掃描)將評估對帕金森病癥狀、安全性和耐受性以及細胞存活率的影響。
將評估長達一年至五年的主要結果安全性,即治療出現的不良事件的發生率和嚴重程度(安全性和耐受性)。隨后每年通過電話評估安全性和耐受性,持續10年(總隨訪期為15年)。
2.自體iPSC多巴胺神經元移植試驗(NCT06422208)
該項1期臨床試驗 (NCT06422208) 針對6名接受自體iPSC衍生多巴胺神經元移植治療帕金森病的患者,該試驗基于Penelope J. Hallett博士的工作。

在該試驗中,將評估將冷凍保存的中腦 多巴胺神經元移植到PD患者的殼核后進行自體移植的安全性。將在移植后12個月和18個月測量嚴重不良事件的發生率。此外,將在移植后18個月分析次要療效運動表現,研究結果預計在2027年公布。
3.加州大學圣地亞哥分校的CT1-DAP001試驗(NCT06482268)
該試驗是一項單中心、開放標簽、非對照試驗。本研究的主要目的是通過確定在雙側殼核中移植約4.2–5.4×106個多巴胺能祖細胞后不良事件(尤其是移植物擴張)的發生率和嚴重程度,評估CT1-DAP001(人類iPS細胞衍生的多巴胺能祖細胞)對七名PD患者的安全性。

其他目標是通過評估帕金森病癥狀和臨床嚴重程度或進展來評估CT1-DAP001的療效。
4.S.Biomedics的A9-DPC試驗(NCT05887466)
該項臨床試驗(NCT05887466)是一項開放標簽、單中心、單劑量、劑量遞增、I/IIa期試驗,旨在評估胚胎干細胞衍生的A9多巴胺祖細胞(A9-DPC)治療PD患者的安全性和探索性療效,該試驗由S.Biomedics贊助。這項研究基于Dong-Wook實驗室進行的臨床前工作。

最多12名患者將接受兩種劑量的治療,3.15×106個細胞(低劑量)和6名受試者接受6.30X10^6個細胞(高劑量)。將收集長達96周(約2年)的主要結果安全性指標和次要療效指標(如MDS-UPDRS總分、K-MMSE Hoehn&Yahr量表等),并與基線(治療前)進行比較分析。
多能干細胞治療肌萎縮側索硬化癥(ALS)的研究進展
肌萎縮側索硬化癥(ALS)是一種致命的神經退行性疾病,特征為上下運動神經元(MNs)的進行性喪失,導致肌肉癱瘓,患者通常在發病后3-5年內因呼吸衰竭死亡。現有藥物(利魯唑和依達拉奉)僅能輕微延緩疾病進展,亟需能靶向病理機制的新型療法。
近年研究表明,星形膠質細胞通過非細胞自主機制(如谷氨酸毒性、氧化應激調控失敗)參與ALS發病機制中發揮作用。這為細胞治療提供了新靶點。
AstroRx?星形膠質細胞療法:從實驗室到臨床
臨床前研究突破
以色列公司Kadimastem開發的AstroRx?是一種人胚胎干細胞(hESC)分化的功能性星形膠質細胞,其作用機制包括:
- 谷氨酸攝取緩解興奮性毒性
- 神經營養因子分泌(GDNF、BDNF等)
- 免疫調節與運動神經元保護
在hSOD1G93A轉基因ALS小鼠模型中,鞘內注射AstroRx?顯著延遲疾病發作并改善運動功能,且細胞在CNS內長期存活(9個月)而無器官遷移。
人胚胎干細胞治療漸凍癥的I/IIa期臨床試驗(NCT03482050)
在Izrael等人研究結果的支持下,進行了一項I/IIa期 (NCT03482050)、開放標簽、劑量遞增臨床研究,以評估AstroRx?鞘內移植對ALS患者的安全性、耐受性和治療效果。

結果表明,鞘內注射1億或2.5億個AstroRx細胞的AstroRx?耐受性良好且安全,12個月的隨訪后未出現與治療相關的不良事件 (AE)。此外,研究表明,在兩個隊列中,在服用AstroRx?3個月后,ALSFRS-R下降速度顯著減緩,并在6個月和12個月的評估中恢復到治療前的速度。鞘內注射后效果至少持續三個月。
AstroRx對ALS有什么作用?
AstroRx是一種基于細胞的研究性療法,目前正在進行肌萎縮側索硬化癥(ALS) 的早期臨床試驗。該療法旨在通過防止神經細胞進一步受損來減緩ALS的進展。
該療法由Kadimastem開發,于2018年獲得美國食品藥品管理局的孤兒藥資格,這提供了一系列激勵措施來加速該療法用于治療ALS的開發。
治療快照
| 治療名稱: | AstroRx |
| 注射方式: | 鞘內(椎管內)注射 |
| 臨床測試: | 已在以色列完成1/2a期試驗;正在計劃在美國進行2a期研究 |
基于這些結果,該公司公布FDA已批準下一步II期臨床試驗的IND。計劃中的臨床試驗是一項前瞻性、隨機、雙盲、安慰劑對照的2a期研究,為期6個月,隨后進行6個月的開放標簽擴展,以評估對30名ALS患者重復鞘內注射冷凍保存的AstroRx?的安全性、有效性和耐受性。
技術創新驅動多能干細胞神經細胞療法的突破
當前技術進步通過三大方向推動多能干細胞(PSC)衍生神經細胞在再生醫學中的應用:
1)單細胞RNA測序(scRNA-seq)、膜片鉗測序等高分辨率技術實現神經元亞型精準分選,如小鼠內耳發育研究中鑒定的體感神經元亞型為聽力損失治療提供新策略;
2)3D類器官技術(如視網膜類器官、皮質類器官)模擬天然中樞神經系統結構,顯著提升移植物與宿主神經網絡的功能整合能力,實驗顯示其可形成血管化、電活動連接并參與宿主行為調控;
3)人工智能(AI)通過機器學習算法優化細胞分化方案、監控生產質量,結合高通量組學數據分析,加速疾病特異性表型解析和藥物篩選。這些技術協同突破傳統療法局限,為帕金森病、脊髓損傷等神經退行性疾病提供更精準的細胞替代策略,同時也對技術標準化與倫理監管提出新挑戰。
多能干細胞的臨床轉化的里程碑與未來使命
多能干細胞衍生細胞療法在神經退行性疾病領域的探索已從實驗室走向臨床,為帕金森病、脊髓損傷等難治性疾病提供了前所未有的治療新方式。盡管當前臨床數據仍有限,但早期試驗已展現出細胞替代的可行性與潛力 —— 例如,iPSC來源的多巴胺能神經元移植使帕金森病患者運動功能改善持續12個月以上。這些成果不僅驗證了再生醫學的科學邏輯,更標志著人類從“對癥治療”向“病因修復”的重大跨越。
作為再生醫學新媒體工作者,我們既是見證者也是推動者。在遵循循證醫學原則的同時,需以開放心態參與臨床試驗設計,關注患者報告結局(PROs)的真實反饋,將技術進步切實轉化為患者福祉。
多能干細胞療法的最終目標,不僅是延長生命長度,更在于重塑生命質量——讓帕金森患者擺脫震顫束縛,使脊髓損傷者重獲行走尊嚴。這一愿景的實現,需要科學界、產業界、監管機構與社會各界的共同努力,而臨床視角的持續審視,將始終是指引方向的燈塔。
主要參考資料:
[1]https://www.sciencedirect.com/science/article/pii/S0169409X25000109#b0310
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信