再生醫(yī)學是一種新的、有前途的治療模式,適用于治療疾病的選擇有限或沒有其他選擇的患者。由于它們通過抑制炎癥或細胞凋亡、細胞募集、刺激血管生成和分化而具有多效性治療潛力,因此干細胞為幾種具有挑戰(zhàn)性的人類疾病提供了一種新穎而有效的方法。
近年來,臨床前研究中令人鼓舞的發(fā)現(xiàn)為許多使用干細胞治療各種疾病的臨床試驗鋪平了道路。這些新的治療產品從實驗室到市場的轉化是在主管監(jiān)管機構提供的高度明確的法規(guī)和指令下進行的。2022年美國芝加哥大學芝婦產科在《Int J Mol Sci》國際分子科學雜志發(fā)表一篇為《干細胞療法:從理念到臨床實踐》,這篇綜述旨在讓讀者熟悉干細胞產品從想法到臨床實踐的轉化過程。

在這篇綜述中,我們概述了干細胞療法從理念到臨床服務的轉化。了解將想法轉化為醫(yī)療服務的循序漸進知識是引入新治療方法的第一步。我們將這一途徑分為四個層次,包括干細胞基本特性、臨床前研究、臨床試驗研究和臨床實踐。我們不僅關注了解每個級別的要求,還討論在從一個級別過渡到下一個級別的過程中如何評估一個想法,最終服務于大眾。
干細胞基本特性
干細胞是一組未成熟的細胞,由于其獨特的增殖、分化和自我更新能力,它們具有構建和恢復體內每個組織/器官的潛力。干細胞提供治療效果,通過再生受損細胞來幫助器官恢復,從而改善身體發(fā)育。依靠干細胞的天然能力,研究人員已將其生物學機制用于基于干細胞的治療。
干細胞促進組織再生的作用機制多種多樣,包括 (1) 抑制炎癥級聯(lián)反應,(2) 減少細胞凋亡,(3) 細胞募集,(4) 刺激血管生成,和 (5) 分化。
在選擇適當?shù)母杉毎麢C制和使用干細胞再生組織/器官時,疾病的原因是一個至關重要的考慮因素。當這些細胞用于臨床實踐時,必須進行許多檢查以確定參與治療的主要機制,并且干細胞治療機制和疾病機制的融合有望增加通過干細胞應用開發(fā)治療的機會。
從1971年到2021年,發(fā)表了40,183篇關于干細胞療法的研究論文。所有這些研究都是圍繞著細胞治療功效的“干細胞治療”目標進行的。隨著過去幾年干細胞基礎研究的飛速發(fā)展,“翻譯研究”這一相對較新的研究領域最近得到了長足的發(fā)展,利用基礎研究成果開發(fā)新的治療方法。盡管每年都會發(fā)表許多關于干細胞療法的文章,而且數(shù)量每年都在增加,但臨床試驗研究的數(shù)量并沒有迅速增加。
此外,在這些研究中,只有一小部分能夠獲得監(jiān)管部門的全面批準,作為治療方法進行驗證。盡管造成這種差異的一個原因是由于在進行臨床試驗研究之前需要進行各種先決條件的臨床前研究,但主要原因是由于指導方針的明確定義阻止了許多臨床前研究轉化為臨床試驗。
從構思到臨床前研究
如果研究人員對使用干細胞進行再生醫(yī)學的想法激發(fā)了他們在研究中的應用,則必須首先對其進行評估。在評估步驟中,重要的是選擇目標疾病并確保了解引起疾病的機制。疾病相關機制是指引起特定疾病的細胞和分子過程,而干細胞的療法被認為是一種治療方法,旨在補償由此類機制引起的破壞,以最終解決恢復有缺陷的組織。多種機制導致疾病;然而,干細胞具有巨大的分化、自我更新、血管生成、抗炎、抗凋亡和免疫調節(jié)潛力,以及它們誘導生長因子分泌和細胞信號傳導的能力,可以影響這些機制。
受試者評估后,應進行臨床前研究以確定該想法是否具有治療該疾病的潛力,并應在目標疾病的動物模型中評估最終產品的安全性。臨床前研究由體外和體內研究組成。基于各種假設對生物分子和細胞進行體外實驗,在體外評估期間,在這種受控環(huán)境中測定了一種新的治療方法。相比之下,在體內研究中,由于不可能控制所有生物實體,新產品可能會受到各種因素的影響,從而呈現(xiàn)出不同的效果。
臨床前研究的一般目的是提供支持臨床研究進行的科學證據(jù),決定推進臨床研究需要以下條件:(i)可行性和基本原理的確立(例如,驗證, (ii) 建立藥理有效能力(例如,安全的初始劑量驗證),(iii) 優(yōu)化給藥途徑和用法(例如,安全的給藥方法,重復給藥和間隔驗證)。
從臨床前研究到臨床試驗
原則上,任何關于干細胞治療的想法都應在考慮進行臨床試驗之前通過綜合研究(即體外和體內)進行評估,并且這些研究的結果應得到主管部門的證明。在體外研究中很容易通過使用基因突變、藥物測試和藥物來創(chuàng)建操縱性生物環(huán)境,并且通過活細胞應用操縱變量很容易觀察到變化。然而,考慮到許多相關變量,例如通過循環(huán)血液和器官相互作用的分子轉運,很難說這樣的研究是否可以完全模擬體內環(huán)境。在應用于患者之前,在體外實驗之后進行體內實驗以克服這些弱點。
此外,體內研究需要根據(jù)實驗動物倫理來維護倫理責任和義務。換句話說,必須避免不必要和不道德的實驗。綜上所述,我們可以看到,在臨床前研究中,無論是體外還是體內的方法,都應該基于各種想法理念在臨床試驗申請之前進行。
在不同的體外和體內研究中必須考慮幾個因素,包括細胞類型測定、細胞劑量規(guī)格、給藥途徑以及安全性和效率。
干細胞來源測定
隨著通過應用干細胞療法對再生治療的期望提高,各種類型和干細胞來源的應用數(shù)量增加,并且干細胞療法從自體到同種異體再到iPSCs多樣化。這些干細胞治療的風險可能會有所不同,具體取決于細胞制造過程以及其他因素以及臨床經(jīng)驗,因此必須在相同的基礎上評估所有類型的干細胞治療。因此,為了確定干細胞在各種疾病中的最大治療效果,應確定每種干細胞的優(yōu)缺點。這將使我們能夠通過將適當?shù)母杉毎麘糜谶m當?shù)募膊順嫿ㄡ槍膊〉母杉毎O旅妫覀兒喴懻摳鞣N干細胞的特性。
間充質干細胞 (MSC):間充質干細胞是分化成間充質系統(tǒng)的譜系定型細胞,主要是脂肪細胞、軟骨細胞和骨細胞。間充質干細胞的最大特點是其免疫抑制功能,通過免疫抑制細胞因子分泌和抑制程序性細胞死亡信號傳導來阻止活化T細胞的增殖。由于這一作用,它們已成為免疫相關炎癥和疾病的潛在治療方法。
造血干細胞 (HSC):HSCs可以分化成來自骨髓和胸腺中存在的所有造血系統(tǒng)的細胞,即骨髓細胞和淋巴細胞。可以從成人骨髓、胎盤和臍帶血中獲得高水平的HSC。它們會引起免疫問題,例如移植排斥。然而,迄今為止,它們已被證明是治療各種疾病的有效方法,包括白血病、惡性淋巴瘤和再生性貧血,以及先天性代謝、先天性免疫缺陷、無反應性自身免疫性疾病和實體癌。此外,HSC是美國食品和藥物管理局 (FDA) 批準用于干細胞治療的唯一干細胞類型。
胚胎干細胞 (ESC):胚胎干細胞已經(jīng)建立了可以通過體外培養(yǎng)維持的細胞系。它們是多能細胞,幾乎可以分化成體內存在的任何類型的細胞,并且可以通過向培養(yǎng)基中添加外部因素或通過基因改造進行體外分化。然而,當移植到可接受的宿主中時,它們可能會形成畸胎瘤,這些畸胎瘤由源自內胚層、中胚層和外胚層的各種形式的細胞組成。
誘導多能干細胞 (iPSC):iPSC是人工制造的干細胞。這些細胞是通過重編程成體細胞(如成纖維細胞)制成的。它們具有ESC的許多特征,包括自我更新、多能分化和畸形物種的表現(xiàn)。不幸的是,這些細胞幾乎沒有關于細胞特異性調控途徑、基因表達和表觀遺傳調控變化的科學證據(jù)。這些特征構成組織嵌合或細胞功能障礙的風險。
細胞劑量規(guī)格
用于治療的干細胞或干細胞衍生產品的有效給藥范圍(即劑量)應通過體內和體外研究確定。必須確定安全有效的處理能力,并且在可能的情況下,還必須確定最低有效處理能力。
只考慮干細胞的有效性,高細胞劑量會產生更好的效果嗎?
我們在下面回答這個問題。已顯示增加劑量的CD34+細胞(每只小鼠 0.5×105個)具有積極作用,可在早期刺激多系造血并增加移植后階段的重建程度。
此外,與較低的細胞劑量相比,改善的T細胞重建與較高的干細胞細胞劑量相關。然而,一些與急性髓細胞性白血病(AML)相關的研究報道,高劑量的HSC與功能恢復和血液學和免疫學快速恢復相關,但這些結果并非無條件的。在本研究中,較高劑量的HSC(≥7×106/kg)比低劑量的HSC(<1×106/kg)導致更差的結果和更高的復發(fā)率。
結果表明,使用的細胞總數(shù)不同,但與細胞數(shù)量越多治療效果越高的假設不一致。因此在進行臨床試驗之前可能需要進行充分而詳細的早期研究。
移植途徑
干細胞已根據(jù)其類型和特征在各種疾病條件下進行了廣泛研究。此時,不應忽視給藥途徑以支持移植的干細胞數(shù)量。一些報告表明,相對于移植細胞的數(shù)量,植入能力通常具有較低的到達靶器官的速率,并且沒有暫時較長的持續(xù)時間。
干細胞給藥的方法可大致分為局部和全身傳播。局部傳播涉及通過各種操作和直接器官內注射的特定注射,例如腹膜內 (IP)、肌肉內和心內注射。全身性傳播使用血管途徑,例如靜脈內 (IV) 和動脈內 (IA) 方法。根據(jù)文獻中的出版物,IV是最常用的方法,其次是脾內和IP。
在肝臟疾病模型中,IV不僅適用于靶向肝臟,而且比其他給藥途徑顯示出更好的肝臟再生效果。心內注射在心臟病中表現(xiàn)出更好的細胞保留,而皮內注射在皮膚病中表現(xiàn)出更好的治療。因此,我們可以確定,在這些不同疾病的背景下,給藥途徑應根據(jù)靶器官而有所不同。
從臨床試驗到臨床實踐
在將治療應用于人類(即患者)之前,臨床前研究必須包括檢查治療效果是積極的還是消極的,如果有任何負面影響,研究人員必須檢查每一步的安全可能性。由于對使用基于干細胞的產品進行治療的擔憂,決定臨床前研究是否足以轉化為臨床試驗提出了幾個必須由主管當局評估的問題。臨床試驗申請應提交給食品和藥物管理局 (FDA)、歐洲藥品管理局 (EMA) 或其他組織,基于國家。
FDA負責認證美國干細胞產品的臨床試驗研究。如果將一種新藥介紹給未經(jīng)FDA批準的臨床研究人員,則可能需要提交研究性新藥 (IND) 申請。IND申請包括來自動物藥理學和毒理學研究、臨床方案和研究人員信息的數(shù)據(jù)。缺乏臨床前支持(例如,體外和體內研究)可能導致所需的修改或不批準。如果FDA宣布一項IND需要修改(意味著該申請旨在獲得批準但尚未獲得批準),則臨床前研究的結果被認為不足以或不足以轉化為臨床試驗研究,以便進一步研究必須完成,之后應提交修改后的IND。
FDA已在聯(lián)邦法規(guī) (CFR) 中發(fā)布了提交IND的指南。這些法規(guī)在 21CFR第210、211部分(現(xiàn)行良好生產規(guī)范 (cGMP))、21CFR 第312部分(研究性新藥申請)、21CFR610(通用生物制品標準)和21CFR1271(人體細胞、組織,以及基于細胞和組織的產品)。這些指南的發(fā)布是為了開發(fā)具有最高安全標準和潛在有效轉化為臨床試驗研究的干細胞產品。
EMA是歐盟 (EU) 的一個機構,負責評估任何研究性醫(yī)療產品 (IMP),以確保最終產品對公眾安全有效。當計劃在歐洲引入一種新藥進行臨床試驗時,可能需要向EMA提交IMP的臨床試驗申請。IMP的臨床試驗申請包括化學、藥理學和生物學臨床前數(shù)據(jù)的總結(例如,來自體內和體外研究)。EMA提出了不同的法規(guī)來支持開發(fā)安全高效的公共產品,包括法規(guī) (EC) No. 1394/2007、指令 2004/23/EC、指令2006/17/EC、指令2006/86/EC , 指令 2001/83/EC、指令2001/20/EC和指令2003/94/EC。
幾乎所有已批準用于人體測試的臨床試驗研究都已在線注冊(https://www.clinicaltrials.gov/2021年12月12日訪問)。我們在該網(wǎng)站上的搜索顯示,截至2021年12月,使用“干細胞”注冊的介入研究記錄超過6500條。記錄的臨床試驗可以從不同方面進行分析。
推薦閱讀:重磅!中國發(fā)布全球首個干細胞國際標準ISO 24603
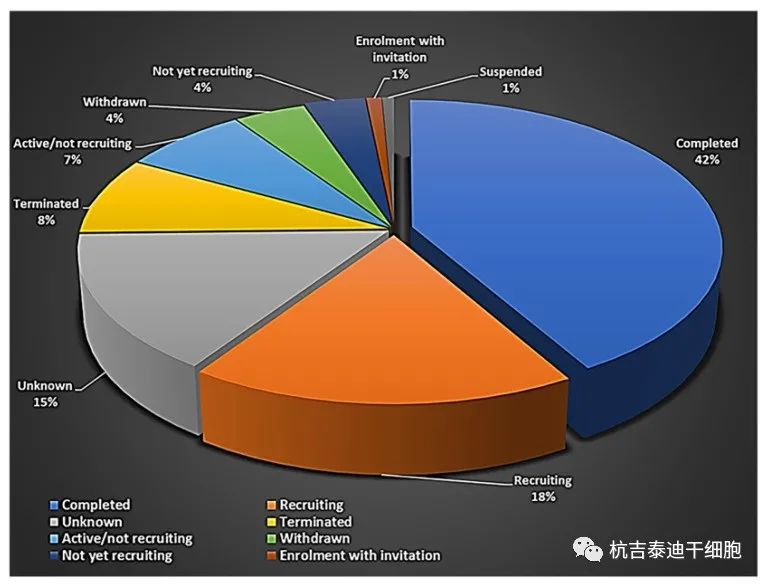
招募狀態(tài):這些研究的招募狀態(tài)表明,這些研究中有18%正在進行中(招募),42%已完成(圖1)。
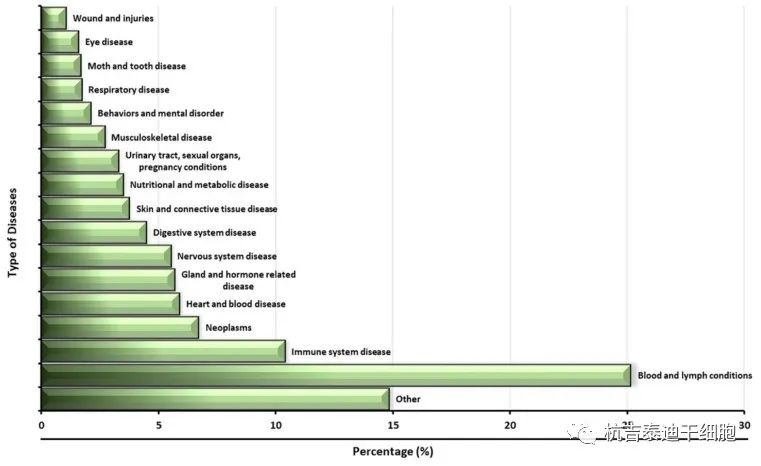
疾病類型:基于干細胞的療法是不同臨床試驗研究中治療各種疾病的新方法。血液和淋巴疾病是受益于這種新方法的最常見疾病(圖 2)。血液和淋巴疾病是指與血液和淋巴缺乏或異常有關的任何類型的疾病,如貧血、血液蛋白紊亂、骨髓疾病、白血病、血友病、地中海貧血、血栓形成傾向、淋巴疾病、淋巴增生性疾病、胸腺瘤等。此外,還進行了各種使用干細胞治療免疫系統(tǒng)疾病的臨床試驗研究;腫瘤、心臟和血液疾病;以及神經(jīng)系統(tǒng)疾病、糖尿病、卒中、帕金森和脊柱損傷等疾病(圖2)。
然而,這并不意味著所有這些研究都有很好的結果,也不意味著所有這些研究都引入了新的治療方法;其中一些臨床試驗研究只是為了提高治療效率,比較不同類型的治療方法,或分析干細胞進入體內后的各種參數(shù)。
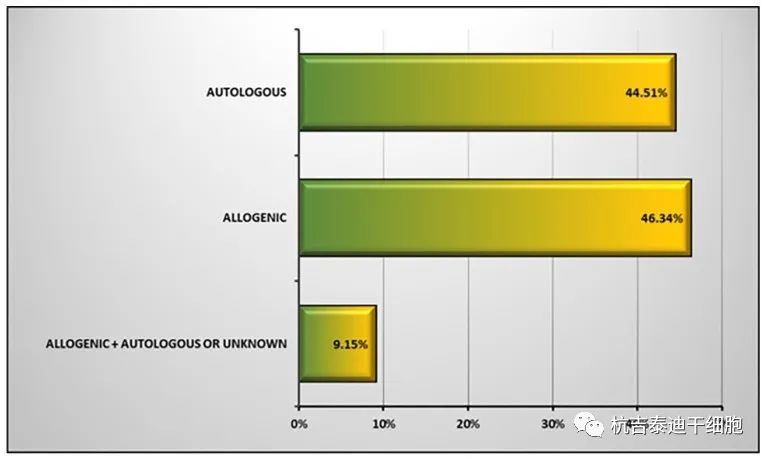
自體與同種異體:用于臨床試驗研究的基于干細胞的產品可分為兩類:自體和同種異體干細胞。在自體干細胞治療中,干細胞是從患者自己的身體中收集的。培養(yǎng)擴增的自體干細胞是移植前擴增的自體干細胞,可分為修飾和未修飾的擴增自體干細胞兩類。如果自體干細胞在采集后立即移植到供體,這是一種非擴增的自體干細胞治療。這些細胞的使用通常對獲得臨床試驗授權的限制較少。
同種異體干細胞的分類與自體干細胞的分類相似,只是同種異體干細胞是從健康供體處收集的。使用這些細胞需要更多的先決條件測試,以檢查捐贈者的健康狀況。同種異體干細胞在臨床試驗研究中的使用量超過自體干細胞(46.34%vs44.51%),如圖所示圖3.
階段:臨床試驗研究分不同階段進行。在每個階段,研究目的、參與者人數(shù)和隨訪時間都可能不同。除非已完成階段的結果已由主管當局審查,否則不應開始新階段的臨床試驗,以證明已完成階段的結果對開始新階段的授權有效臨床試驗階段。為此,在臨床試驗研究的每個階段結束時,主管部門都會評估新藥是否安全、有效、有效地治療目標疾病。圖4)。
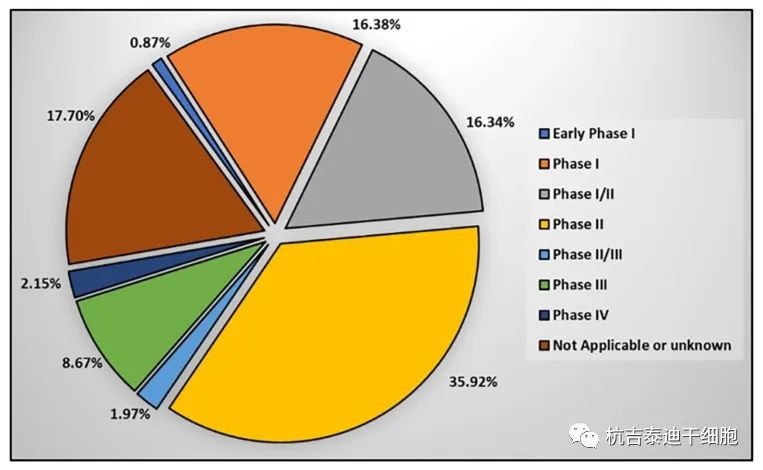
早期階段I:強調藥物對人體的影響以及藥物在體內的加工方式。
進行臨床試驗的第一階段是為了確保新療法是安全的,并確定新藥如何在人類身上發(fā)揮作用。FDA估計大約70%的研究通過了這一階段。
在第二階段,確定準確的劑量并收集有關效率和可能的副作用的初始數(shù)據(jù)。FDA估計大約33%的研究進入下一階段。
第三階段評估產品的安全性和有效性。這一階段的結果將提交給 FDA/EMA以獲得新產品的批準,從而允許生產和銷售該藥物。FDA估計有25%–30%的藥物在此階段通過。
第四階段在新產品獲批后進行,用于確定新產品的公共安全性。
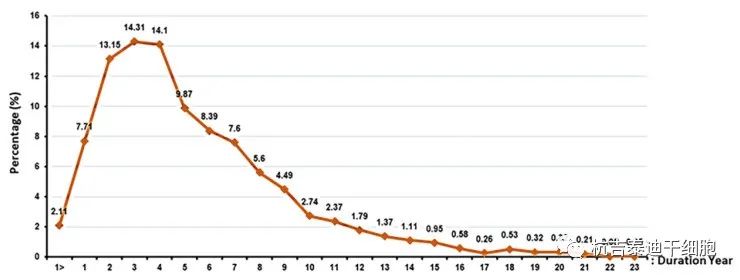
參與者數(shù)量和持續(xù)時間:新的干細胞產品在成功完成臨床試驗階段后有資格上市。由于新產品已在志愿者身上使用,并且該藥物的效果/副作用也已在不同階段進行了很長時間的跟蹤,因此現(xiàn)在可以決定是否將其引入市場供公眾使用。每個研究和每個階段的參與者人數(shù)和長期隨訪的持續(xù)時間都不同(圖5和圖6)。
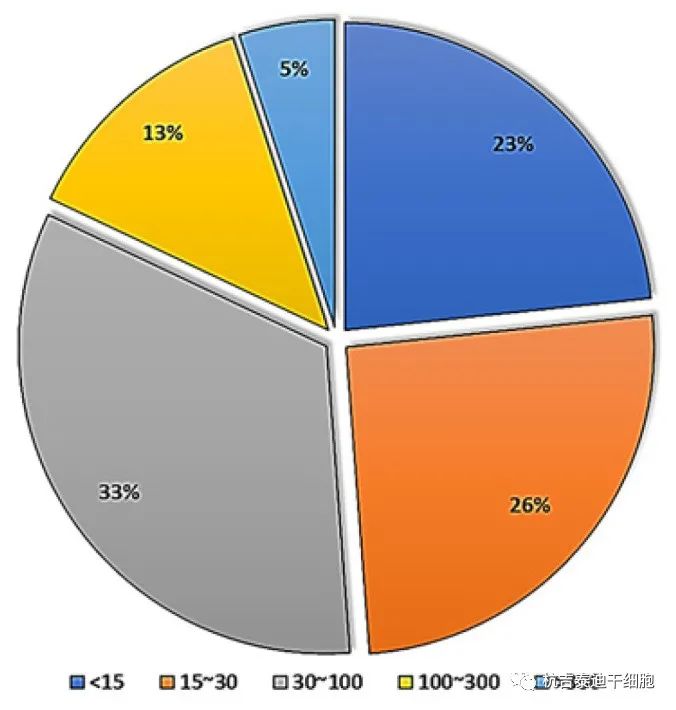
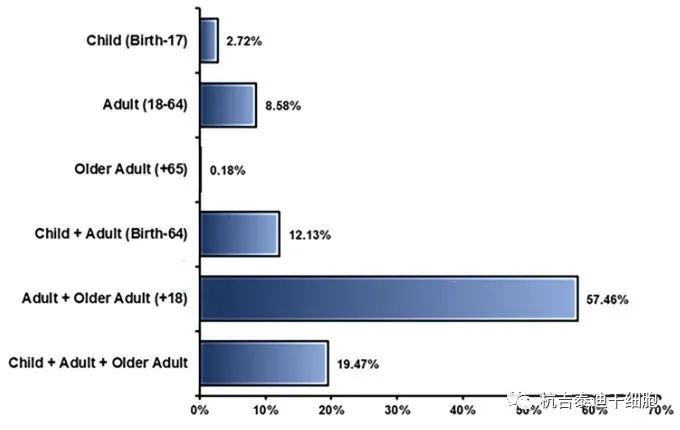
參與者年齡:大約有190,000人使用已注冊的干細胞參與了所有已完成的臨床試驗研究。每項臨床研究均在不同年齡組進行,根據(jù)藥物類型、疾病類型和申辦者決定,不同研究之間的差異,如圖7。
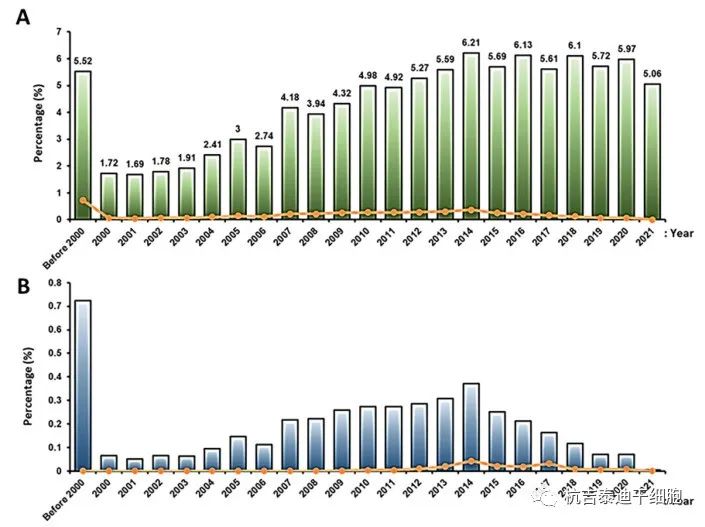
臨床試驗研究數(shù)量:臨床試驗研究數(shù)量從2000年到2014年逐漸增加,2014年以后雖然有波動但沒有明顯變化(圖8)。2014年這一增長的原因尚不清楚,但可能與EMA在2014-2015年推出的第一個含有干細胞的先進藥物治療產品 (Holoclar) 有關。
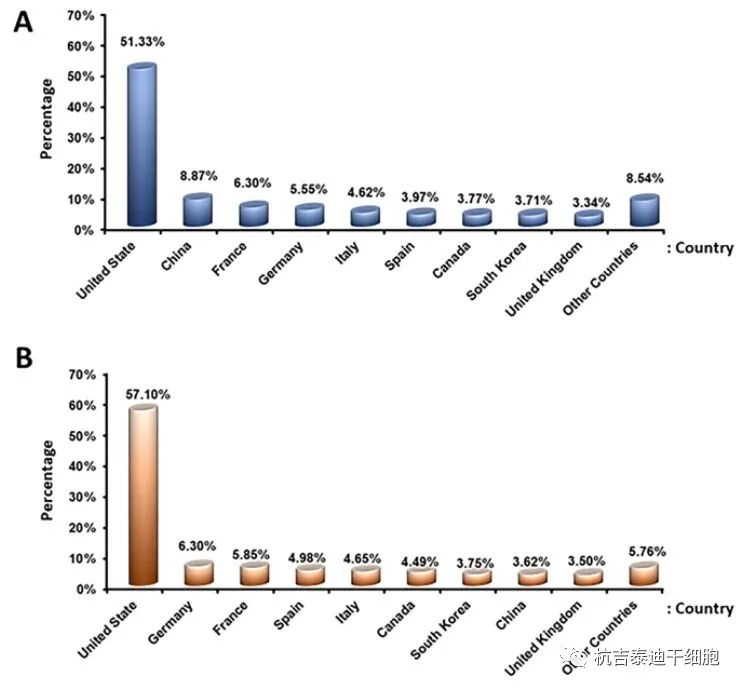
各個國家臨床試驗注冊數(shù)量:據(jù)經(jīng)濟網(wǎng)站報道,細胞治療市場近年來增長顯著,未來幾年有望進一步增長;因此,許多國家都開始了這方面的研究。我們來自clinicaltrial.gov 的數(shù)據(jù)顯示,美國使用干細胞進行的臨床試驗最多(圖9)。政府機構、行業(yè)、個人、大學和私人組織都對基于干細胞的治療進行了投資。
近年來,以干細胞為基礎的公司數(shù)量迅速增加,對提交的臨床試驗研究的簡要概述表明,這些研究主要旨在引入用于臨床應用的治療產品。因此,我們可以期待將基于干細胞的產品引入市場。
如上所述,從實驗室到臨床服務的轉化研究有許多層必須經(jīng)過,每個層都有自己的要求和衡量標準。因此,將基于干細胞的新產品推向市場的唯一途徑是主管當局確保該發(fā)現(xiàn)對其預期的人類用途安全有效,并且該產品已成功通過所有臨床試驗階段。
結論及未來展望
近年來,再生醫(yī)學已成為各種疾病的有希望的治療選擇。由于其治療潛力,包括抑制炎癥或細胞凋亡、細胞募集、刺激血管生成和分化,干細胞可被視為再生醫(yī)學的良好候選者。在過去的50年中,超過40,000篇研究論文專注于基于干細胞的療法。
在這項回顧性研究中,我們概述了干細胞療法從科學理念到臨床應用的轉化。由于干細胞具有巨大的治療潛力,導致疾病的多種機制可以被逆轉。然而,包括體外和體內實驗在內的臨床前研究對于評估基于干細胞的治療的潛力是必要的。
值得注意的是,近年來,旨在引入臨床應用的干細胞公司數(shù)量迅速增加。所以,在不久的將來,有可能在臨床市場上找到干細胞的產品。
再生醫(yī)學市場正在發(fā)展,由于臨床前研究的令人鼓舞的發(fā)現(xiàn)和可預測的經(jīng)濟效益,專注于細胞產品開發(fā)的公司之間的競爭已經(jīng)加劇。因此,政府機構、行業(yè)、個人、大學和私人組織近年來對再生醫(yī)學市場的發(fā)展投入了大量資金,讓我們對干細胞療法的未來充滿希望。
參考資料:Mousaei Ghasroldasht M, Seok J, Park HS, Liakath Ali FB, Al-Hendy A. Stem Cell Therapy: From Idea to Clinical Practice. Int J Mol Sci. 2022 Mar 5;23(5):2850. doi: 10.3390/ijms23052850. PMID: 35269990; PMCID: PMC8911494.
免責說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構成任何臨床診斷建議!杭吉干細胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信