干細胞是身體的原材料,所有其他具有特殊功能的細胞都是由干細胞產(chǎn)生的。但是什么是間充質(zhì)干細胞,間充質(zhì)干細胞又來源于哪里呢?接下來我將帶您慢慢了解
間充質(zhì)干細胞(Mesenchymal Stem Cells, MSCs)是一類具有自我更新能力和多向分化潛能的成體干細胞。它們不僅能夠自我復(fù)制,還可以在特定條件下分化為多種類型的細胞,如骨骼、軟骨、脂肪等組織細胞。此外,MSCs還具備獨特的免疫調(diào)節(jié)功能,能夠在炎癥環(huán)境中發(fā)揮抗炎或促炎的作用,這使得它們成為治療各種疾病的重要候選者。
間充質(zhì)干細胞(MSC)可來源于多種組織,包括脂肪組織(脂肪)、骨髓、臍帶組織、血液、肝臟、牙髓和皮膚。本文將重點關(guān)注源自脂肪組織 (ADSC)、骨髓 (BMSC) 和臍帶組織 (UC-MSC) 的間充質(zhì)干細胞。
什么是間充質(zhì)干細胞,間充質(zhì)干細胞來源于哪里?
01.間充質(zhì)干細胞的定義與特性
間充質(zhì)干細胞最早是在骨髓中被發(fā)現(xiàn),并因此得名。隨著研究的深入,科學(xué)家們逐漸認識到這類細胞并非局限于骨髓之中,實際上存在于人體多個部位。MSCs屬于中胚層起源的細胞,具有以下幾大特點:
- 自我更新:可以無限次地分裂而不失去其未分化的狀態(tài)。
- 多向分化:可以在適當(dāng)?shù)臈l件下分化為不同類型的細胞。
- 免疫調(diào)節(jié):根據(jù)所在微環(huán)境的不同,MSCs能夠調(diào)節(jié)免疫系統(tǒng)的活性,既能在過度活躍時抑制免疫反應(yīng),又能在免疫不足時增強免疫應(yīng)答。
- 低免疫原性:由于表達較低水平的主要組織相容性復(fù)合物II類分子(MHC II),使得異體移植時排斥反應(yīng)的風(fēng)險相對較小。
02.間充質(zhì)干細胞的來源
間充質(zhì)干細胞可以從多種組織中獲取,主要包括但不限于以下幾個方面:
- 骨髓:傳統(tǒng)上被認為是MSCs的主要來源之一。然而,從骨髓中提取MSCs的過程較為復(fù)雜且對捐獻者有一定的侵入性風(fēng)險。隨著年齡增長,骨髓內(nèi)的MSCs數(shù)量會減少,質(zhì)量也會有所下降。
- 脂肪組織:通過吸脂手術(shù)可大量獲得脂肪源性間充質(zhì)干細胞(ADSC)。相比骨髓MSCs,ADSC擁有更高的增殖率和更廣泛的臨床應(yīng)用前景,尤其是在整形美容領(lǐng)域。
- 臍帶:包括沃頓膠在內(nèi)的臍帶部分含有豐富的MSCs資源。采集過程非侵入性強,且這些細胞表現(xiàn)出較高的增殖潛力及較低的免疫原性,適合作為新生兒及其親屬未來的健康儲備。
- 其他來源:除了上述三種主要來源外,MSCs還可以從牙髓、皮膚、肝臟等多個組織中分離出來。例如,胎盤也是一個重要的MSCs來源,特別是對于那些尋求避免倫理爭議的應(yīng)用場景而言。
03.間充質(zhì)干細胞的臨床應(yīng)用
間充質(zhì)干細胞由于其自我更新、分化、抗炎和免疫調(diào)節(jié)等特性而被廣泛應(yīng)用于多種疾病的治療。體外(在實驗室環(huán)境中進行)和體內(nèi)(在活體中進行)研究支持了對MSC治療在臨床應(yīng)用中的機制、安全性和有效性的理解。[3]
根據(jù)Crigna等人2018年進行的一項研究。
“間充質(zhì)干細胞主要通過旁分泌和內(nèi)分泌作用模式發(fā)揮其再生作用,包括免疫調(diào)節(jié)、抗炎、促有絲分裂、抗凋亡、抗氧化應(yīng)激、抗纖維化和血管生成影響。”?[1]
3.1脂肪組織來源的間充質(zhì)干細胞 (ADSC)
脂肪組織來源的間充質(zhì)干細胞是從皮下脂肪組織(脂肪組織)中獲得的,可以通過吸脂手術(shù)快速大量獲得且具有高細胞活性?[2]。??
當(dāng)來自年輕的捐贈者時,ADSC可能更具有活力。對于參與自體手術(shù)(使用您的細胞)的老年患者來說,這可能是一個問題,因為老年細胞可能不太適合接受者的長期生存。與老年供體相比,年輕供體的脂肪組織來源的間充質(zhì)干細胞(ADSC)具有更高的增殖率(移植后的存活率),但分化能力隨著年齡的增長而保持,因此比骨髓間充質(zhì)干細胞(BM-MSCs)更具優(yōu)勢。
然而,ADSC確實保持了分化為中胚層(中間細胞層)來源細胞的潛力,并且通常因其低免疫原性和調(diào)節(jié)作用而聞名。其中不到1%在其表面表達HLA-DR蛋白,從而產(chǎn)生免疫抑制作用,使其適合同種異體移植和治療耐藥性免疫疾病的臨床應(yīng)用。?[2]
人們普遍認為ADSC可用于各種不同的條件。ADSC也可以成為大多數(shù)骨科治療的可行來源。常見的應(yīng)用可能是脊髓損傷、關(guān)節(jié)炎、局部關(guān)節(jié)炎癥、膝蓋疼痛和其他肌肉骨骼問題。
然而,ADSC在臨床環(huán)境中的使用仍然存在一些挑戰(zhàn)。這些挑戰(zhàn)包括與細胞年齡有關(guān)的增殖限制、有限的分化能力和方案標(biāo)準(zhǔn)化。
根據(jù)Mazini等人發(fā)表的一項研究。
“ADSC在起源、類型和使用方式方面代表了許多治療挑戰(zhàn),最近的不同研究為其在組織修復(fù)中的成功治療應(yīng)用鋪平了道路。需要對標(biāo)準(zhǔn)化技術(shù)使用有更多的見解,以評估深入的療效干細胞的有益作用以及組織再生的范式可能不僅限于細胞修復(fù),還可能與以下方面有關(guān):細胞短暫的旁分泌作用。”
3.2骨髓間充質(zhì)干細胞 (BM-MSC)
骨髓間充質(zhì)干細胞(BM-MSCs)被歸類為多能成體干細胞,憑借其自我更新、分化和免疫調(diào)節(jié)特性,廣泛應(yīng)用于各種疾病的治療。
“體外和體內(nèi)研究支持了對 BM-MSC 治療在臨床應(yīng)用中的機制、安全性和有效性的理解。I/II 期臨床試驗的數(shù)量正在加速;然而,它們的規(guī)模有限。 BMSC的制備、運輸和管理的主題、法規(guī)和標(biāo)準(zhǔn)存在差異,導(dǎo)致治療的輸入和結(jié)果不一致。”?[3]
局限性
骨髓采集是一種高度侵入性且痛苦的過程,需要全身麻醉和多天的醫(yī)院護理。BM-MSC 構(gòu)成一個稀有群體,僅占總基質(zhì)(干)細胞群體的0.002%,其分離取決于患者狀態(tài)和收集的物質(zhì)體積。?[2]
與ADSC類似,骨髓干細胞的數(shù)量和質(zhì)量隨著年齡的增長而下降。當(dāng)采用同種異體(細胞來自第三方)治療時,來自年輕捐贈者的BM-MSC可能更具活力。對于參與自體手術(shù)的老年患者來說,這可能是一個問題,因為老年細胞可能不太適合在接受者體內(nèi)長期生存。Chu等人概述了這個問題。在2020年的一項研究中。
“從老年人身上分離出的干細胞,其增殖率和分化成成骨細胞的能力較低,但它們會增加凋亡標(biāo)記物和 SA-β-gal 陽性細胞(衰老細胞指標(biāo))的表達”?[3]
大多數(shù)臨床前和臨床試驗都顯示骨髓間充質(zhì)干細胞在治療各種疾病方面取得了良好的效果,并且在隨訪期間幾乎沒有不良反應(yīng)。目前,BM-MSCs療法已用于治療骨關(guān)節(jié)炎、神經(jīng)退行性疾病和運動相關(guān)損傷。?[3]
3.3臍帶組織來源的間充質(zhì)干細胞 (UC-MSC)
UC-MSC 可來源于多種區(qū)域,包括沃頓膠、臍帶內(nèi)膜和臍帶血管周圍區(qū)域。作為一種常見的廢棄組織,臍帶含有豐富的間充質(zhì)基質(zhì)細胞來源,因此可以通過非侵入性方式獲得?[14]。?
“UC-MSC是最原始的MSC類型,其 Oct4、Nanog、Sox2 和 KLF4 標(biāo)記物的較高表達表明了這一點。”?[1]
臍帶組織來源的間充質(zhì)干細胞具有分化成不同細胞類型的能力,并且在上述三種類型的干細胞(脂肪、骨髓、臍帶組織)中具有最高的增殖率。?[2]
與脂肪組織和骨髓來源的MSC類似,UC-MSC能夠分泌生長因子、細胞因子和趨化因子,從而改善不同的細胞修復(fù)機制。?[4]。這些功能都有助于MSC的抗炎和免疫調(diào)節(jié)特性。
非侵入性細胞產(chǎn)品
UC-MSC的采集過程是非侵入性的,因為它不需要從患者體內(nèi)提取。間充質(zhì)干細胞直接取自道德捐贈的人類臍帶區(qū)域。
與BMSC和ASC相比,UC-MSC還具有較高的增殖潛力,這意味著它們在體外擴增更有效,從而在獲得更多細胞數(shù)量時效率更高。[15]
研究發(fā)現(xiàn),UC-MSCs與細胞增殖(EGF)、PI3K-NFkB信號通路(TEK)和神經(jīng)發(fā)生(RTN1、?NPPB和NRP2)相關(guān)的基因在UC-MSCs中上調(diào)(受體數(shù)量增加)。到BM-MSC中。[15]
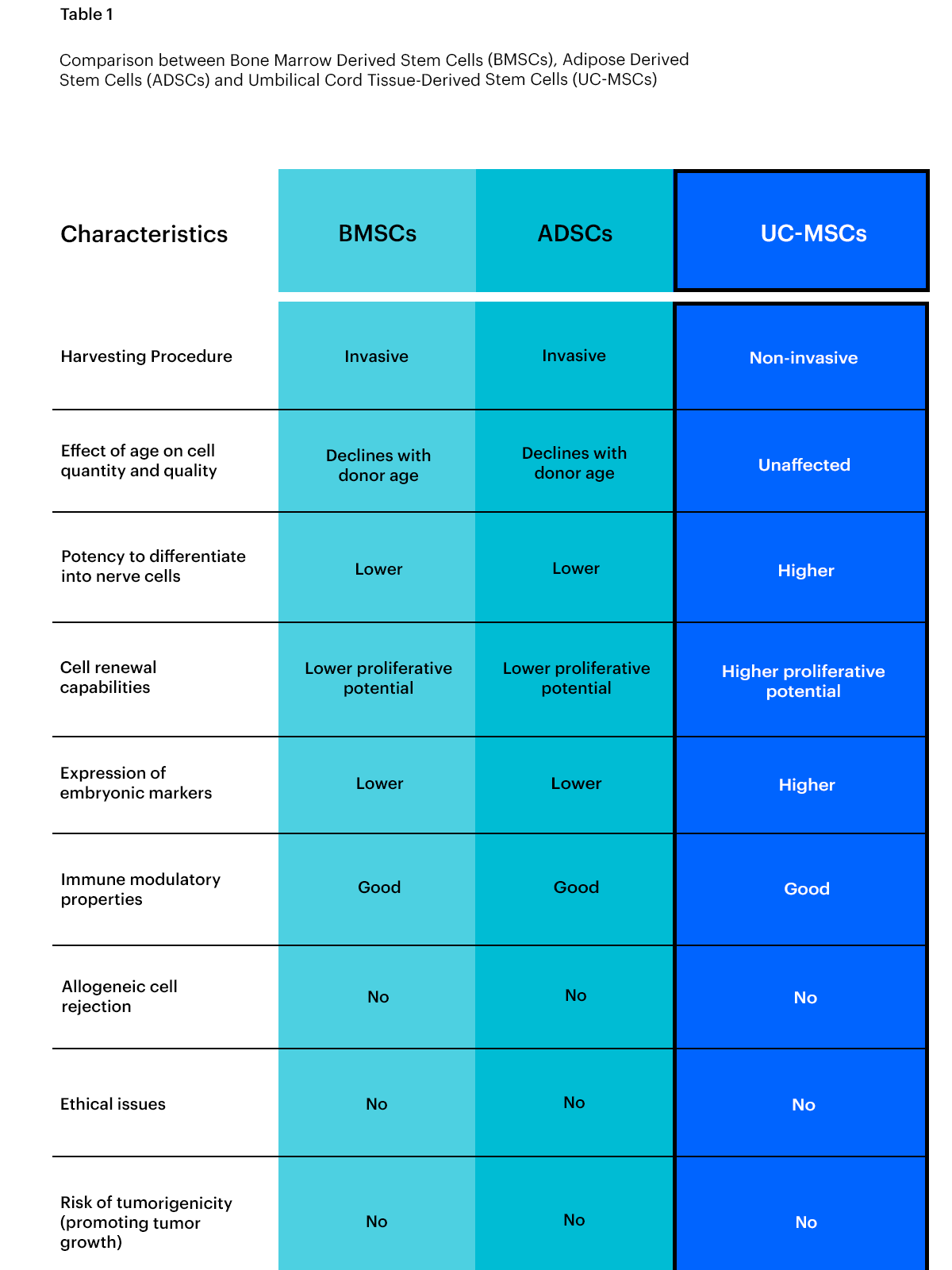
下圖顯示了BMSC、ADSC和UC-MSC之間的比較。
04.間充質(zhì)干細胞如何在體內(nèi)發(fā)揮作用?
間充質(zhì)干細胞利用其自我更新、免疫調(diào)節(jié)、抗炎、信號傳導(dǎo)和分化特性來影響體內(nèi)的積極變化。間充質(zhì)干細胞 (MSC) 還具有通過分裂和發(fā)育成特定組織或器官中存在的多種專門細胞類型來自我更新的能力。間充質(zhì)干細胞是成體干細胞,這意味著它們不存在倫理問題,間充質(zhì)干細胞并非源自胚胎材料。
“不存在重大倫理問題、免疫原性低、具有免疫調(diào)節(jié)功能的特點使間充質(zhì)干細胞成為干細胞治療的有希望的候選者。”?– 江等人。[6]
4.1免疫調(diào)節(jié)(調(diào)節(jié)免疫系統(tǒng))
間充質(zhì)干細胞(MSC)可以通過在免疫系統(tǒng)激活不足時促進炎癥反應(yīng)以及在免疫系統(tǒng)過度激活時減少炎癥來調(diào)節(jié)免疫系統(tǒng)。間充質(zhì)干細胞可以在防止免疫系統(tǒng)攻擊自身方面發(fā)揮關(guān)鍵作用,類似于許多自身免疫性疾病中可能看到的情況。根據(jù)Bernardo等人2013年進行的一項研究。當(dāng)間充質(zhì)干細胞暴露于足夠水平的促炎標(biāo)記物(細胞因子)時,會通過促進免疫抑制反應(yīng)來抑制炎癥并促進組織穩(wěn)態(tài)。[7]
根據(jù)Jiang等人2019年進行的一項研究。
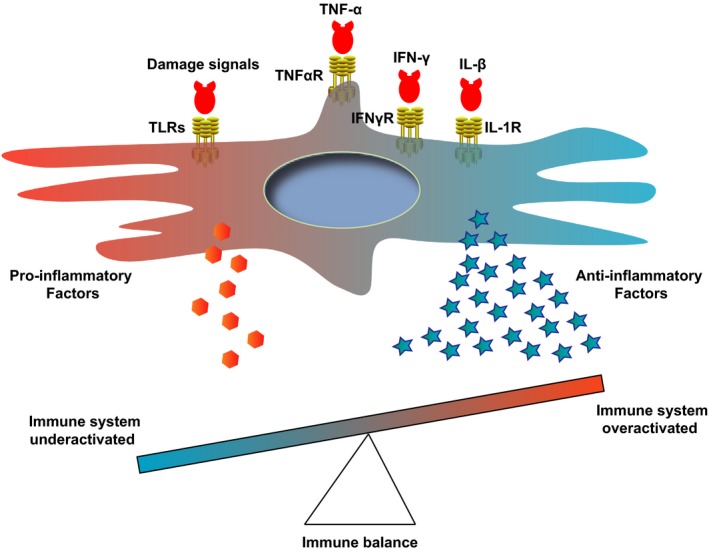
“根據(jù)信號類型或強度,間充質(zhì)干細胞分泌細胞因子來促進或抑制免疫反應(yīng),以維持免疫平衡。”
下圖中的同一研究概述了這種平衡。
4.2抗炎(減少有害炎癥)
炎癥是免疫系統(tǒng)的一種反應(yīng),旨在保護身體免受有害的外部刺激,并幫助和修復(fù)身體。然而,當(dāng)炎癥失調(diào)時,會對身體產(chǎn)生有害影響。免疫系統(tǒng)長期失調(diào)會導(dǎo)致多種自身免疫性疾病,例如多發(fā)性硬化癥、1型糖尿病、炎癥性腸病或狼瘡。[7]
間充質(zhì)干細胞的抗炎特性在其治療能力中發(fā)揮著關(guān)鍵作用。??
間充質(zhì)干細胞如何減輕炎癥呢?
“來自不同來源的間充質(zhì)干細胞通過減少腫瘤壞死因子-α (TNF-α) 和干擾素-γ (IFN-γ) 的產(chǎn)生以及增加前列腺素 (PGE2) 和白介素-6 (IL-6) 的分泌來減少炎癥。”[9]
根據(jù)Gugjoo等人2020年進行的一項研究。
“一般來說,間充質(zhì)干細胞(MSC) 在維持體內(nèi)平衡(免疫調(diào)節(jié)和抗炎活性)方面的核心作用是通過與免疫細胞相互作用來實現(xiàn)的,并通過細胞因子、趨化因子、細胞表面分子和代謝途徑介導(dǎo)。MSC抑制T細胞增殖、細胞因子分泌和細胞毒性 [9]“
4.3間充質(zhì)干細胞分泌組和細胞外囊泡(外泌體信號傳導(dǎo))
間充質(zhì)干細胞的再生作用不僅依賴于其分化潛力和替代受損組織的能力,而且還由其分泌組通過旁分泌機制介導(dǎo)。[5]
MSC分泌組是一組釋放到體內(nèi)的生物活性因子,包括細胞因子、生長因子、細胞外囊泡、神經(jīng)營養(yǎng)因子、可溶性蛋白質(zhì)、脂質(zhì)和核酸。[5]
釋放的分泌蛋白組在許多生理過程的調(diào)節(jié)中發(fā)揮著重要作用,并且它們作為疾病的潛在生物標(biāo)志物和治療靶點越來越受到人們的關(guān)注。[10]
根據(jù)Arutyunyan等人2016年進行的一項研究。與骨髓來源的 (BM-MSC) 相比,UC-MSC表現(xiàn)出神經(jīng)營養(yǎng)因子的分泌增加,例如bFGF、神經(jīng)生長因子 (NGF)、神經(jīng)營養(yǎng)蛋白3 (NT3)、神經(jīng)營養(yǎng)蛋白4 (NT4) 和膠質(zhì)源性神經(jīng)營養(yǎng)因子 (GDNF) MSC)和脂肪組織來源的(AT-MSC)。[15]
此外,與BM相比,UC-MSC分泌的多種重要細胞因子和造血生長因子的數(shù)量明顯更高,包括G-CSF、GM-CSF、LIF、IL-1α、IL-6、IL-8和IL-11間充質(zhì)干細胞。這表明UC-MSC可能比其他來源的MSC更有效。?
4.4歸巢特性(間充質(zhì)干細胞如何知道去哪里)
間充質(zhì)干細胞的主要優(yōu)點之一是由于其固有的歸巢能力,它們能夠靶向特定的關(guān)注區(qū)域。當(dāng)全身施用時,間充質(zhì)干細胞歸巢可以定義為退出循環(huán)并遷移到損傷部位。[11]
根據(jù)Ullah等人2019年進行的一項研究。
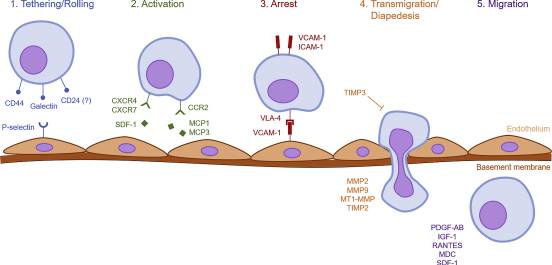
系統(tǒng)歸巢是一個由特定分子相互作用控制的多步驟過程。“系統(tǒng)歸巢的過程可以分為五個步驟:(1)束縛和滾動,(2)激活,(3)停滯,(4)輪回或滲出,以及(5)遷移”。
下圖概述了此過程。
4.5分化(成為新型細胞)
間充質(zhì)干細胞是多能干細胞,可以自我更新并分化成不同的細胞類型。換句話說,間充質(zhì)干細胞可以變成多種不同的細胞類型,包括:脂肪組織、軟骨、肌肉、肌腱/韌帶、骨骼、神經(jīng)元和肝細胞 (12)
根據(jù) Almalki 等人2016年進行的一項研究。- “MSC分化為特定的成熟細胞類型是由各種細胞因子、生長因子、細胞外基質(zhì)分子和轉(zhuǎn)錄因子 (TF) 控制的。[12]
間充質(zhì)干細胞有助于組織再生和分化,包括維持體內(nèi)平衡和功能、適應(yīng)改變的代謝或環(huán)境要求以及修復(fù)受損組織。[13]
結(jié)論
綜上所述,間充質(zhì)干細胞作為一種多功能的成體干細胞,在再生醫(yī)學(xué)、組織工程等領(lǐng)域展現(xiàn)出了巨大的應(yīng)用價值。其廣泛存在于人體內(nèi)多種組織中的特性,加上易于體外擴增的特點,使其成為了科研工作者探索新型治療方法的理想工具。未來,隨著對MSCs生物學(xué)特性的進一步理解和技術(shù)手段的進步,相信這類神奇的細胞將在更多疾病的治療中發(fā)揮關(guān)鍵作用。
要了解有關(guān)間充質(zhì)干細胞在臨床環(huán)境中使用的更多信息,請訪問我們的方案頁面。
參考:
(1) Torres Crigna, A.、Daniele, C.、Gamez, C.、Medina Balbuena, S.、Pastene, DO、Nardozi, D….Bieback, K.(2018 年 6 月 15 日)。 干/基質(zhì)細胞治療腎損傷,重點關(guān)注臨床前模型。醫(yī)學(xué)前沿。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6013716/。
(2) Mazini, L.、Rochette, L.、Amine, M. 和 Malka, G.(2019 年 5 月 22 日)。 脂肪干細胞 (ADSC) 的再生能力,與間充質(zhì)干細胞 (MSC) 的比較。國際分子科學(xué)雜志。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6566837/。
(3) Chu, D.-T., Phuong, TNT, Tien, NLB, Tran, DK, Thanh, VV, Quang, TL, … Kushekhar, K.(2020 年 1 月 21 日)。 人骨髓間充質(zhì)干細胞/基質(zhì)細胞分離、培養(yǎng)、保存及臨床應(yīng)用的最新進展。國際分子科學(xué)雜志。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7037097/。
(4) Jin, HJ, Bae, YK, Kim, M., Kwon, S.-J., Jeon, HB, Choi, SJ, Kim, SW, Yang, YS, Oh, W., & Chang, JW ( 2013 年 9 月 3 日)。 來自骨髓、脂肪組織和臍帶血的人間充質(zhì)干細胞作為細胞治療來源的比較分析。國際分子科學(xué)雜志。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3794764/。
(5) Liau, LL、Looi, QH、Chia, WC、Subramaniam, T.、Ng, MH 和 Law, JX(2020 年 9 月 22 日)。 用間充質(zhì)干細胞治療脊髓損傷。細胞與生物科學(xué)。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7510077/。
(6) 江文、徐靜(2020 年 1 月)。 間充質(zhì)干細胞的免疫調(diào)節(jié)。細胞增殖。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6985662/。
(7) 貝爾納多 (ME) 和菲比 (WE) (2013)。間充質(zhì)基質(zhì)細胞:炎癥的傳感器和開關(guān)。 細胞干細胞, 13(4),392–402。https://doi.org/10.1016/j.stem.2013.09.006
(8) Ryu, J.-S.、Jeong, E.-J.、Kim, J.-Y.、Park, SJ、Ju, WS、Kim, C.-H.、Kim, J.-S. ,&Choo,Y.-K。(2020 年 11 月 7 日)。 間充質(zhì)干細胞在炎癥和纖維化疾病中的應(yīng)用。國際分子科學(xué)雜志。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7664655/。
(9) Gugjoo, MB、Hussain, S.、Amarpal、Shah, RA 和 Dhama, K. (2020)。 免疫和過敏性疾病中間充質(zhì)干細胞介導(dǎo)的免疫調(diào)節(jié)和抗炎機制。最近的炎癥和過敏藥物發(fā)現(xiàn)專利。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7509741/。
(10) Stastna, M. 和 Van Eyk, JE(2012 年,2 月 1 日)。 研究分泌蛋白組:有關(guān)構(gòu)成心臟的細胞的課程。循環(huán)。心血管遺傳學(xué)。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3282018/。
(11) Ullah, M.、Liu, DD 和 Thakor, AS(2019 年 5 月 31 日)。 間充質(zhì)基質(zhì)細胞歸巢:改進機制和策略。i科學(xué)。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6529790/。
(12) SG 阿爾馬爾基和 DK 阿格拉瓦爾 (2016)。 間充質(zhì)干細胞分化的關(guān)鍵轉(zhuǎn)錄因子。差異化;生物多樣性研究。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5010472/。
(13) Grafe, I.、Alexander, S.、Peterson, JR、Snider, TN、Levi, B.、Lee, B. 和 Mishina, Y.(2018 年 5 月 1 日)。 間充質(zhì)分化中的 TGF-β 家族信號傳導(dǎo)。冷泉港的生物學(xué)觀點。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5932590/。
(14) Walker, JT、Keating, A. 和 Davies, JE(2020 年 5 月 28 日)。 干細胞:臍帶/沃頓膠干細胞。細胞工程和再生。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7992171/。
(15) Arutyunyan, I.、Elchaninov, A.、Makarov, A. 和 Fatkhudinov, T. (2016)。 臍帶作為間充質(zhì)干細胞治療的潛在來源。干細胞國際。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5019943/。
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構(gòu)成任何臨床診斷建議!杭吉干細胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信