近年來,細(xì)胞療法為炎癥性腸病(IBD)患者提供了突破性治療方向,其核心機制在于通過免疫調(diào)節(jié)與組織修復(fù)雙重作用重建腸道穩(wěn)態(tài)。間充質(zhì)干細(xì)胞(MSC) 作為主流策略,通過分泌抗炎因子(如IL-10、TGF-β)抑制Th1/Th17細(xì)胞過度活化,促進(jìn)調(diào)節(jié)性T細(xì)胞(Treg)分化,并修復(fù)受損黏膜屏障。
中國在此領(lǐng)域進(jìn)展顯著,2018年至今已有3款干細(xì)胞新藥(臍帶/脂肪源MSC)獲藥監(jiān)局批準(zhǔn)。
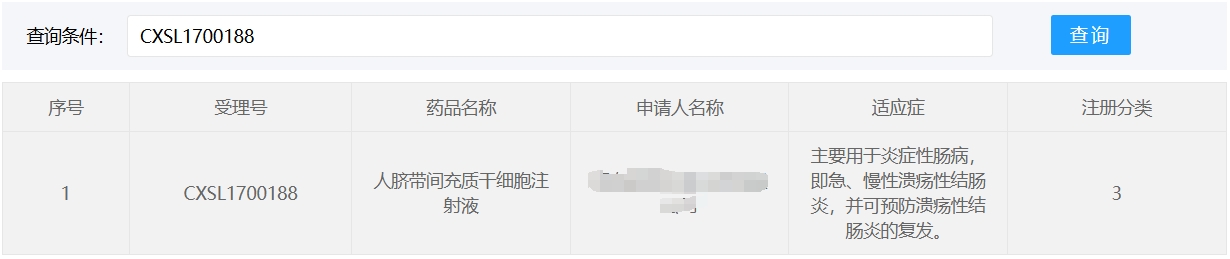
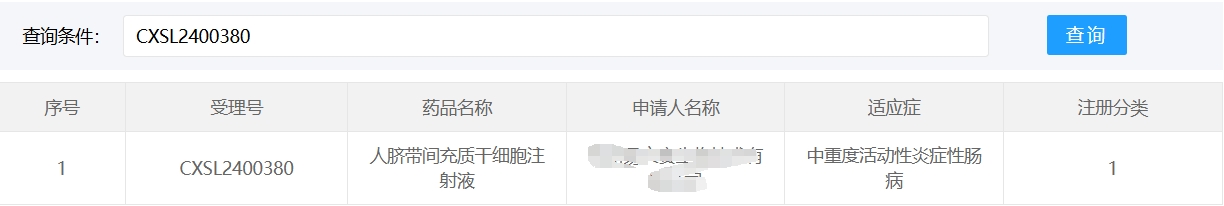
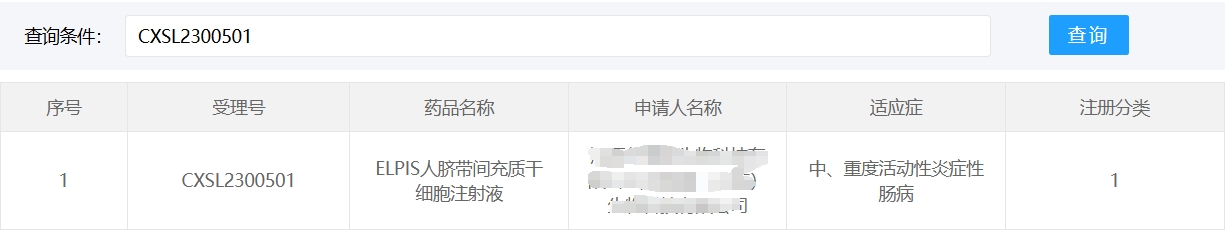
然而,細(xì)胞療法的規(guī)模化生產(chǎn)、長期安全性及成本控制(單療程約30-50萬元)仍是挑戰(zhàn)。未來需優(yōu)化歸巢技術(shù)(如CCR9修飾提升靶向性)、開發(fā)緩釋載體(如3D打印微球),并探索聯(lián)合療法(如與生物制劑聯(lián)用),以推動細(xì)胞療法成為IBD個體化治療的新支柱。
本文旨在通過解答8大問題闡述細(xì)胞療法在炎癥性腸病領(lǐng)域的機制探索、臨床轉(zhuǎn)化及未解難題,為未來研究提供方向性見解[1]。

01、為何業(yè)界開始關(guān)注用細(xì)胞療法治療炎癥性腸病患者?
細(xì)胞療法在炎癥性腸病領(lǐng)域引發(fā)關(guān)注的核心原因在于突破了傳統(tǒng)藥物開發(fā)的根本局限。長期以來,單一分子或蛋白質(zhì)的遞送難題制約著治療效果——如何精準(zhǔn)遞送活性物質(zhì)至病灶部位始終是研發(fā)瓶頸。而自然界進(jìn)化數(shù)億年的活細(xì)胞天然具備雙重優(yōu)勢:既能動態(tài)合成關(guān)鍵生物分子調(diào)控疾病進(jìn)程(如抑制炎癥或促進(jìn)愈合),又自帶”歸巢本能”實現(xiàn)精準(zhǔn)靶向遞送。
于是新挑戰(zhàn)轉(zhuǎn)變?yōu)椋喝绾巫R別維持有益或有害作用的特定細(xì)胞類型?
如何富集這些細(xì)胞?直到某天我們突然頓悟:或許細(xì)胞自身就能成為治療載體。這徹底顛覆了疾病治療的認(rèn)知框架。
這一認(rèn)知顛覆催生了治療范式革新:細(xì)胞本身成為治療載體后,不僅能替代昂貴的體外生物合成,更可同時調(diào)控多重分子通路(如免疫抑制與黏膜修復(fù)協(xié)同作用)。相較于實驗室人工合成的模擬物質(zhì),細(xì)胞療法直接利用患者體內(nèi)天然存在的功能性細(xì)胞,通過駕馭細(xì)胞自身生物學(xué)機制,實現(xiàn)對復(fù)雜疾病網(wǎng)絡(luò)的系統(tǒng)性干預(yù),為炎癥性腸病提供了前所未有的多靶點治療可能。
02、目前針對炎癥性腸病的細(xì)胞療法研究聚焦于哪些細(xì)胞類型?
答:克羅恩病領(lǐng)域已應(yīng)用多種細(xì)胞療法。最廣為人知的是間充質(zhì)細(xì)胞療法,其中多數(shù)產(chǎn)品屬于同種異體療法(即使用他人細(xì)胞),而自體療法則采用患者自身細(xì)胞。同種異體間充質(zhì)療法已開展II/III期研究,旨在作為黏膜修復(fù)療法或瘺管型病變治療方案。該類療法雖已在歐洲上市,但尚未進(jìn)入國際市場。
一、間充質(zhì)干細(xì)胞(MSCs)為核心,同種異體與自體方案并行
研究最集中的是間充質(zhì)干細(xì)胞(MSCs),尤其是脂肪源性(ADSCs)和骨髓源性細(xì)胞。多數(shù)進(jìn)展集中在同種異體療法(如歐盟已批準(zhǔn)的Alofisel),通過局部注射修復(fù)瘺管,臨床緩解率達(dá)59.2%(52周),優(yōu)于傳統(tǒng)療法。
但I(xiàn)II期結(jié)果存在矛盾:部分因細(xì)胞歸巢能力不足或免疫排斥(異體細(xì)胞被清除),療效依賴細(xì)胞死亡后釋放的生長因子。自體MSCs因避免排斥風(fēng)險被重新探索,但受限于患者脂肪組織獲取難度。
二、造血干細(xì)胞移植(HSCT)針對難治性患者,但應(yīng)用受限
造血干細(xì)胞(HSCs) 是另一重點,主要用于重度難治性克羅恩病。通過大劑量化療清除異常免疫細(xì)胞后,回輸自體HSCs重建健康免疫系統(tǒng),旨在實現(xiàn)長期緩解。但此類療法風(fēng)險高(如感染),目前僅限特定人群,歐美正推進(jìn)其安全性和適應(yīng)癥優(yōu)化研究。
當(dāng)前主要細(xì)胞療法類型及研究進(jìn)展
| 細(xì)胞類型 | 研究階段 | 優(yōu)勢 | 主要挑戰(zhàn) | 代表療法/進(jìn)展 |
|---|---|---|---|---|
| 同種異體MSCs | 臨床III期/已上市(歐洲) | 無需患者自體細(xì)胞,可規(guī)模化生產(chǎn) | 免疫排斥、歸巢能力不足 | Alofisel(脂肪源干細(xì)胞) |
| 自體MSCs | 臨床II-III期 | 無免疫排斥風(fēng)險 | 患者脂肪組織獲取受限 | 局部注射治療肛周瘺 |
| 造血干細(xì)胞 | 臨床II-III期 | 重建免疫系統(tǒng),潛在長期緩解 | 高感染風(fēng)險,適用人群有限 | 難治性CD患者移植 |
| 調(diào)節(jié)性T細(xì)胞 | 早期研究 | 精準(zhǔn)免疫調(diào)節(jié) | 亞型篩選復(fù)雜 | 歐美早期臨床試驗 |
三、新興療法拓展靶點:調(diào)節(jié)性T細(xì)胞與CAR-T技術(shù)
為提升精準(zhǔn)性,研究向調(diào)節(jié)性T細(xì)胞(Tregs) 和CAR-T細(xì)胞延伸:
- Tregs療法:通過調(diào)節(jié)免疫應(yīng)答抑制炎癥,歐美進(jìn)入早期試驗,探索不同亞型對潰瘍性結(jié)腸炎的作用;
- CAR-T細(xì)胞:借鑒腫瘤治療,改造T細(xì)胞靶向異常B細(xì)胞(如CD19/BCMA)或髓系細(xì)胞,嘗試重塑免疫平衡,但仍處實驗室階段。
四、未來方向:通用型細(xì)胞開發(fā)與精準(zhǔn)功能優(yōu)化
當(dāng)前研究從“初始熱潮”轉(zhuǎn)向理性設(shè)計:
- 第二代同種異體細(xì)胞:改造細(xì)胞避免免疫清除(如基因編輯HLA),并強化其歸巢與定植能力,而非僅作為因子載體;
- 亞型精細(xì)化篩選:區(qū)分MSCs或Tregs的功能亞群,結(jié)合基質(zhì)材料提升局部滯留率;
- 個體化給藥策略:根據(jù)患者免疫狀態(tài)匹配細(xì)胞類型(如難治瘺管用MSCs,免疫異常用HSCT)。
未來5–10年,隨著這些策略落地,IBD治療有望從全局免疫抑制轉(zhuǎn)向病灶特異性修復(fù)。
3、細(xì)胞療法如何確定給藥劑量?
答:這種治療方式顛覆了傳統(tǒng)給藥理念。我們不再局限于藥代動力學(xué)層面(即組織內(nèi)藥物濃度),轉(zhuǎn)而關(guān)注活細(xì)胞數(shù)量、細(xì)胞在靶組織的持續(xù)存在能力及局部微環(huán)境調(diào)控能力。對于細(xì)胞療法,劑量設(shè)計的核心在于確保足量活性細(xì)胞抵達(dá)目標(biāo)組織。
即便在同種異體療法中無法直接測量”定植”等指標(biāo),仍需確保劑量足以實現(xiàn)預(yù)期療效。當(dāng)療法旨在促進(jìn)組織愈合或清除致病細(xì)胞群時,個體化給藥將成為必然趨勢——這需要大量伴隨診斷技術(shù)來監(jiān)測細(xì)胞行為、存活狀態(tài)及靶向準(zhǔn)確性。
癌癥治療領(lǐng)域已提供借鑒:患者復(fù)發(fā)時,可通過重復(fù)給藥或輔助細(xì)胞輸注來增強療效,劑量調(diào)整取決于新細(xì)胞在骨髓等部位的定植能力及穩(wěn)態(tài)建立情況。
隨著技術(shù)演進(jìn),細(xì)胞療法的給藥理念將走向高度個體化。這遠(yuǎn)非傳統(tǒng)藥物維持特定濃度那般簡單,而需構(gòu)建復(fù)雜體系確保細(xì)胞精準(zhǔn)歸巢并發(fā)揮設(shè)計功能。
4、細(xì)胞療法的給藥途徑有哪些研究進(jìn)展?
答:一是間接全身給藥——將細(xì)胞注入循環(huán)系統(tǒng)。例如造血干細(xì)胞移植時,采集的干細(xì)胞經(jīng)靜脈回輸。這些細(xì)胞天生具備”歸巢分子”,能自主返回骨髓”定居”并發(fā)揮治療功能。但需注意:某些細(xì)胞療法可能缺乏此類定向遷移機制,無法在全身給藥后精準(zhǔn)歸巢。
另一些企業(yè)則探索局部給藥方案,即向靶組織直接注射細(xì)胞。這種組織定向給藥策略甚至延伸至活體生物制劑(以細(xì)菌為治療載體):雖然多數(shù)情況下旨在將微生物遞送至腸道特定部位,但已有研究嘗試將細(xì)菌直接注射至目標(biāo)組織發(fā)揮作用。
在間充質(zhì)干細(xì)胞療法中,針對瘺管治療采用局部注射:先對瘺管清創(chuàng)創(chuàng)造利于細(xì)胞定植的微環(huán)境,再行注射。該過程不僅涉及給藥部位預(yù)處理,還需將細(xì)胞搭載于適宜基質(zhì)材料中。企業(yè)正著力研發(fā)新型基質(zhì)以提升組織再生與細(xì)胞定植效率——這才是細(xì)胞療法的本質(zhì)功能。
5、歷年來干細(xì)胞治療炎癥性腸病的研究進(jìn)展
難治性肛周瘺克羅恩病(CD)
2024年,由法國馬賽大學(xué)醫(yī)學(xué)院牽頭聯(lián)合多國研究團(tuán)隊,剛剛發(fā)表在國際權(quán)威雜志《Stem Cell Research&Therapy》一項系統(tǒng)綜述及薈萃分析研究,納入截至2023年12月的25項臨床試驗,涵蓋596名難治性肛周瘺患者,全面對比脂肪干細(xì)胞與骨髓干細(xì)胞療法的長期效果。治療炎癥性腸病的方法有哪些?現(xiàn)干細(xì)胞治療積累的成果為其指明新方向

結(jié)果表明:目前已有多種基于間充質(zhì)干細(xì)胞的療法正在開發(fā)或已投入使用。這些療法對治療CD中的難治性和/或復(fù)雜性會陰瘺有效,并可實現(xiàn)綜合緩解。最佳療效通常在治療6個月后達(dá)到。ASC和BMSC療法之間尚未證實存在優(yōu)勢。
潰瘍性結(jié)腸炎(UC)系統(tǒng)治療
2025年1月15日,經(jīng)國家衛(wèi)生健康委審批,桂林醫(yī)學(xué)院附屬醫(yī)院正式獲批成為廣西首家干細(xì)胞臨床研究備案機構(gòu),獲得開展干細(xì)胞臨床研究的資質(zhì)。
醫(yī)院消化病院消化內(nèi)科主任李濱教授為主要研究者的“人臍帶間充質(zhì)干細(xì)胞注射液治療中、重度活動期潰瘍性結(jié)腸炎患者安全性和初步有效性的隨機、雙盲、安慰劑對照的臨床研究”也成功完成了干細(xì)胞臨床研究項目備案。這是廣西首個完成備案的干細(xì)胞臨床研究項目。
2010年,青島大學(xué)附屬醫(yī)院開展臍帶間充質(zhì)干細(xì)胞治療中重度潰瘍性結(jié)腸炎的長期有效性研究。研究結(jié)果顯示,臍帶間充質(zhì)干細(xì)胞治療后的近期有效率達(dá)到87.5%。該成果在《Experimental andTherapeutic Medicine》上刊登。

這篇論文表明:臍帶間充質(zhì)干細(xì)胞治療中重度潰瘍性結(jié)腸炎是一種有效的治療方法,并且具有較好的安全性和耐受性。雖然需要進(jìn)一步的臨床研究驗證其療效,但是這種干細(xì)胞治療方法具有廣泛的應(yīng)用前景,有望成為未來治療腸道疾病的一種新方法。
6、細(xì)胞療法在實現(xiàn)炎癥性腸病長期緩解方面有何潛力?
答:這觸及”治愈”概念的核心,其潛力在于:植入的健康細(xì)胞可獨立于誘發(fā)疾病的病理生理環(huán)境發(fā)揮作用。其細(xì)胞療法在治療炎癥性腸病長期緩解方面可通過三方面:
一、突破性治愈潛力:重塑細(xì)胞命運軌跡
細(xì)胞療法的核心價值在于觸及“治愈”本質(zhì)——通過植入健康細(xì)胞或基因修正的細(xì)胞(如同種異體細(xì)胞/修復(fù)遺傳缺陷的自體細(xì)胞),使其獨立于誘發(fā)IBD的病理環(huán)境發(fā)揮作用。這種干預(yù)能徹底改變疾病相關(guān)的細(xì)胞群體命運,例如:
- 遺傳修正:采集患者細(xì)胞后修復(fù)致病突變(如NOD2基因),回輸后重建健康細(xì)胞群;
- 免疫重置:通過造血干細(xì)胞移植清除異常免疫記憶,恢復(fù)免疫穩(wěn)態(tài)。
這為從根源阻斷疾病進(jìn)展提供了可能。
二、雙路徑實現(xiàn)持久緩解:預(yù)防與逆轉(zhuǎn)并行
針對IBD長期緩解存在兩大科學(xué)路徑:
- 預(yù)防性干預(yù):消除遺傳與環(huán)境風(fēng)險因素(如改造易感基因),阻止疾病發(fā)生;
- 狀態(tài)逆轉(zhuǎn):清除細(xì)胞在IBD中的?“異常記憶”(如過度炎癥反應(yīng)),將其重置至疾病前狀態(tài)。
當(dāng)前重點在于解析細(xì)胞獲得”不良行為”的機制(如表觀遺傳改變),并通過細(xì)胞療法富集未受影響的健康細(xì)胞群體。即便無法完全治愈,也可能實現(xiàn)>5年的無藥緩解期。
三、技術(shù)演進(jìn)方向:長效性與精準(zhǔn)性突破
未來突破需解決三大關(guān)鍵問題:
- 長效維持機制:設(shè)計具備自我更新能力的植入細(xì)胞(如改造干細(xì)胞),避免反復(fù)輸注;
- 精準(zhǔn)靶向重置:開發(fā)伴隨診斷技術(shù),動態(tài)監(jiān)測細(xì)胞行為(如CAR-T對異常B細(xì)胞的清除效果);
- 體內(nèi)外協(xié)同策略:結(jié)合基因編輯(體外修正細(xì)胞)與小分子藥物(體內(nèi)微環(huán)境調(diào)控),提升”細(xì)胞矯正”效率。
目標(biāo)是通過單次或有限療程實現(xiàn)終身緩解,推動IBD治療從癥狀控制轉(zhuǎn)向根本性逆轉(zhuǎn)。
7、使用細(xì)胞療法治療炎癥性腸病是否存在安全隱患?
答:對于涉及植入外來細(xì)胞或經(jīng)工程化改造使其快速增殖的細(xì)胞療法,我們始終擔(dān)憂細(xì)胞過度增殖可能導(dǎo)致癌癥等風(fēng)險。但總體而言,在克羅恩病臨床試驗中,這種風(fēng)險僅停留在理論層面,尚未證實具有顯著臨床意義。需強調(diào)的是,風(fēng)險程度因療法而異。例如CAR-T細(xì)胞療法需先進(jìn)行化療為細(xì)胞增殖騰出空間,這本身就會產(chǎn)生系列風(fēng)險。
細(xì)胞療法的風(fēng)險演變可能類似生物制劑早期階段——當(dāng)時人們因同屬抗體藥物而預(yù)設(shè)了相似風(fēng)險。
未來我們終將認(rèn)識到:不同細(xì)胞療法風(fēng)險各異,主要取決于其設(shè)計功能。譬如細(xì)胞需長期定植體內(nèi)還是短期存留(約1-2周后隨體液自然排出),其風(fēng)險特征截然不同。
另一理論風(fēng)險(尤其對異體產(chǎn)品)在于:患者可能接觸從未遇見的免疫抗原。若存在特定蛋白錯配,這些細(xì)胞可能意外誘發(fā)免疫應(yīng)答反應(yīng)。這在CAR-T細(xì)胞療法等特定治療中已有觀察案例,需根據(jù)個體情況密切監(jiān)測。
8、該領(lǐng)域下一步最關(guān)鍵的研究方向是什么?
答:關(guān)鍵步驟包括:首先持續(xù)完善醫(yī)療機構(gòu)的細(xì)胞療法輸注基礎(chǔ)設(shè)施體系,同時開展精準(zhǔn)的轉(zhuǎn)化醫(yī)學(xué)研究以驗證細(xì)胞是否按設(shè)計功能發(fā)揮作用并準(zhǔn)確抵達(dá)靶向部位。這些基礎(chǔ)工作將推動重大進(jìn)展。此外,確保在特定疾病患者中開展早期研究至關(guān)重要。
當(dāng)前對細(xì)胞療法的認(rèn)知往往存在疾病間不可遷移性——例如細(xì)胞在健康人群與克羅恩病患者體內(nèi)的作用機制可能存在本質(zhì)差異。盡管健康志愿者早期研究仍有價值,但唯有在長期治療的目標(biāo)人群(炎癥性腸病患者)中開展研究,才能深入揭示該疾病的病理生理學(xué)機制。
主要參考資料:
[1]Cohen LJ. Insights Into Cell Therapies for Patients With Inflammatory Bowel Disease. Gastroenterology & Hepatology. 2025 May;21(5):311-314. PMID: 40416917; PMCID: PMC12100522.
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信