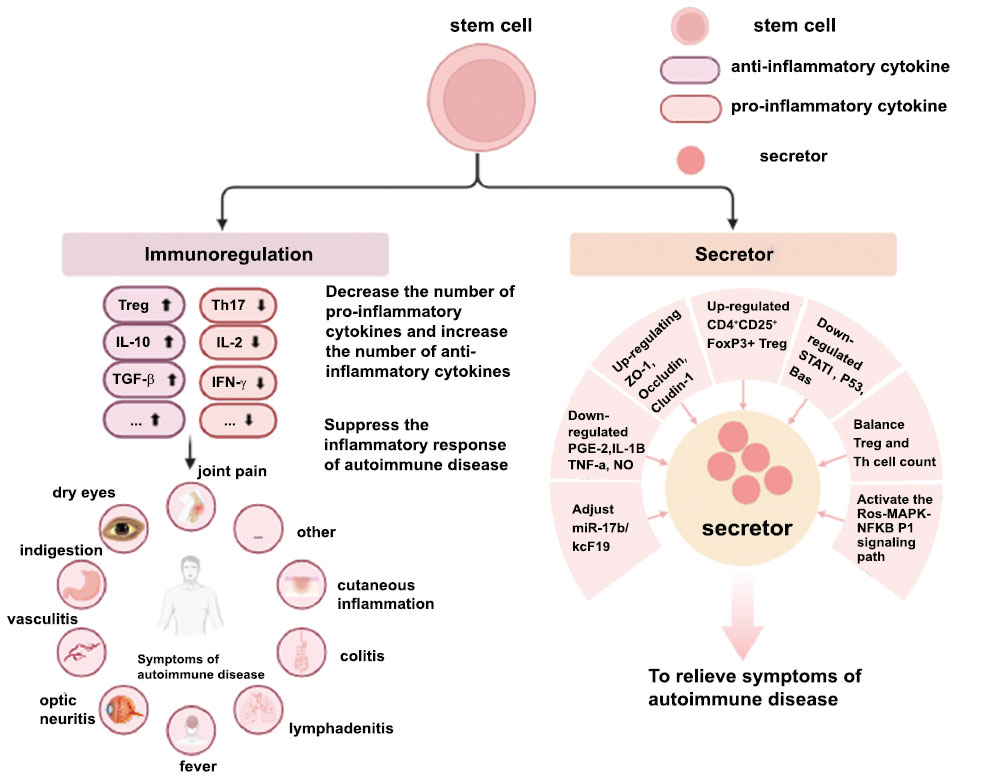
干細(xì)胞憑借其強(qiáng)大的自我更新和分化能力在多種疾病中發(fā)揮治療作用,尤其在自身免疫性疾病的治療中。目前,干細(xì)胞治療自身免疫性疾病的機(jī)制主要依賴(lài)于其免疫調(diào)節(jié)能力,調(diào)節(jié)患者體內(nèi)輔助細(xì)胞、抗炎因子和促炎因子的數(shù)量和功能,從而減輕炎癥。另一方面,干細(xì)胞來(lái)源的分泌體免疫原性弱、分子量小,能夠靶向損傷部位,與復(fù)合材料結(jié)合后可以延長(zhǎng)其在患者體內(nèi)的作用時(shí)間。因此,分泌體在干細(xì)胞治療自身免疫性疾病中的作用日益重要。
2024年,在國(guó)際期刊雜志《當(dāng)前的干細(xì)胞研究與療法》發(fā)表一篇關(guān)于”干細(xì)胞及其分泌的外泌體治療自身免疫性疾病的機(jī)制“的文章,該文章旨在幫助廣大患有自身免疫性疾病的患者了解干細(xì)胞及外泌體治療自身免疫性疾病的具體機(jī)制。
干細(xì)胞及其外泌體在治療自身免疫性疾病中的作用機(jī)制
干細(xì)胞研究的起源與關(guān)鍵突破:20世紀(jì)60年代,人們發(fā)現(xiàn)骨髓中有一類(lèi)細(xì)胞能夠支持造血,并能分化成骨,干細(xì)胞研究由此開(kāi)始蓬勃發(fā)展。1988年,這類(lèi)細(xì)胞被正式命名為“骨髓基質(zhì)干細(xì)胞”。進(jìn)一步的研究促使這些細(xì)胞中又單獨(dú)劃分出一個(gè)亞類(lèi),稱(chēng)為“間充質(zhì)干細(xì)胞”。這標(biāo)志著干細(xì)胞研究的真正開(kāi)端。
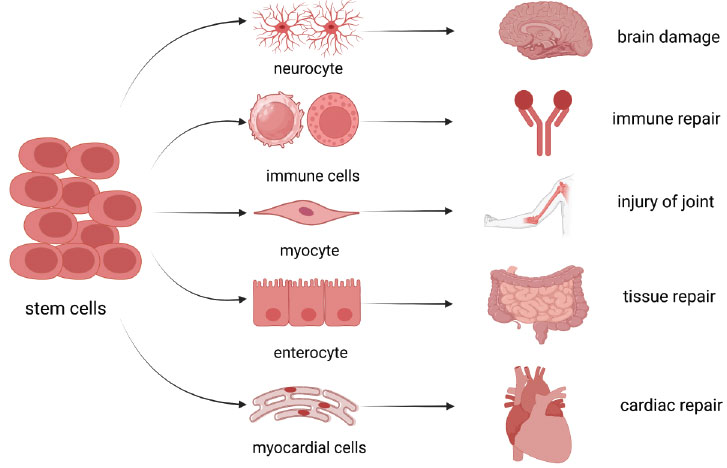
干細(xì)胞的分類(lèi)體系與再生醫(yī)學(xué)價(jià)值:目前,干細(xì)胞通常分為全能性、多能性和特化性三類(lèi),其中胚胎干細(xì)胞、間充質(zhì)干細(xì)胞、造血干細(xì)胞等類(lèi)型干細(xì)胞由于具有自我更新和分化成各種特定組織的能力,在再生醫(yī)學(xué)領(lǐng)域得到了廣泛的研究(圖1)。
自身免疫性疾病的發(fā)病機(jī)制:干細(xì)胞發(fā)育異常與免疫紊亂
自身免疫性疾病(AID)是危害人類(lèi)健康的常見(jiàn)疾病,其發(fā)病機(jī)制復(fù)雜多樣,主要原因是由于自身免疫系統(tǒng)的結(jié)構(gòu)和功能紊亂,使機(jī)體產(chǎn)生針對(duì)自身組織器官的抗體,破壞了組織器官的結(jié)構(gòu)和功能,造成多種器官功能障礙和激素分泌失衡,從而增加了自身免疫性疾病的發(fā)生概率。
由于自身免疫性疾病的發(fā)生與機(jī)體的免疫功能有關(guān),可以通過(guò)檢查患者體內(nèi)免疫細(xì)胞的數(shù)量和功能來(lái)判斷免疫系統(tǒng)在自身免疫性疾病發(fā)生中的作用。同時(shí),機(jī)體的各種免疫細(xì)胞都是由干細(xì)胞發(fā)育而來(lái)的。然而,如果微環(huán)境或細(xì)胞本身出現(xiàn)異常,影響干細(xì)胞發(fā)育,就會(huì)導(dǎo)致成熟細(xì)胞的結(jié)構(gòu)和功能異常,從而引發(fā)自身免疫性疾病(圖2)。
干細(xì)胞移植:自身免疫性疾病治療的新策略突破
自身免疫性疾病對(duì)人體健康具有長(zhǎng)期危害作用。然而,各類(lèi)自身免疫性疾病的發(fā)病機(jī)制和治療方法復(fù)雜多樣,很難制定出一套統(tǒng)一的臨床治療方案。此外,常規(guī)治療方法無(wú)法治愈此類(lèi)疾病,因?yàn)橐恍┳陨砻庖咝约膊?duì)治療產(chǎn)生耐藥性或會(huì)引起嚴(yán)重的副作用。
近年來(lái),隨著干細(xì)胞研究的不斷深入,人們發(fā)現(xiàn)某些疾病的免疫細(xì)胞異常可以追溯到造血干細(xì)胞/祖細(xì)胞。干細(xì)胞移植逐漸成為此類(lèi)疾病的新治療策略,自體造血干細(xì)胞移植已被公認(rèn)為是嚴(yán)重難治性自身免疫性風(fēng)濕病患者的治療選擇。因此,本文綜述了干細(xì)胞在某些自身免疫性疾病的發(fā)病機(jī)制和治療中的作用,為其在臨床治療中的應(yīng)用提供理論和實(shí)踐依據(jù)。
適應(yīng)性免疫失衡與干細(xì)胞分化:自身免疫性疾病的核心病理關(guān)聯(lián)
自身免疫性疾病最常見(jiàn)的原因是自身抗體的產(chǎn)生。抗體是由機(jī)體免疫系統(tǒng)通過(guò)適應(yīng)性免疫反應(yīng)產(chǎn)生的。因此,自身免疫性疾病的發(fā)生大多與適應(yīng)性免疫有關(guān)。例如,自身抗原的抗原表位丟失和增多,導(dǎo)致機(jī)體免疫系統(tǒng)無(wú)法識(shí)別自身組織,從而激活機(jī)體先天免疫中的巨噬細(xì)胞,將抗原呈遞給機(jī)體其他特異性免疫細(xì)胞。在適應(yīng)性免疫激活的條件下,B細(xì)胞分泌相應(yīng)的抗體,或者T細(xì)胞分化為致敏的T細(xì)胞,攻擊自身的組織成分并造成損傷。
因此,大多數(shù)自身免疫性疾病患者存在調(diào)節(jié)性T細(xì)胞和輔助性T細(xì)胞比例失衡,也可能存在B細(xì)胞過(guò)度分泌抗體的情況。由于這些細(xì)胞是由干細(xì)胞發(fā)育而來(lái)的,如果免疫細(xì)胞的祖細(xì)胞在分化過(guò)程中發(fā)生突變,導(dǎo)致抗原表位的改變,就會(huì)導(dǎo)致先天性和適應(yīng)性免疫的激活,從而導(dǎo)致自身免疫性疾病的發(fā)生。
干細(xì)胞治療多種類(lèi)自身免疫性疾病的臨床研究進(jìn)展
自身免疫性疾病種類(lèi)繁多,如系統(tǒng)性紅斑狼瘡和類(lèi)風(fēng)濕性關(guān)節(jié)炎是常見(jiàn)的自身免疫性結(jié)締組織疾病,潰瘍性結(jié)腸炎是常見(jiàn)的消化系統(tǒng)免疫疾病,多發(fā)性硬化癥是與中樞神經(jīng)系統(tǒng)相關(guān)的免疫疾病,糖尿病是自身免疫性?xún)?nèi)分泌疾病的典型代表。因此,本文選取這些疾病作為代表進(jìn)行綜述,并總結(jié)其發(fā)病機(jī)制及與干細(xì)胞相關(guān)的治療機(jī)制,旨在為后續(xù)研究提供相關(guān)基礎(chǔ)。
干細(xì)胞治療系統(tǒng)性紅斑狼瘡
傳統(tǒng)治療局限與干細(xì)胞療法的興起
系統(tǒng)性紅斑狼瘡(SLE)的傳統(tǒng)治療依賴(lài)糖皮質(zhì)激素聯(lián)合免疫抑制劑(如環(huán)磷酰胺、甲氨蝶呤),雖能抑制病情進(jìn)展,但長(zhǎng)期使用易引發(fā)感染、代謝紊亂等副作用,且難以恢復(fù)免疫穩(wěn)態(tài)。近年來(lái),干細(xì)胞療法因其獨(dú)特的免疫調(diào)節(jié)和組織修復(fù)能力成為SLE治療的新方向。研究發(fā)現(xiàn),SLE患者體內(nèi)間充質(zhì)干細(xì)胞(MSCs)功能異常(如骨髓MSCs中microRNA Let-7f表達(dá)降低),導(dǎo)致促炎因子IL-6升高,加劇Th17/Treg細(xì)胞失衡,而干細(xì)胞移植可通過(guò)調(diào)控免疫細(xì)胞分化與炎癥信號(hào)通路,從根源干預(yù)疾病進(jìn)程。
干細(xì)胞病變與SLE發(fā)病機(jī)制的深度關(guān)聯(lián)
SLE的發(fā)病與造血干細(xì)胞(HSPCs)及間充質(zhì)干細(xì)胞的表觀遺傳和功能紊亂密切相關(guān)。狼瘡模型顯示,HSPCs發(fā)生髓系偏向性轉(zhuǎn)錄重編程,促炎因子(IL-1、GM-CSF)驅(qū)動(dòng)其分化為過(guò)度活躍的髓系細(xì)胞,加劇炎癥損傷。同時(shí),SLE患者BM-MSCs中Let-7f表達(dá)下調(diào),通過(guò)解除對(duì)IL-6的抑制,直接破壞Th17/Treg平衡;而外泌體攜帶的miR-146a可加速M(fèi)SCs衰老,進(jìn)一步削弱其免疫調(diào)控能力。這些發(fā)現(xiàn)揭示干細(xì)胞不僅是SLE病理的“受害者”,更是驅(qū)動(dòng)免疫失衡的“始動(dòng)者”。
干細(xì)胞治療的潛力與挑戰(zhàn)
基于機(jī)制研究,干細(xì)胞療法在SLE中展現(xiàn)出多靶點(diǎn)干預(yù)潛力:
- 間充質(zhì)干細(xì)胞移植:通過(guò)分泌抗炎因子(如TGF-β、IL-10)抑制Th17分化,促進(jìn)Treg增殖,重建免疫耐受;
- 基因修飾策略:如過(guò)表達(dá)Let-7f或沉默IL-6基因,可增強(qiáng)MSCs的免疫調(diào)節(jié)功能;
- 外泌體遞送:利用工程化外泌體攜帶特定miRNA(如miR-146a拮抗劑),精準(zhǔn)調(diào)控靶細(xì)胞通路。
目前臨床研究已證實(shí)異體MSCs輸注可顯著降低SLE疾病活動(dòng)指數(shù)(SLEDAI),但干細(xì)胞衰老、歸巢效率及長(zhǎng)期安全性仍需優(yōu)化。未來(lái)需結(jié)合單細(xì)胞測(cè)序與類(lèi)器官模型,解析干細(xì)胞異質(zhì)性,推動(dòng)個(gè)體化治療。
干細(xì)胞調(diào)控免疫失衡的核心機(jī)制
近年來(lái),干細(xì)胞療法在系統(tǒng)性紅斑狼瘡(SLE)治療中展現(xiàn)出獨(dú)特潛力,其核心功能在于通過(guò)多通路重塑免疫穩(wěn)態(tài)。人臍帶間充質(zhì)干細(xì)胞(HUC-MSCs)移植后,通過(guò)分泌miRNA(如miR-199a-5p)靶向調(diào)控T細(xì)胞衰老相關(guān)通路(Sirt5/p21軸),抑制CD4+ T細(xì)胞過(guò)度活化;同時(shí),通過(guò)低表達(dá)TGF-β1調(diào)節(jié)Th17/Treg平衡,減少促炎因子釋放并抑制mTORC1通路,從而阻斷炎癥級(jí)聯(lián)反應(yīng)。這些機(jī)制協(xié)同作用,顯著改善脾臟及腎臟等靶器官的病理?yè)p傷。
近日,首先,有報(bào)道稱(chēng),間充質(zhì)干細(xì)胞來(lái)源的外泌體可通過(guò)調(diào)節(jié)巨噬細(xì)胞促進(jìn)胞吐和募集IL-17調(diào)節(jié)性T細(xì)胞來(lái)緩解SLE癥狀。此外,多項(xiàng)研究發(fā)現(xiàn)巨噬細(xì)胞在外泌體治療SLE中發(fā)揮重要作用。更重要的是,MSC-Exos移植可顯著抑制M1巨噬細(xì)胞的極化,降低TNF-α和IL-1β的表達(dá),并增加巨噬細(xì)胞中M2標(biāo)志物的表達(dá)(圖3)。
干細(xì)胞移植治療系統(tǒng)性紅斑狼瘡的臨床試驗(yàn)
近期,新華社報(bào)道,南京鼓樓醫(yī)院風(fēng)濕免疫科孫凌云教授在該領(lǐng)域深耕20余年,開(kāi)創(chuàng)了異體間充質(zhì)干細(xì)胞治療新技術(shù),目前已帶領(lǐng)團(tuán)隊(duì)用間充質(zhì)干細(xì)胞治療方案成功治療2800余例重癥紅斑狼瘡、系統(tǒng)性硬化癥等免疫疾病,有效率達(dá)60%,顯著降低了死亡率,避免了傳統(tǒng)治療的嚴(yán)重副作用。

2018年,國(guó)際期刊《STEM CELL REPORTS》上刊登了關(guān)于間充質(zhì)干細(xì)胞治療系統(tǒng)性紅斑狼瘡的臨床研究。這是一項(xiàng)開(kāi)放標(biāo)簽的II期臨床試驗(yàn),81名重度難治性系統(tǒng)性紅斑狼瘡患者接受異體骨髓/臍帶間充質(zhì)干細(xì)胞靜脈輸注治療,并進(jìn)行了平均長(zhǎng)達(dá)5年的隨訪。

該研究中,22名患者第一次細(xì)胞治療使用的是異體骨髓間充質(zhì)干細(xì)胞,其中4名患者因病情復(fù)發(fā),在第二次治療時(shí)接受了臍帶間充質(zhì)干細(xì)胞治療。另有2名患者在第一次治療后又接受了2次臍帶間充質(zhì)干細(xì)胞輸注,有1名患者在第一次治療后又接受了3次臍帶間充質(zhì)干細(xì)胞輸注。
81名患者中的其余59人,所有療程的治療都選用臍帶間充質(zhì)干細(xì)胞,其中7例接受了二次細(xì)胞輸注,1例接受3次細(xì)胞輸注,1例接受了4次細(xì)胞輸注。此外,在間充質(zhì)干細(xì)胞移植前,有39名患者接受了3天的環(huán)磷酰胺治療,其它42例患者未接受該治療。
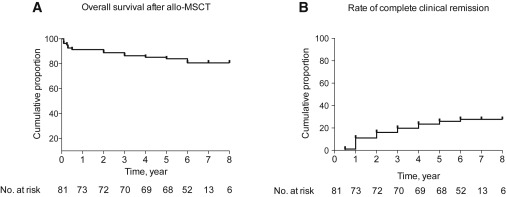
術(shù)后5年總生存率為84%。在5年隨訪中,27%的患者處于完全臨床緩解狀態(tài),另有7%的患者處于部分臨床緩解狀態(tài),5年疾病緩解率為34%。總共有37例患者達(dá)到臨床緩解狀態(tài),隨后有9例患者復(fù)發(fā),5年總復(fù)發(fā)率為24%。另外,隨訪期間,系統(tǒng)性紅斑狼瘡疾病活動(dòng)指數(shù)評(píng)分、血清白蛋白、補(bǔ)體C3、外周血白細(xì)胞、血小板數(shù)量以及蛋白尿水平持續(xù)改善。
值得注意的是,這一療法還可改善多個(gè)器官功能,多名患者治療前的癥狀得到改善,包括間質(zhì)性肺炎、彌漫性肺泡出血、Stevens-Johnson綜合征(重癥多形紅斑型藥疹)、癲癇、頭痛等。
干細(xì)胞治療類(lèi)風(fēng)濕性關(guān)節(jié)炎
類(lèi)風(fēng)濕性關(guān)節(jié)炎的治療分為一般治療、藥物治療和手術(shù)治療。一般治療是通過(guò)功能鍛煉和物理治療來(lái)恢復(fù)身體的局部功能,而藥物治療則多通過(guò)非甾體類(lèi)抗炎藥物來(lái)減輕炎癥癥狀。與系統(tǒng)性紅斑狼瘡一樣,這些治療僅針對(duì)患者的癥狀,并不能從根本上解決患者的后顧之憂(yōu),因此干細(xì)胞的出現(xiàn)為類(lèi)風(fēng)濕性關(guān)節(jié)炎的治愈帶來(lái)了希望。
類(lèi)風(fēng)濕性關(guān)節(jié)炎的發(fā)病機(jī)制
類(lèi)風(fēng)濕關(guān)節(jié)炎 (RA) 是一種病因不明的慢性炎癥性自身免疫性疾病。其特征是手足小關(guān)節(jié)的多關(guān)節(jié)、對(duì)稱(chēng)性和侵襲性關(guān)節(jié)炎,常伴有關(guān)節(jié)外器官受累和血清類(lèi)風(fēng)濕因子陽(yáng)性,可導(dǎo)致關(guān)節(jié)畸形和功能喪失。它還以異常的血液表型為特征,包括貧血和淋巴生成抑制,這會(huì)增加患者的發(fā)病率。
類(lèi)風(fēng)濕性關(guān)節(jié)炎(RA)的發(fā)病機(jī)制主要為三大方面聚焦免疫衰老、干細(xì)胞異常與滑膜增生間的相互作用:
1. 免疫細(xì)胞衰老與自身耐受崩潰
RA的核心機(jī)制是免疫穩(wěn)態(tài)失衡,表現(xiàn)為T(mén)/B細(xì)胞異常活化及自身抗體(如類(lèi)風(fēng)濕因子、抗CCP抗體)的產(chǎn)生。近年研究發(fā)現(xiàn),免疫細(xì)胞過(guò)早衰老是驅(qū)動(dòng)疾病的關(guān)鍵因素:
- 造血干細(xì)胞(HSPCs)衰老:HSPCs作為免疫細(xì)胞的源頭,其衰老導(dǎo)致分化能力下降(如多向分化潛能喪失),分泌功能(如細(xì)胞因子)失調(diào),進(jìn)而生成功能缺陷的免疫細(xì)胞(如促炎性Th17細(xì)胞增多、調(diào)節(jié)性T細(xì)胞減少),加速自身免疫攻擊。
- 衰老相關(guān)分泌表型(SASP):衰老的HSPCs釋放IL-6、TNF-α等促炎因子,通過(guò)NF-κB通路激活滑膜成纖維細(xì)胞,形成“炎癥-衰老”惡性循環(huán)。
2. 骨髓干細(xì)胞異常與滑膜病理增生
RA的滑膜增生與骨髓干細(xì)胞分化紊亂密切相關(guān):
- 滑膜前體細(xì)胞來(lái)源異常:A型滑膜細(xì)胞(類(lèi)似巨噬細(xì)胞)可能源自骨髓單核細(xì)胞,B型滑膜細(xì)胞(成纖維樣)可能源于骨髓樹(shù)突狀細(xì)胞,其異常遷移與活化受TNF-α、GM-CSF等驅(qū)動(dòng)。
- CD34+祖細(xì)胞功能失調(diào):RA患者骨髓中CD34+祖細(xì)胞在炎癥因子(如TNF-α)刺激下,過(guò)度分化為破骨細(xì)胞前體,促進(jìn)關(guān)節(jié)骨侵蝕;同時(shí),其修復(fù)性分化能力(如軟骨再生)受損,加劇關(guān)節(jié)破壞。
3. 炎癥微環(huán)境與表觀遺傳調(diào)控
- 慢性炎癥微環(huán)境通過(guò)表觀遺傳修飾進(jìn)一步惡化干細(xì)胞功能:
- 表觀遺傳重編程:滑膜成纖維細(xì)胞在炎癥刺激下發(fā)生DNA甲基化異常(如TNF-α誘導(dǎo)的DNMT1抑制),導(dǎo)致促炎基因(如MMPs、COX-2)持續(xù)表達(dá),促進(jìn)滑膜侵襲。
- 外泌體介導(dǎo)的細(xì)胞間通訊:衰老干細(xì)胞釋放的外泌體攜帶miRNA(如miR-155、miR-146a),調(diào)控滑膜細(xì)胞增殖及免疫細(xì)胞極化,形成“自身免疫-組織破壞”正反饋。
干細(xì)胞移植治療類(lèi)風(fēng)濕性關(guān)節(jié)炎的臨床試驗(yàn)
目前,類(lèi)風(fēng)濕性關(guān)節(jié)炎(RA)的傳統(tǒng)治療方法效果有限,因此自體干細(xì)胞移植成為治療難治性類(lèi)風(fēng)濕性關(guān)節(jié)炎(RA)的一種公認(rèn)的方法。
自體干細(xì)胞移植通過(guò)免疫調(diào)控與抗炎機(jī)制治療類(lèi)風(fēng)濕性關(guān)節(jié)炎
自體干細(xì)胞移植通過(guò)多途徑重塑類(lèi)風(fēng)濕性關(guān)節(jié)炎(RA)的免疫失衡。
2019年,伊朗科研人員在期刊雜志《生物醫(yī)學(xué)與藥物治療學(xué)》上發(fā)表了一篇“自體骨髓間充質(zhì)干細(xì)胞治療后難治性類(lèi)風(fēng)濕性關(guān)節(jié)炎患者臨床癥狀改善的臨床試”的文章。

該研究納入了9名無(wú)其他風(fēng)濕病的難治性RA患者。所有患者均接受單次靜脈注射劑量為1×106自體骨髓來(lái)源的MSCs/kg,并在注射MSCs后1、6和12個(gè)月進(jìn)行隨訪。我們發(fā)現(xiàn),與時(shí)間點(diǎn)零相比,在注射MSCs12個(gè)月后,Th17 百分比和 IL-17A 的幾何平均熒光強(qiáng)度呈顯著下降趨勢(shì)。此外,在干預(yù)后第一個(gè)月末觀察到調(diào)節(jié)性T細(xì)胞百分比顯著增加。
在隨訪期間,VAS評(píng)分呈顯著下降趨勢(shì)。干預(yù)后,血清CRP和抗CCP水平無(wú)顯著差異。總之,我們的數(shù)據(jù)表明,在對(duì)難治性RA患者進(jìn)行自體骨髓MSCs靜脈注射后,臨床癥狀得到顯著改善。
異體干細(xì)胞移植的療效優(yōu)勢(shì)與風(fēng)險(xiǎn)挑戰(zhàn)
異體間充質(zhì)干細(xì)胞通過(guò)分泌吲哚胺2,3-雙加氧酶(IDO)抑制濾泡輔助T細(xì)胞(Tfh)分化,阻斷自身抗體產(chǎn)生,同時(shí)調(diào)節(jié)Treg/Th17平衡,實(shí)現(xiàn)持續(xù)抗炎。
如 2019年,空軍第九八六醫(yī)院和澳門(mén)大學(xué)健康科學(xué)學(xué)院的研究團(tuán)隊(duì)在《DrugDesign,DevelopmentandTherapy》期刊上發(fā)表了一項(xiàng)重要的臨床研究成果。該研究在ClinicalTrials.gov注冊(cè)(NCT01547091)并經(jīng)過(guò)中國(guó)人民解放軍空軍986醫(yī)院倫理委員會(huì)批準(zhǔn)。

研究團(tuán)隊(duì)招募了64名年齡在18-64歲的RA患者。入組標(biāo)準(zhǔn)包括至少一個(gè)關(guān)節(jié)腫脹,三個(gè)或更多關(guān)節(jié)腫脹,晨僵平均持續(xù)3小時(shí),并有至少一次血液測(cè)試結(jié)果顯示存在類(lèi)風(fēng)濕性關(guān)節(jié)炎,且癥狀持續(xù)至少6周。在治療期間,患者在輸注100ml鹽水后立即靜脈注射40ml臍帶間充質(zhì)干細(xì)胞混懸液(2×10^7細(xì)胞/20ml)。治療結(jié)果顯示,干細(xì)胞療法對(duì)患者的免疫平衡恢復(fù)和炎癥控制效果顯著。
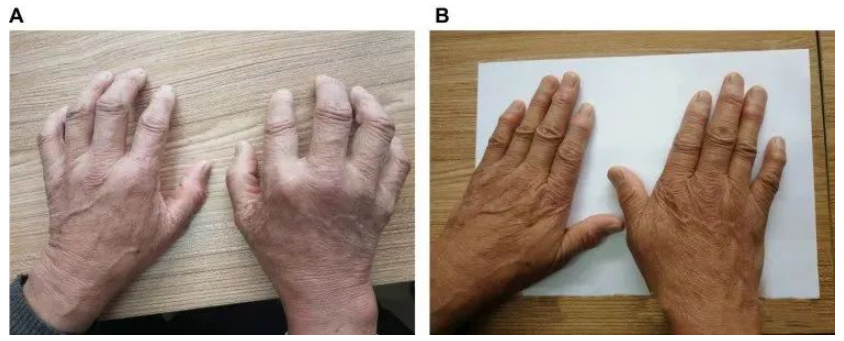
一名68歲的男性患者,在接受MSCs治療前,雙手關(guān)節(jié)無(wú)法伸直。在經(jīng)過(guò)3年的治療后,他已停用抗風(fēng)濕藥物5年,雙手能夠自如伸展,關(guān)節(jié)周?chē)娘L(fēng)濕結(jié)節(jié)逐漸變軟消退。更令人振奮的是,治療后1年和3年的血常規(guī)、肝腎功能和免疫球蛋白檢查均無(wú)異常,均在正常范圍內(nèi)。同時(shí),治療后1年和3年的血沉、C反應(yīng)蛋白(CRP)、類(lèi)風(fēng)濕因子(RF)以及治療后3年的抗環(huán)瓜氨酸肽抗體(抗CCP)均顯著低于治療前,差異具有統(tǒng)計(jì)學(xué)意義。患者的健康指數(shù)(HAQ)和關(guān)節(jié)功能指數(shù)(DAS28)在治療后1年和3年較治療前顯著下降(P<0.05)。
這項(xiàng)研究表明,臍帶間充質(zhì)干細(xì)胞(UC-MSC)聯(lián)合抗風(fēng)濕藥(DMARDs)治療對(duì)于類(lèi)風(fēng)濕性關(guān)節(jié)炎患者是安全、有效且可行的治療選擇。這不僅為類(lèi)風(fēng)濕患者帶來(lái)了新希望,也為再生醫(yī)學(xué)的發(fā)展提供了寶貴的臨床數(shù)據(jù)。
然而,異體移植的GVHD風(fēng)險(xiǎn)仍存在不確定性,需結(jié)合精準(zhǔn)免疫抑制方案優(yōu)化安全性。相較于自體移植,異體策略雖療效持久,但需權(quán)衡免疫排斥與個(gè)體化匹配難題。
干細(xì)胞治療炎癥性腸病
炎癥性腸病與系統(tǒng)性紅斑狼瘡、類(lèi)風(fēng)濕性關(guān)節(jié)炎等類(lèi)似,目前尚無(wú)特效治療方法,患者疼痛主要依靠藥物緩解。干細(xì)胞的發(fā)現(xiàn)和廣泛應(yīng)用后,成為治療炎癥性腸病的新方法。
炎癥性腸病的發(fā)病機(jī)制:炎癥性腸病 (IBD) 的特征是胃腸道慢性復(fù)發(fā)性炎癥。潰瘍性結(jié)腸炎 (UC) 和克羅恩病 (CD) 是兩種典型的慢性炎癥性腸病,其病因多種多樣,例如遺傳因素、環(huán)境因素、管腔因素和黏膜免疫紊亂都可能導(dǎo)致該病。
其中最主要跟兩大機(jī)制相關(guān):
1、腸道干細(xì)胞損傷與炎癥模型的異質(zhì)性:炎癥性腸病(IBD)的發(fā)病與腸道干細(xì)胞(如Lgr5+隱窩基底干細(xì)胞)的損傷模式密切相關(guān),其丟失程度因炎癥誘導(dǎo)模型而異。在DSS誘導(dǎo)的結(jié)腸炎中,Lgr5+干細(xì)胞幾乎完全缺失,導(dǎo)致隱窩再生功能崩潰;而TNBS或惡唑酮模型中,干細(xì)胞仍部分存留但呈現(xiàn)區(qū)域異質(zhì)性,提示不同損傷機(jī)制(化學(xué)刺激 vs. 免疫失調(diào))對(duì)干細(xì)胞池的破壞方式不同。
此外,IL-10缺陷模型中干細(xì)胞滯留現(xiàn)象顯著,表明免疫微環(huán)境失衡(如抗炎因子缺乏)通過(guò)干擾干細(xì)胞遷移與定位加劇黏膜修復(fù)障礙。這些差異揭示了IBD亞型(如UC與CD)可能對(duì)應(yīng)特定的干細(xì)胞損傷路徑,為機(jī)制分型提供依據(jù)。
2、間充質(zhì)干細(xì)胞功能異常與免疫穩(wěn)態(tài)失衡:IBD的進(jìn)展還涉及組織駐留間充質(zhì)干細(xì)胞(MtSC)的增殖與分化異常。CD患者的MtSC(CD-MtSC)再生能力嚴(yán)重受損,PD-L1高表達(dá)抑制其免疫調(diào)節(jié)功能,而UC患者的MtSC(UC-MtSC)則表現(xiàn)為Oct4持續(xù)低表達(dá)與分化阻滯,導(dǎo)致黏膜修復(fù)缺陷。MtSC表面標(biāo)志物(如ALDH1A、Grem1)的異常持續(xù)表達(dá)進(jìn)一步擾亂隱窩-間質(zhì)對(duì)話(huà),削弱屏障修復(fù)并促進(jìn)慢性炎癥。
這些發(fā)現(xiàn)表明,MtSC不僅是IBD病理的“受害者”,其功能失調(diào)還可通過(guò)PD-L1等分子加劇免疫耐受崩潰,形成“損傷-修復(fù)失衡”惡性循環(huán),為靶向干細(xì)胞重塑黏膜穩(wěn)態(tài)提供新思路。
干細(xì)胞移植治療炎癥性腸病
與SLE、RA一樣,利用干細(xì)胞治療IBD也成為目前研究的熱點(diǎn),并取得了一些成果。
與SLE、RA一樣,利用干細(xì)胞治療IBD也成為目前研究的熱點(diǎn),并取得了一些成果。在利用間充質(zhì)干細(xì)胞治療IBD小鼠模型的實(shí)驗(yàn)中,研究人員發(fā)現(xiàn),病情嚴(yán)重程度以劑量依賴(lài)性方式降低。干細(xì)胞通過(guò)增加脾臟和腸系膜淋巴結(jié)中Tr1細(xì)胞的比例,并降低Th1和Th17細(xì)胞的比例來(lái)緩解癥狀。3-吲哚胺-2,3-雙加氧酶(IDO)隨后被消除,這表明在IBD的治療中,兩者之間可能存在協(xié)同關(guān)系。其中,胚胎來(lái)源的干細(xì)胞可以提高IGF-1水平,促進(jìn)上皮細(xì)胞再生和損傷修復(fù),也是治療潰瘍性結(jié)腸炎的重要干細(xì)胞來(lái)源。
此外,IBD最重要的治療是通過(guò)抗炎藥物修復(fù)受損的腸黏膜屏障,干細(xì)胞來(lái)源的外泌體可以通過(guò)這一途徑發(fā)揮治療作用。研究表明,腹膜內(nèi)注射MSC-Exos可以增加結(jié)腸組織中ZO-1、Occludin和Claudin-1的表達(dá),從而維持腸黏膜的功能和完整性。
外泌體療法的另一個(gè)作用是抑制促炎細(xì)胞因子的表達(dá),促進(jìn)抗炎細(xì)胞因子的表達(dá),因此,IL-4、IL-10 和 TNF-β 等抗炎因子在治療后往往會(huì)上調(diào),同時(shí)還能誘導(dǎo)結(jié)腸炎中 CD4+ T 細(xì)胞的分化,平衡 Th2 和 Th17 細(xì)胞的關(guān)系,從而改善結(jié)腸炎(圖3)。因此,外泌體的發(fā)現(xiàn)也可能為 IBD 提供一種新的治療方法。然而,目前利用干細(xì)胞和外泌體治療 IBD 的臨床病例很少,而且大多數(shù)隨訪時(shí)間較短,不能有效體現(xiàn)干細(xì)胞的治療機(jī)制,因此仍需要大量的臨床試驗(yàn)進(jìn)行進(jìn)一步探索。
干細(xì)胞治療多發(fā)性硬化癥
發(fā)病機(jī)制:與上述疾病不同的是,多發(fā)性硬化癥是一種累及中樞神經(jīng)系統(tǒng)的自身免疫性疾病,以脫髓鞘和軸突變?yōu)樘卣鳌?/p>
其中多發(fā)性硬化癥的發(fā)病機(jī)制有兩大因素相關(guān):
1. 環(huán)境-免疫交互作用與中樞神經(jīng)靶向損傷
MS的核心機(jī)制是自身免疫系統(tǒng)異常攻擊中樞神經(jīng)系統(tǒng),引發(fā)脫髓鞘與軸突變性。環(huán)境因素與遺傳易感性共同驅(qū)動(dòng)免疫失調(diào):
- 環(huán)境風(fēng)險(xiǎn):兒童期肥胖(高BMI)、維生素D缺乏、EB病毒/巨細(xì)胞病毒感染及有機(jī)溶劑暴露,通過(guò)表觀遺傳修飾(如DNA甲基化)激活外周自身反應(yīng)性T細(xì)胞,突破血腦屏障。
- 免疫極化失衡:Th1/Th17細(xì)胞過(guò)度活化,分泌IFN-γ、IL-17等促炎因子,募集小膠質(zhì)細(xì)胞及巨噬細(xì)胞,形成炎性病灶;同時(shí),調(diào)節(jié)性T細(xì)胞(Treg)功能缺陷(如FOXP3表達(dá)下調(diào)),導(dǎo)致免疫耐受崩潰。
2. 非編碼RNA與炎癥級(jí)聯(lián)的分子樞紐作用
長(zhǎng)鏈非編碼RNA(lncRNA)作為表觀遺傳調(diào)控因子,深度參與MS病理進(jìn)程:
- lncRNA異常表達(dá):復(fù)發(fā)緩解型MS(RRMS)患者中,SNHG1、lincRNA-Cox2等促炎lncRNA上調(diào),激活NLRP3炎癥小體(ASC/caspase-1通路),驅(qū)動(dòng)IL-1β釋放;而神經(jīng)保護(hù)性lncRNA(如NRC-EGFR)下調(diào),削弱少突膠質(zhì)細(xì)胞再生能力。
- 炎癥-修復(fù)失衡:血清TGF-β1水平降低進(jìn)一步抑制免疫調(diào)節(jié)與髓鞘修復(fù),形成“脫髓鞘-軸突損傷-慢性神經(jīng)退行”惡性循環(huán)。
?干細(xì)胞移植治療多發(fā)性硬化癥的臨床試驗(yàn)
目前,在另一項(xiàng)研究中,507名MS患者(包括414名復(fù)發(fā)緩解型MS患者和93名新診斷的繼發(fā)進(jìn)展型MS患者)被選中接受自體造血干細(xì)胞移植。同時(shí),研究發(fā)現(xiàn),治療后,神經(jīng)退行性 (SPMS) 患者的總體5年生存率為98.8%(而以炎癥為主 [即RRMS] 的患者約為80%)。
中樞神經(jīng)干細(xì)胞具有強(qiáng)大的自我更新和分化能力,可以根據(jù)中樞神經(jīng)系統(tǒng)微環(huán)境塑造自身形態(tài),并可通過(guò)分泌機(jī)制和細(xì)胞相互作用在營(yíng)養(yǎng)支持、免疫調(diào)節(jié)和代謝信號(hào)傳導(dǎo)中發(fā)揮作用;重建神經(jīng)與神經(jīng)膠質(zhì)細(xì)胞之間的功能;或喚醒內(nèi)源性神經(jīng)細(xì)胞以促進(jìn)神經(jīng)保護(hù)和組織修復(fù)。這表明,將這些細(xì)胞移植到多發(fā)性硬化癥患者體內(nèi),可以通過(guò)這些機(jī)制成為一種潛在的治療策略。
最近一項(xiàng)對(duì)120名接受自體造血干細(xì)胞移植的MS患者的回顧性研究發(fā)現(xiàn),隨訪兩年和四年后復(fù)發(fā)率明顯降低;93%的患者兩年無(wú)復(fù)發(fā),87%的患者四年無(wú)復(fù)發(fā)。結(jié)果表明,干細(xì)胞移植后患者的生存率和生活質(zhì)量明顯提高。也有研究表明干細(xì)胞在治療MS方面有更好的潛力。如外周造血干細(xì)胞移植有助于重建患者體內(nèi)的免疫細(xì)胞亞群(NK、CD4和CD8),從而減輕炎癥癥狀。尤其是輔助性T細(xì)胞和NK細(xì)胞的變化,造血干細(xì)胞移植后,NK細(xì)胞在短時(shí)間內(nèi)迅速重建,調(diào)節(jié)輔助性T細(xì)胞液的重建,減少炎癥浸潤(rùn)。與代謝物相比,干細(xì)胞移植對(duì)外周脂質(zhì)的影響更大,可在短時(shí)間內(nèi)降低甘油磷酸膽堿的濃度。神經(jīng)酰胺濃度受自體造血干細(xì)胞的影響,與白細(xì)胞計(jì)數(shù)相關(guān),在治療后三個(gè)月內(nèi)發(fā)生變化,并持續(xù)很長(zhǎng)時(shí)間。
除了干細(xì)胞的分化能力外,它們所來(lái)源的細(xì)胞外囊泡 (MSC-EVs) 已成為治療MS的新方法。MSC-EVs在治療中主要通過(guò)旁分泌信號(hào)傳導(dǎo)起作用,其功能似乎與其抗炎、髓鞘刺激、免疫調(diào)節(jié)和神經(jīng)保護(hù)作用有關(guān)。
首先,注射MSC-EVs可以抑制白細(xì)胞浸潤(rùn),減少促炎因子的釋放,抑制小膠質(zhì)細(xì)胞的活化并促進(jìn)促炎小膠質(zhì)細(xì)胞轉(zhuǎn)化為抗炎小膠質(zhì)細(xì)胞,從而達(dá)到抗炎作用。
其次,它還可以上調(diào)小鼠脊髓中 CD4+CD25+FOXP3+ 調(diào)節(jié)性 T 細(xì)胞 (Tregs) 的數(shù)量,降低凋亡標(biāo)志物STAT1、P53和 Bax 的表達(dá),從而具有神經(jīng)保護(hù)作用。治療后患者的病情也可能惡化。接受間充質(zhì)干細(xì)胞直接治療的多發(fā)性硬化癥患者可能會(huì)出現(xiàn)暫時(shí)性腦病,這可能危及生命。因此,需要大量的臨床研究來(lái)評(píng)估干細(xì)胞治療的安全性。
干細(xì)胞治療糖尿病
1型糖尿病的發(fā)病機(jī)制:除上述疾病外,糖尿病(DM)是一種常見(jiàn)的自身免疫性疾病,是由于胰島β細(xì)胞功能障礙,胰島素分泌不足,導(dǎo)致機(jī)體糖代謝紊亂,并引發(fā)一系列相關(guān)疾病。臨床上根據(jù)疾病特點(diǎn)可將糖尿病分為兩型。
1型糖尿病好發(fā)于中青年人,患者體型消瘦,存在絕對(duì)胰島素抵抗,有典型的“三多一少”癥狀。2型糖尿病好發(fā)于中老年人,患者體脂含量高,存在相對(duì)胰島素抵抗,起病緩慢,臨床癥狀隱匿不典型。糖尿病的發(fā)病機(jī)制復(fù)雜多樣,常由于自身抗體的出現(xiàn)而導(dǎo)致發(fā)病率高。
1型糖尿病的發(fā)病機(jī)制:兩大核心觀點(diǎn)概述
一、自身免疫攻擊導(dǎo)致胰島β細(xì)胞選擇性破壞:1型糖尿病的核心病理特征是胰島β細(xì)胞的進(jìn)行性凋亡與功能喪失,本質(zhì)是免疫系統(tǒng)對(duì)自身β細(xì)胞的錯(cuò)誤攻擊,具體機(jī)制包括:
- 免疫細(xì)胞異常活化:遺傳易感個(gè)體中,抗原呈遞細(xì)胞(如樹(shù)突狀細(xì)胞)錯(cuò)誤識(shí)別β細(xì)胞表面抗原(如胰島素原、谷氨酸脫羧酶 GAD65),將其呈遞給 CD4?輔助性T細(xì)胞(Th1/Th17)和 CD8?細(xì)胞毒性 T 細(xì)胞,觸發(fā)特異性免疫反應(yīng)。活化的T細(xì)胞遷移至胰島,分泌干擾素-γ(IFN-γ)、腫瘤壞死因子 -α(TNF-α)等促炎細(xì)胞因子,誘導(dǎo)β細(xì)胞表達(dá)主要組織相容性復(fù)合體(MHC-I/II),進(jìn)一步加劇自身識(shí)別和攻擊。
- 自身抗體的協(xié)同作用:B細(xì)胞產(chǎn)生針對(duì)β細(xì)胞的自身抗體(如胰島素抗體 IAA、GAD 抗體、IA-2 抗體),通過(guò)補(bǔ)體依賴(lài)的細(xì)胞毒性作用或抗體介導(dǎo)的細(xì)胞吞噬,直接損傷β細(xì)胞。同時(shí),抗體與抗原形成的免疫復(fù)合物激活固有免疫細(xì)胞(如巨噬細(xì)胞、自然殺傷細(xì)胞),釋放活性氧(ROS)和炎癥介質(zhì),加速β細(xì)胞凋亡。
- β細(xì)胞的免疫原性暴露:病毒感染、氧化應(yīng)激或代謝紊亂可導(dǎo)致β細(xì)胞內(nèi)質(zhì)網(wǎng)應(yīng)激,釋放熱休克蛋白(HSP)、未折疊蛋白等 “危險(xiǎn)信號(hào)”,激活固有免疫受體(如 TLR3/TLR7),打破免疫耐受,將β細(xì)胞標(biāo)記為 “非己” 靶標(biāo)。
二、遺傳易感性與環(huán)境因素的交互致病作用:1型糖尿病是遺傳背景與環(huán)境觸發(fā)因素共同作用的結(jié)果,二者通過(guò)復(fù)雜機(jī)制協(xié)同破壞β細(xì)胞功能:
遺傳風(fēng)險(xiǎn)因素:人類(lèi)白細(xì)胞抗原(HLA)基因(尤其是 HLA-DQ 和 HLA-DR 位點(diǎn))貢獻(xiàn)約 40%-50% 的遺傳易感性,其編碼的 MHC 分子影響抗原呈遞效率和 T 細(xì)胞識(shí)別閾值。非 HLA 基因(如 IL-2 受體 α 鏈基因IL2RA、蛋白酪氨酸磷酸酶基因PTPN22)則通過(guò)調(diào)控免疫細(xì)胞活化、凋亡或β細(xì)胞功能,進(jìn)一步放大風(fēng)險(xiǎn)。
環(huán)境觸發(fā)因素:
- 病毒感染:柯薩奇 B 病毒、腮腺炎病毒、風(fēng)疹病毒等通過(guò)直接感染β細(xì)胞(破壞細(xì)胞結(jié)構(gòu))或模擬β細(xì)胞抗原(分子模擬),誘發(fā)交叉免疫反應(yīng);
- 早期營(yíng)養(yǎng)與腸道菌群:嬰兒期過(guò)早接觸牛乳蛋白、維生素D缺乏或腸道菌群失調(diào)(如普氏菌屬減少、促炎菌增多),可能通過(guò)調(diào)節(jié)腸道黏膜免疫屏障,誘導(dǎo)系統(tǒng)性炎癥或自身免疫傾向;
- 表觀遺傳修飾:環(huán)境因素(如高糖、高脂飲食)通過(guò) DNA 甲基化、組蛋白修飾等方式,調(diào)控 β 細(xì)胞關(guān)鍵基因(如INS、PDX-1)和免疫相關(guān)基因(如CTLA-4)的表達(dá),在遺傳易感基礎(chǔ)上加速 β 細(xì)胞功能衰退。
干細(xì)胞移植治療1型糖尿病的臨床案例
目前,糖尿病的治療主要依靠胰島素注射和飲食干預(yù),尚無(wú)徹底治愈糖尿病的最佳方法。隨著科技的發(fā)展和細(xì)胞治療在糖尿病中的廣泛應(yīng)用,胰島移植是一種常見(jiàn)的治療方法,但由于個(gè)體差異等因素,確定合適的胰腺細(xì)胞譜系候選人仍存在爭(zhēng)議。然而,胰島細(xì)胞移植可以恢復(fù)胰島細(xì)胞對(duì)胰島素和胰高血糖素的調(diào)節(jié),因此是一種安全有效的治療方法。目前,研究人員主要利用干細(xì)胞的多能分化潛能來(lái)產(chǎn)生可再生細(xì)胞用于胰島替代供應(yīng),從而解決移植胰島細(xì)胞短缺的問(wèn)題。
總體而言,這種方法主要涉及多能干細(xì)胞功能的兩個(gè)方面:一是其分化治療作用,二是其外泌體(MSC-Exo)作用。來(lái)自人類(lèi)的多能干細(xì)胞通常可以作為糖尿病移植治療的來(lái)源,主要是通過(guò)衍生的胰腺祖細(xì)胞的作用,其可以產(chǎn)生單一激素胰島素分泌細(xì)胞來(lái)解決糖尿病患者胰島素缺乏的問(wèn)題。這樣,可以誘導(dǎo)多能干細(xì)胞在患者體內(nèi)分化,也可以在體外誘導(dǎo)分化,然后移植到患者體內(nèi)進(jìn)行治療。
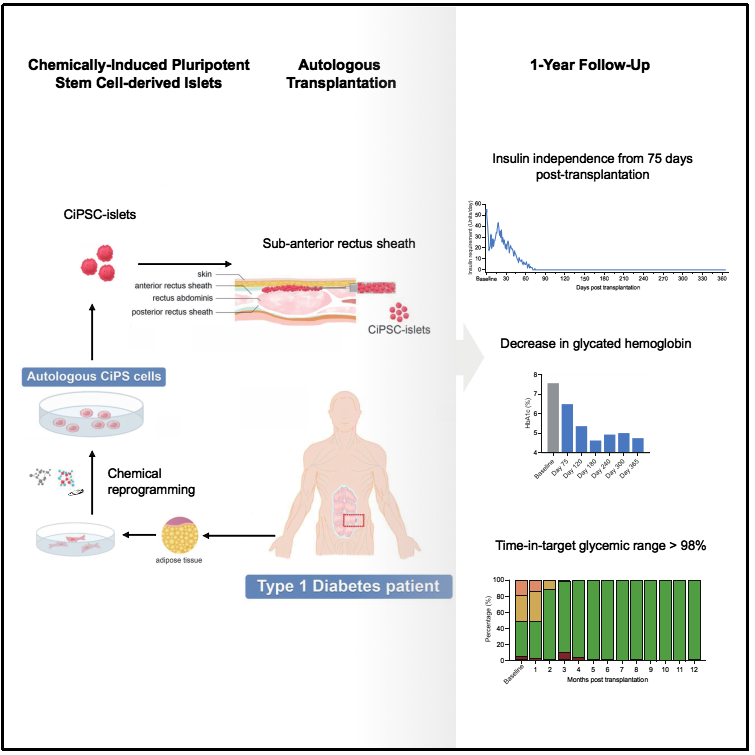
2024年9月25日,天津市第一中心醫(yī)院沈中陽(yáng)、王樹(shù)森研究組聯(lián)合北京大學(xué)昌平實(shí)驗(yàn)室鄧宏魁研究組在Cell發(fā)表題為“Transplantation of Chemically Induced Pluripotent Stem-Cell-Derived Islet Under Abdominal Anterior Rectus Sheath in a Type 1 Diabetes Patient”的研究論文,在國(guó)際上首次報(bào)道了利用化學(xué)重編程誘導(dǎo)多能干細(xì)胞制備的胰島細(xì)胞移植,治療1型糖尿病的臨床研究。

首位患者在移植后恢復(fù)了內(nèi)源自主性、生理性的血糖調(diào)控,移植75天后完全穩(wěn)定地脫離胰島素注射治療,目前療效已穩(wěn)定持續(xù)1年以上(圖1)。該研究初步證明化學(xué)重編程多能干細(xì)胞制備的胰島細(xì)胞療法安全有效,實(shí)現(xiàn)了1型糖尿病的臨床功能性治愈。
2025年4月14號(hào),日本一家醫(yī)院表示,已完成一項(xiàng)臨床試驗(yàn),通過(guò)移植可產(chǎn)生胰島素的誘導(dǎo)多能干細(xì)胞來(lái)治療1型糖尿病患者,此舉可減輕患者每日注射胰島素的負(fù)擔(dān)。

京都醫(yī)院于2025年4月14日在京都舉行新聞發(fā)布會(huì)。
首例患者于今年2月接受了手術(shù),醫(yī)生將由iPS細(xì)胞分化培養(yǎng)的胰島細(xì)胞薄片移植至腹部皮下,以驗(yàn)證該療法對(duì)胰腺功能受損的1型糖尿病患者的安全性。目前患者恢復(fù)良好,已出院并進(jìn)入為期五年的長(zhǎng)期監(jiān)測(cè)階段。
干細(xì)胞與其他自身免疫性疾病
干細(xì)胞治療強(qiáng)直性脊柱炎
強(qiáng)直性脊柱炎 (AS) 是另一種常見(jiàn)的自身免疫性疾病。AS病變中過(guò)量的IgG抗體可誘導(dǎo)補(bǔ)體介導(dǎo)和免疫細(xì)胞介導(dǎo)的細(xì)胞毒作用,導(dǎo)致病變發(fā)生。AS的病理改變與HLA-B27密切相關(guān)。特別是異常的HLA-B27同型二聚體在 AS 的發(fā)病機(jī)制中發(fā)揮作用。這些已知病因是否與干細(xì)胞發(fā)育和分化異常有關(guān)仍不清楚,有待確定。盡管如此,已有研究報(bào)告了如何利用干細(xì)胞移植治療該疾病。
最近,一項(xiàng)研究報(bào)告稱(chēng),一名75歲的女性強(qiáng)直性脊柱炎患者,在使用來(lái)那度胺、硼替佐米和地塞米松方案誘導(dǎo)緩解失敗后,先接受了卡非佐米治療,隨后又接受了自體造血干細(xì)胞移植。移植兩年后,患者的癥狀持續(xù)緩解,且病理未復(fù)發(fā)。因此,該研究表明干細(xì)胞移植可能在緩解強(qiáng)直性脊柱炎癥狀方面發(fā)揮作用。然而,由于此類(lèi)研究數(shù)量較少,需要進(jìn)行更多基礎(chǔ)實(shí)驗(yàn)來(lái)確定是否可以通過(guò)干細(xì)胞治愈強(qiáng)直性脊柱炎。
干細(xì)胞治療自身免疫性溶血性貧血
自身免疫性溶血性貧血是一種以自身免疫性溶血為特征的疾病。人臍帶間充質(zhì)干細(xì)胞移植后,Tregs與Bregs的比例升高,患者體內(nèi)免疫細(xì)胞亞群的數(shù)量發(fā)生改變,從而達(dá)到治療效果。干細(xì)胞治療后,干燥綜合征患者體內(nèi)抗炎細(xì)胞因子顯著升高,促炎細(xì)胞因子水平降低,口干眼干癥狀得到較大緩解,但其治療機(jī)制尚不明確。
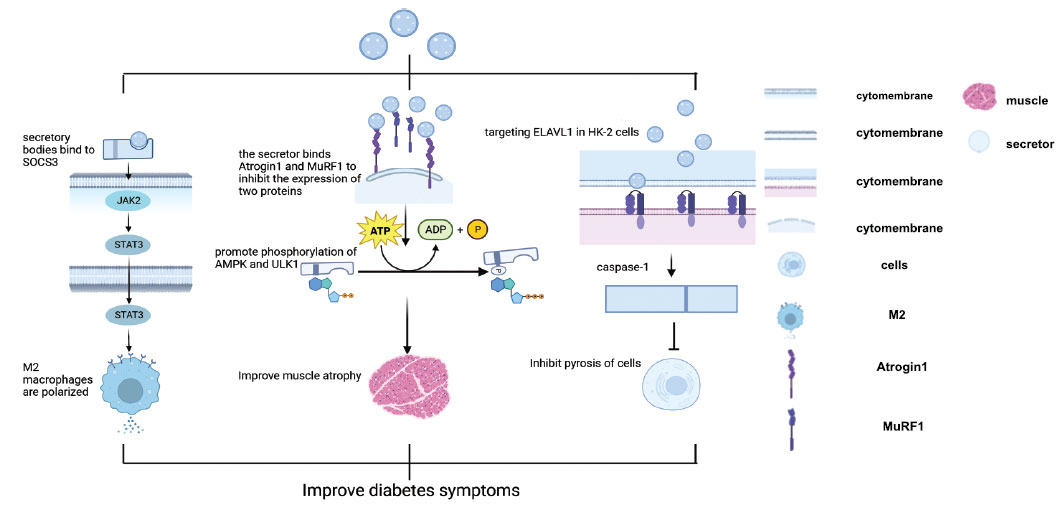
目前,干細(xì)胞治療自身免疫性疾病的能力部分源于其能夠在損傷部位分化為正常細(xì)胞,并進(jìn)行生命周期活動(dòng)以取代功能失調(diào)的細(xì)胞。同時(shí),靶向性可以更準(zhǔn)確地將細(xì)胞運(yùn)送到身體所需的部位,提高干細(xì)胞作用的效率。另一方面,干細(xì)胞分泌的外泌體可以通過(guò)體內(nèi)不同的代謝途徑改善患者的癥狀,越來(lái)越多的證據(jù)表明,干細(xì)胞的治療效果主要通過(guò)外泌體產(chǎn)生。例如,來(lái)自牙髓干細(xì)胞的外泌體可能通過(guò)ROS–MAPK–NF-κB P1信號(hào)通路抑制脊髓損傷中M65巨噬細(xì)胞的極化。滑膜間充質(zhì)干細(xì)胞來(lái)源的外泌體可用于軟骨形成和再生。
間充質(zhì)干細(xì)胞來(lái)源的外泌體通過(guò)抑制 miR-141-3p/PTEN/AKT 通路促進(jìn)肝星狀細(xì)胞活化。干細(xì)胞的免疫調(diào)節(jié)作用可以幫助患者重建免疫系統(tǒng),恢復(fù)自身的免疫應(yīng)答能力,在炎癥和感染的治療中發(fā)揮重要作用。此外,利用化學(xué)重編程將體細(xì)胞轉(zhuǎn)化為干細(xì)胞,擴(kuò)大了干細(xì)胞來(lái)源,為干細(xì)胞的生成和功能提供了新的途徑。
以上案例表明,干細(xì)胞已成為治療自身免疫性疾病可靠有效的方法,而Th17/Treg比例是干細(xì)胞調(diào)節(jié)自身免疫的重要方式,也是治療自身免疫性疾病的重要途徑,值得進(jìn)一步探索。但與此同時(shí),干細(xì)胞治療引起的移植排斥等不良后果也值得進(jìn)一步關(guān)注,只有這樣,才能更好地發(fā)揮干細(xì)胞潛在的治療能力。
結(jié)論
自身免疫性疾病(AID)在全球人群中發(fā)病率較高。由于目前尚無(wú)針對(duì)各類(lèi)AID的特效治療方案,這給艾滋病患者帶來(lái)了沉重的經(jīng)濟(jì)負(fù)擔(dān)和心理負(fù)擔(dān)。因此,尋找新的有效治療方法仍然是臨床迫切需要。干細(xì)胞研究已發(fā)展成為一個(gè)可能為多種AID治療提供新方法的領(lǐng)域。事實(shí)上,一些典型的AID,例如系統(tǒng)性紅斑狼瘡(SLE)、潰瘍性結(jié)腸炎(UC)和糖尿病(DM),已被證明在接受干細(xì)胞移植治療后,病情均有不同程度的緩解(表1)。
基于干細(xì)胞強(qiáng)大的自我更新和分化能力,其在后續(xù)的基礎(chǔ)研究中將得到更廣泛的發(fā)展。然而,由于免疫排斥和倫理要求,干細(xì)胞在臨床上的實(shí)際應(yīng)用受到一定限制,這是科研人員在干細(xì)胞應(yīng)用過(guò)程中需要面對(duì)的實(shí)際問(wèn)題,也是一個(gè)難以解決的難題。顯然,干細(xì)胞具備在體內(nèi)和體外定向分化的能力,這一功能及其靶向運(yùn)輸?shù)淖饔每梢蕴岣吒杉?xì)胞治療的效率,而這正是科研人員利用干細(xì)胞治療疾病的最終目標(biāo)。
外泌體能夠?qū)⒏杉?xì)胞的部分內(nèi)容物運(yùn)送到靶細(xì)胞內(nèi)釋放并發(fā)揮其功能,然而分泌體的分離以及如何使外泌體在患者體內(nèi)長(zhǎng)期發(fā)揮作用而不被代謝是外泌體應(yīng)用于臨床治療的關(guān)鍵。目前,為了更好地發(fā)揮外泌體的作用,研究人員從干細(xì)胞中分離外泌體,并將其與復(fù)合材料結(jié)合,從而在一定程度上避免了外泌體在體內(nèi)的早期代謝。
未來(lái)發(fā)展的新方向是明確外泌體治療的靶向途徑,并解決其代謝問(wèn)題。顯然,隨著干細(xì)胞研究的深入,這些問(wèn)題必將得到妥善解決,干細(xì)胞也必將在自身免疫性疾病的治療中發(fā)揮更大的作用。
參考資料:干細(xì)胞及其分泌的外泌體治療自身免疫性疾病的機(jī)制 |邊沁科學(xué) (eurekaselect.com)
免責(zé)說(shuō)明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專(zhuān)業(yè)建議。如有版權(quán)等疑問(wèn),請(qǐng)隨時(shí)聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信