如今,研究人員和臨床醫生面臨著巨大的壓力,需要開發能夠逆轉或顯著影響疾病進展的療法。近年來,細胞和基因治療行業的出現為各種危及生命的疾病以及傷害、退行性疾病、遺傳性疾病和癌癥提供了變革性、持久性和潛在治愈性結果的可能性。
細胞療法是利用活細胞治療或治愈疾病。它既可以涉及天然(未經改造)細胞,也可以涉及工程化或基因編輯細胞。它還包括活細胞分泌的外泌體和細胞外囊泡。
基因治療是將功能性基因插入細胞以替代有缺陷的基因,以治療遺傳疾病。通常,病毒經過基因改造以攜帶治療基因并將其遞送到患者體內的細胞中。當治療成功時,載體遞送的新基因會產生功能性蛋白質。進行基因治療有多種技術,包括基因增強療法、基因抑制療法和自殺基因插入以及其他方法。
當然,CAR-T細胞療法是基因編輯細胞療法,因此它們屬于這兩類。
FDA批準的細胞和基因療法
以下是美國FDA下屬組織和先進療法辦公室 (OTAT) 批準的所有已知細胞和基因治療產品列表。目前,美國已批準43種細胞和基因療法。迄今為止,尚無任何外泌體療法獲得FDA批準,盡管臨床試驗管道看起來很有希望。
目前,這些產品中最大的部分是臍帶血衍生物。這些產品占目前批準的43個細胞和基因治療批準中的9個(20.1%)。目前,FDA批準的所有臍帶血療法都是細胞療法。
CAR-T細胞療法是第二大細分市場,占43個獲批藥物中的7個(16.3%)。美國獲批的CAR-T細胞療法包括:Abcema、Aucatzyl、Breyanzi、Carvykti、Kymriah、Tecartus和Yescarta(按字母順序排列)。
除了這兩類之外,還有15種非CAR-T細胞療法的基因療法和12種非臍帶血衍生療法的細胞療法。
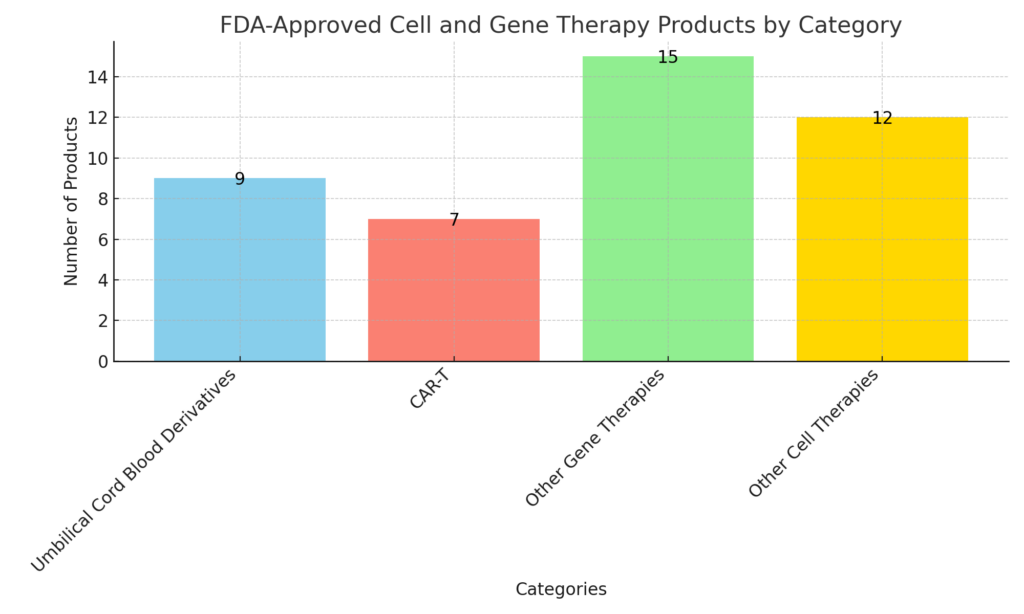
美國FDA批準的細胞和基因療法(按類別)
對于每種產品,以下列表列出了其品牌名稱、臨床名稱、開發公司以及重要的批準年份。此列表中最近批準的產品是Mesoblast, Inc.的RYONCIL (remestemcel-L)和Humacyte Global, Inc.的SYMVESS。

Ryoncil于2024年12月18日獲得FDA批準,用于治療患有類固醇難治性急性移植物抗宿主病 (SR-aGVHD) 的2個月及以上的兒科患者。而SYMVESS于2024年12月19日獲得FDA批準,用于在成人肢體動脈損傷且需要緊急血運重建以避免即將發生的肢體損失且自體靜脈移植不可行時用作血管導管。

1、臍帶血衍生物
- ALLOCORD(HPC、臍帶血)–SSM Cardinal Glennon兒童醫療中心–2011年
- CLEVECORD(HPC 臍帶血)–克利夫蘭臍帶血中心–2016年
- Ducord(HPC 臍帶血)– 杜克大學醫學院–2008年
- HEMACORD(HPC,臍帶血)– 紐約血液中心–2012年
- HPC,臍帶血 -Clinimmune 實驗室,科羅拉多大學臍帶血庫-2007年
- HPC,臍帶血 -MD Anderson 臍帶血庫-2008年
- HPC,臍帶血 –LifeSouth 社區血液中心,Inc.–2008年
- HPC,臍帶血 –Bloodworks–2010
- REGENECYTE(HPC、臍帶血)– StemCyte, Inc.–2008年
2、CAR-T
- ABECMA(idecabtagene vicleucel)– Celgene Corporation(百時美施貴寶旗下公司)–2021年
- AUCATZYL(obecabtagene autoleucel)– Autolus Limited–2024 年
- BREYANZI(lisocabtagene maraleucel)– Juno Therapeutics, Inc.(百時美施貴寶旗下公司)–2021年
- CARVYKTI(ciltacabtagene autoleucel)– Janssen Biotech, Inc. –2022年
- KYMRIAH (tisagenlecleucel) – 諾華制藥公司–2017年
- TECARTUS (brexucabtagene autoleucel) – Kite Pharma–2020
- YESCARTA(axicabtagene ciloleucel)– Kite Pharma–2017年
3、其他基因療法
- ADSTILADRIN(nadofaragenefiradenovec-vcng)–Ferring Pharmaceuticals A/S –?2022
- BEQVEZ(fidanacogene elaparvovec-dzkt)——輝瑞——2023年
- CASGEVY(exagamglogene autotemcel [exa-cel])–Vertex Pharmaceuticals–2023年
- ELEVIDYS(delandistrogene moxeparvovec-rokl)–Sarapeta Therapeutics –?2023年
- HEMGENIX (etranacogene dezaparvovec-drlb) –CSL Behring–?2022
- IMLYGIC(talimogene laherparepvec)——BioVex, Inc.,安進公司子公司——2015年
- KEBILIDI (eladocagene exuparvovec-tneq) –PTC Therapeutics–2023
- LENMELDY(atidarsagene autotemcel)–Orchard Therapeutics(歐洲)有限公司–2022年
- LUXTURNA(voretigene neparvovec-rzyl)–Spark Therapeutics –?2017
- LYFGENIA(lovotibeglogene autotemcel [lovo-cel])–bluebird bio –?2023年
- ROCTAVIAN(valoctocogene roxaparvovec-rvox)–BioMarin Pharmaceutical–2022
- SKYSONA(elivaldogene autotemcel)– bluebird bio –?2022
- VYJUVEK (beremagene geperpavec) – Krystal Biotech–2023
- ZYNTEGLO(betibeglogene autotemcel) – bluebird bio–2022
- ZOLGENSMA(onasemnogene abeparvovec-xioi) –諾華基因療法–2019年
4、其他細胞療法
- AMTAGVI (lifileucel) – Iovance Biotherapeutics–2023
- GINTUIT(牛膠原蛋白中的同種異體培養角質形成細胞和成纖維細胞) – 器官發生–2012
- LANTIDRA (donislecel) – CellTrans–2023
- LAVIV (Azficel-T) – Fibrocell Technologies–2011
- MACI(豬膠原膜上的自體培養軟骨細胞)– Vericel Corp–2016年
- OMISIRGE (omidubicel-onlv) – Gamida Cell–2023
- PROVENGE (sipuleucel-T) – Dendreon–2010
- RETHYMIC(同種異體處理胸腺組織-agdc)– Enzyvant Therapeutics GmbH –2021
- RYONCIL (remestemcel-L-rknd) –Mesoblast–2024
- STRATAGRAFT(小鼠膠原蛋白-dsat 中的同種異體培養角質形成細胞和真皮成纖維細胞)– Stratatech Corporation–2021
- SYMVESS(脫細胞組織工程血管類型)——Humacyte Global, Inc.——2024年
- TECELRA(afamitrisgene autoleucel)——Adaptimmune——?2024年
細胞和基因治療獲批情況(按年份)
接下來,讓我們按年份統計一下這些批準。具體情況如下:
- 2007?: 1 (HPC, 臍帶血 – Clinimmune實驗室)
- 2008年:4(Ducord、HPC、臍帶血–MD Anderson、HPC、臍帶血– LifeSouth、Regenecyte)
- 2010 年:2 (HPC、臍帶血-西北血庫、普羅文奇)
- 2011:2(Allocord、Laviv)
- 2012:2 (Hemacord、Gintuit)
- 2015:1(Imlygic)
- 2016:2 (Clevecord, Maci)
- 2017:3(Kymriah、Yescarta、Luxturna)
- 2019:1(Zolgensma)
- 2020:2(Tecartus,Ryoncil)
- 2021:4(Abecma、Breyanzi、Strataraft、Rethymic)
- 2022:6 (Carvykti、Adstiladrin、Hemgenix、Lenmeldy、Roctavian、Skysona)
- 2023年:6(Casgevy、Elevidys、Lyfgenia、Vyjuvek、Lantidra、Omisirge)
- 2024年:7(Amtagvi, Aucatzyl, Beqvez, Kebilidi, Ryoncil, Symvess, Tecelra)
有趣的是,從2022年開始,這些批準開始增加到每年大約六個。在過去三年中,這一數字保持相對穩定,2022年、2023年和2024年每年批準的分別為6個、6個和7個。
總結:隨著醫學科技的飛速發展,美國FDA批準的細胞和基因治療產品正不斷拓展著人類對抗疾病的邊界。從罕見病的突破到癌癥治療領域的曙光初現,這些創新療法為無數患者帶來了新的希望。
展望未來,我們有理由相信,在科研人員的不懈努力與監管機構的嚴格把控下,細胞和基因治療領域將繼續蓬勃發展,開發出更多安全有效的療法,攻克更多疑難雜癥,為全球患者的健康福祉譜寫更加輝煌的篇章。
內容來源:BIO,美國FDA網站
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信