糖尿病是一種普遍存在的全球健康挑戰,對社會和經濟福祉產生重大影響。胰島移植越來越多地被認為是一種可行的1型糖尿病治療方法,旨在恢復內源性胰島素的產生并減輕與外源性胰島素依賴相關的并發癥。
FDA批準了首個源自已故捐獻者的同種異體胰腺胰島細胞治療產品Lantidra,標志著胰島移植的一項重大創新,為盡管接受了強化糖尿病管理但仍與嚴重低血糖作斗爭的T1D患者帶來了新的希望。

這一進展不僅標志著移植技術的突破,而且為無法達到所需糖化血紅蛋白水平的成年T1D患者提供了有效的替代治療。
胰島移植是一種創新治療方法,可為1型糖尿病患者恢復內源性胰島素生成,減少對外源性胰島素的依賴并預防長期并發癥。這種微創方法已顯示出超越傳統治療方法的有效性,一些中心報告稱,五年后超過50%的患者不再依賴胰島素。然而,仍然存在挑戰,包括供體細胞稀缺、移植后因血液介導的即時炎癥反應、缺氧和缺血-再灌注損傷而導致的大量細胞損失,以及免疫抑制劑的并發癥。因此,實現最佳血糖控制通常需要多次移植。

推進糖尿病治療:間充質干細胞在胰島移植中的作用
再生醫學領域的最新進展已將間充質干細胞 (MSC) 確定為克服這些障礙的關鍵因素。由于具有多能性、免疫調節特性和低免疫原性,來自骨髓、脂肪組織和臍帶血的MSC已證實具有提高胰島移植物存活率、調節免疫反應以及促進組織修復和血管生成的潛力。
它們能夠分化成不同類型的細胞(例如產生胰島素的細胞)并分泌大量再生因子,這證明了這一點,使其成為與胰島聯合移植的有希望的候選者。MSC的免疫調節特性對于調節免疫反應和促進組織修復至關重要,這一點已得到廣泛證實,表明移植排斥風險顯著降低。
此外,MSCs的治療多功能性已在多種疾病環境中得到探索,包括心血管疾病和肝損傷,進一步證明了其在再生醫學領域的廣泛潛力。
這篇綜述不僅強調了間充質干細胞通過胰島移植增強糖尿病治療的潛力,而且還解決了持續存在的挑戰,例如間充質干細胞異質性和治療優化的需要。這一發現強調了人工智能和scRNA-seq等先進方法克服這些障礙的前景,表明MSC療法可以在未來提供更有效、個性化的糖尿病治療解決方案。
間充質干細胞的背景
間充質干細胞的治療分子和機制
間充質干細胞源自骨髓、脂肪組織、臍帶和牙齦,由于其獨特的分化能力,能夠分化為組織修復和再生所必需的多種細胞類型,因此在再生醫學中發揮著至關重要的作用。
MSC具有顯著的免疫調節作用,通過分泌具有免疫抑制和抗炎特性的生物活性因子影響先天性和適應性免疫系統,這凸顯了它們的重要性。這些細胞可以分化成各種不同的細胞類型也很重要,特別是在通過支持移植物存活、調節免疫反應和促進組織修復和血管生成來解決T1D和增強胰島移植結果時。
MSC衍生的細胞外囊泡 (EV):拓寬治療前景
MSC衍生的EV的潛力不僅限于糖尿病,還包括缺血性中風和骨關節炎等疾病,這證明了MSC的廣泛應用。臨床研究已證實MSC具有進化為胰島素生成細胞和分泌愈合因子的能力,使它們成為T1D治療的關鍵參與者。
間充質干細胞改善胰島移植結果
在用于治療糖尿病的胰島移植中,MSC發揮著至關重要的作用,可保護胰島細胞并改善同種異體和異種移植的結果。分泌的多種分子(包括生長因子和免疫調節劑)有助于提高移植效果和存活率。在再生過程中,這些分泌因子促進組織重塑并促進細胞穩態。
MSC的這種多方面作用解決了胰島移植中的關鍵挑戰,包括減少移植排斥和改善移植物性能,從而提高糖尿病治療的效果。此外,MSC在新型治療策略中的潛力標志著糖尿病管理的進步,表明MSC是再生醫學和自身免疫治療的重要組成部分。MSC在通過胰島移植改善糖尿病患者預后方面的作用至關重要,因為它們強調了這些細胞的廣泛治療潛力并為糖尿病護理進步開辟了新途徑。
MSCs在胰島分離和培養過程中的保護作用
它在分離和培養過程中保護胰島活力的能力至關重要,因為它可以減輕缺氧和炎癥應激,而缺氧和炎癥應激是胰島損傷的關鍵因素。將胰島與MSCs共培養不僅可以保留胰島功能,還可以通過維持胰島素分泌和細胞活力來改善移植結果。
MSCs在改善1型糖尿病治療內部微環境中的作用已得到充分研究。MSCs有助于在分離和培養過程中保護胰島活力,并減輕缺氧和炎癥應激,而缺氧和炎癥應激是胰島損傷的關鍵因素。將胰島與MSCs共培養不僅可以保留胰島功能,還可以通過維持胰島素分泌和細胞活力來改善移植結果。
通過MSC驅動的免疫調節和血管生成增強胰島移植
MSC可以改善胰島移植后的內部微環境,減少炎癥并改善患者的預后。這些細胞在移植后減輕血液介導的炎癥反應的能力對于T1D患者走向胰島素獨立性至關重要。通過減輕移植相關的應激和減少β細胞損傷,間充質干細胞發揮著關鍵作用。此外,可溶性免疫調節因子的分泌至關重要地抑制免疫排斥,促進移植物耐受。
MSCs在胰島移植中的協同作用是多方面的,不僅強調了它們的抗炎作用,而且強調了它們對血管生成的關鍵貢獻。分離后,胰島會發生血管化損失,增加對應激源的敏感性,例如即時血液介導的免疫反應、缺氧和缺血-再灌注損傷,這會導致細胞凋亡和壞死。MSCs促進快速血管重建;分泌VEGF、Ang-1、bFGF 、KGF、IGF-1、IGF-2和HGF等因子;對血管生成和增強胰島移植物存活率和功能至關重要。MSC 可通過激活AKT/MAPK信號轉導和上調VEGFR信號轉導來促進血管生成。
間充質干細胞治療糖尿病的臨床應用
2021年10月18日,生物科技巨頭Vertex宣布:他們利用同種異體干細胞衍生出的胰島β細胞(VX-880療法),對一位遭受Ⅰ型糖尿病折磨有40年之久的患者進行了治療,在移植270天后,這名原本“胰島失靈”的患者已經完全停止了胰島素的使用。

2021年,南京市鼓樓醫院內分泌科朱大龍教授團隊,在Stem Cell Research & Therapy發表了《臍帶間充質干細胞在1型糖尿病重復移植:一項開放、非隨機、平行對照臨床試驗》。

53例(成人33,青少年20) 1型糖尿病(T1DM)患者參與該研究。MSCs組27例接受治療,對照組26例。MSCs組劑量,1×106/kg,靜脈輸注2次,間隔3個月。
隨訪1年,11名(11/27,40.7%)MSCs受試者組的達到臨床緩解,顯著高于對照組(3/26,11.5%)。其中3名MSCs治療的成年人實現不依賴胰島素,并在3-12個月內保持不使用胰島素,而對照組沒有。MSCs無嚴重不良反應。研究提示,對于新發T1DM患者,重復1次注射MSCs是安全的,可能有利于保護胰島β細胞的功能。
2023年10月03日,波士頓,Vertex制藥公司(納斯達克股票代碼:VRTX)今天公布了VX-8801/2期臨床試驗A和B部分患者的長期數據,VX-880是一種研究性干細胞來源的完全分化胰島細胞,用于治療患有低血糖意識受損和嚴重低血糖事件(SHEs)的1型糖尿病(T1D)患者。
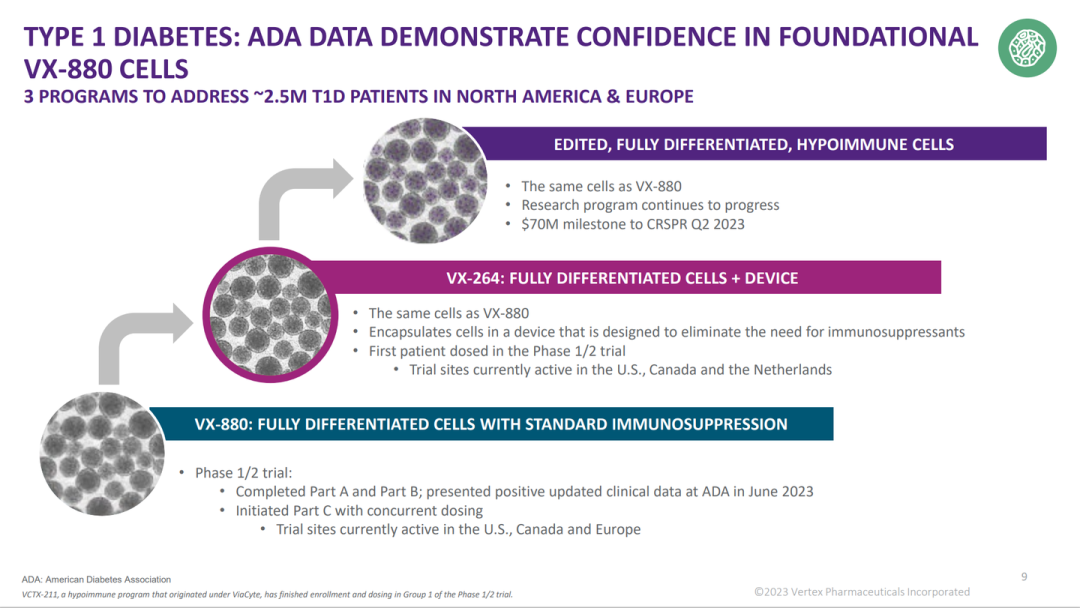
在VX-880治療之前,所有入組的6名患者均患有長期T1D,無內源性胰島素分泌,平均每天需要34.0單位胰島素,并且在篩查前一年有復發性嚴重低血糖事件(SHEs)史。
A部分和B部分的所有患者現在都有超過90天的隨訪,并在第90天的混合膳食耐量試驗(MMTT)中顯示出胰島細胞植入和內源性葡萄糖反應性胰島素產生。
所有患者的血糖控制均得到改善,包括HbA1c降低,持續胰島素監測的時間范圍改善,外源性胰島素使用減少或消除。
這兩名患者在VX-880輸注后至少隨訪了12個月,因此可以評估該研究的主要療效終點,在第90天至第12個月期間,HbA1c<7.0%,滿足SHEs消除的主要終點標準。
- 第一位患者在第270天至第24個月期間擺脫了胰島素。這是一個患有T1D近42年的患者,在試驗入組之前,每天使用34單位的外源性胰島素。
- 第二名患者在第180天至第12個月期間擺脫胰島素。這是一個患有T1D 19年的患者,在試驗入組之前,每天使用45.1單位的外源性胰島素。從第15個月開始,根據研究者的判斷,該患者開始每天使用4個單位的基礎胰島素。在數據截止日期之后,第三名患者在180天實現擺脫胰島素。
迄今為止,VX-880在所有患者中均具有良好的耐受性。大多數不良事件(AE)為輕度或中度,無與VX-880治療相關的嚴重AE。如既往報道,1例患者圍手術期出現SHEs。研究中沒有其他的SHEs 。
多倫多大學外科醫學博士Trevor Reichman說:“我們繼續對VX-880項目的令人印象深刻的數據感到驚訝,因為所有接受治療的患者在所有血糖測量方面都有所改善。”
“這代表了一種非常有前途的研究性療法,具有深遠的潛力。”
近日,在我國,在獲得國家衛生健康委干細胞臨床研究備案的基礎上,天津市第一中心醫院與北京大學干細胞中心通力合作,成功完成國際首例1型糖尿病受試者化學重編程誘導多潛能干細胞(CiPSC)分化的胰島樣細胞移植手術。

這是我國在干細胞治療糖尿病領域的一個重大突破。
規劃間充質干細胞治療糖尿病的未來
MSC從早期臨床前研究進展到臨床應用,既說明了它們的潛力,也說明了MSC治療的復雜性。盡管取得了進展,但仍存在一些挑戰影響其臨床成功。在糖尿病治療中,尤其是胰島移植,MSC的變異性和適應性需要仔細的臨床評估。
由于MSC的來源、制備方法和遞送技術不同,其變異性對其在治療中的標準化和一致性構成了重大挑戰。為了最大限度地減少異質性并提高結果的可預測性,重要的是探索策略和潛在指南,例如嚴格的細胞表征、統一的培養條件和標準化的遞送方法。
強調全面質量控制和臨床方案標準化的必要性將為推動MSC療法向更可靠、更有效的臨床應用發展提供參考,從而提高其在再生醫學和其他領域的效用。
人工智能和scRNA-seq等創新技術是解決這些障礙的有希望的方法,這表明MSC療法未來可能成為糖尿病的標準、個性化治療選擇(圖1)。
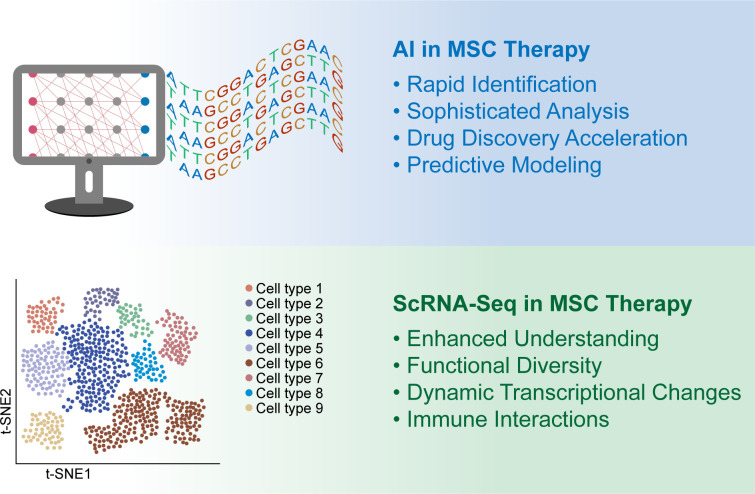
AI在MSC臨床治療中的應用
將人工智能整合到間充質干細胞療法中治療糖尿病是一個不斷發展的領域,結合了兩項尖端科學進步。盡管在糖尿病中的直接應用才剛剛起步,但人工智能的預測能力和間充質干細胞的治療潛力之間的協同作用為更精確和定制的治療提供了有希望的方向。這種跨學科方法旨在通過利用人工智能優化間充質干細胞治療結果來加強糖尿病護理,這表明再生醫學正在朝著更加個性化和有效的治療策略邁進。
在間充質干細胞療法中利用人工智能加速藥物發現
數字技術和人工智能對醫療創新有著重大影響,尤其是在藥物研發領域。人工智能從頭設計生物活性分子的能力有可能提高治療效果。這些技術進步旨在通過提高關鍵分子成分和藥物靶點的識別來改進MSC療法,從而提高藥物開發的精準度。制藥行業與人工智能公司合作開發先進平臺,凸顯了人工智能在簡化藥物發現過程中的作用,需要嚴格的臨床驗證以確保這些創新的有效性和安全性。
利用人工智能增強MSC療法的開發
將人工智能融入MSC治療研究是探索再生醫學詳細前景的方法策略。人工智能分析大量數據的能力提高了識別MSC分子屬性的精確度,這對于旨在修復或再生受糖尿病等疾病影響的組織的再生療法至關重要。
- 人工智能在自動創建治療化合物方面的作用代表了提高再生治療效果的重大進步。
- 人工智能與再生醫學研究之間的這種協同作用有望推動新治療策略的發展,并可能為患有各種慢性疾病的患者帶來重大益處。
ScRNA-seq在MSC治療中的應用
scRNA-seq的出現增強了對MSC的理解和應用。盡管間充質干細胞在再生醫學中具有廣闊的潛力,并且在臨床前模型中取得了成功,但臨床試驗往往達不到預期,部分原因是間充質干細胞的異質性和不一致的鑒定標準。ScRNA-seq通過實現精確的MSC表征和生物標志物識別并揭示MSC亞簇內的基因表達異質性來彌補關鍵差距。這些見解對于理解MSC的功能多樣性及其在發育、再生和病理學中的作用非常寶貴。
此外,scRNA-seq有助于闡明MSC分化過程中的動態轉錄變化以及調節其關鍵功能的復雜信號通路。通過不斷發展的分析方法和與組織學研究的整合,促進了這種精確的理解,有望實現更有針對性的基于間充質干細胞的治療,特別是在糖尿病胰島移植等復雜治療中,有助于個性化和有效的干預。
結論
該綜述強調了間充質干細胞對胰島移植治療糖尿病的重大影響。這一發現強調了間充質干細胞在增強胰島移植物存活、調節免疫反應以及促進血管生成和組織修復方面的作用,表明它們在糖尿病管理中的應用潛力。
MSC異質性等挑戰和治療應用優化的需求是公認的,人工智能和scRNA-seq等先進技術提供了有前景的解決方案。
間充質干細胞和胰島移植之間的協同作用被強調為一種基于間充質干細胞的個性化干預的前瞻性方法,為糖尿病治療策略設定了新方向。
參考資料:Mou L, Wang TB, Wang X, Pu Z. Advancing diabetes treatment: the role of mesenchymal stem cells in islet transplantation. Front Immunol. 2024 Mar 28;15:1389134. doi: 10.3389/fimmu.2024.1389134. PMID: 38605972; PMCID: PMC11007079.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信