近年來,間充質干細胞(Mesenchymal Stem Cells, MSCs)因其多向分化潛能和免疫調節特性,成為腦癱治療領域的重要研究方向。盡管療效研究已取得顯著進展,但安全性始終是臨床應用的核心關注點。
本文將基于多項臨床研究數據,系統分析間充質干細胞治療腦癱的安全性證據、潛在風險及未來優化方向,為醫學界和腦癱患者家庭提供科學參考。

間充質干細胞治療腦癱安全嗎?22例患者5年隨訪揭示長期安全性
案例1:間充質干細胞治療腦癱患者5年長期安全性
2015年,湖北三甲醫院在國際期刊《全球兒科健康》上發表過一篇關于《人臍血間充質干細胞移植聯合基礎康復治療治療腦癱一例》的臨床研究成果,并進行了長達5年的長期隨訪記錄。

本報告介紹了一例人臍帶間充質干細胞(hUCB-MSCs)移植聯合基本康復治療腦癱兒童的病例,早在6個月大時就開始進行,隨訪時間長達5年。
安全性結果:在治療期間及5年隨訪期間未觀察到不良反應或并發癥。體格檢查和生命體征正常。此外,所有實驗室檢查結果均在正常范圍內。移植后5年內,MRI檢查未發現腦腫瘤征兆。
案例2:間充質干細胞鞘內注射治療腦癱患者的安全性
2021年,伊朗德黑蘭科研人員在行業期刊《干細胞研究與治療》上發表了一篇關于《臍帶組織間充質干細胞鞘內注射治療腦癱的臨床及影像學結果:一項隨機雙盲假手術對照臨床試驗》的研究成果。本研究評估了臍帶組織間充質干細胞(UCT-MSC)鞘內注射治療患有痙攣性腦性癱瘓的安全性和有效性。

總體情況:共記錄5例不良事件,均發生于鞘內細胞注射后24小時內,且全部自行緩解,未引發嚴重不良反應(SAE)。
UCT-MSC組中有2例(2/36或5.5%)在鞘內細胞注射后24小時內出現發燒(38至38.7oC),但自行緩解,且未診斷出感染(例如腦膜炎)。輕度至中度煩躁、頭痛;腰痛;嘔吐是術后24小時內報告的其他不良事件,干細胞治療組和對照組均有發生。
結論:所有癥狀均為輕度且無需干預,隨訪期間未見持續性或嚴重不良事件,表明鞘內注射臍帶間充質干細胞具有良好的安全性。
案例3:多次注射間充質干細胞治療腦癱的安全性
2025年,伊朗德黑蘭科研人員在國際期刊《神經修復學雜志》上發表了一篇關于《反復鞘內注射自體骨髓間充質干細胞治療痙攣性腦癱:單組安全性和初步療效臨床試驗》的臨床研究結果。

本研究對16名2至12歲痙攣型腦性癱瘓(CP)患兒進行了一項前瞻性、單組、開放標簽的I期臨床試驗。患者接受4次鞘內MSC注射,每次間隔一個月。安全性結果發現:
總體情況:16例患者中記錄5例輕度不良事件(I級或II級),均未直接歸因于干細胞治療。(見圖)
具體事件:
- 胃腸道問題:3例(18.75%)報告惡心(I-II級)。
- 全身癥狀:3例(18.75%)出現疲勞(2例)、發熱(1例)(I級)。
- 神經系統癥狀:2例(12.5%)頭痛(I級)。
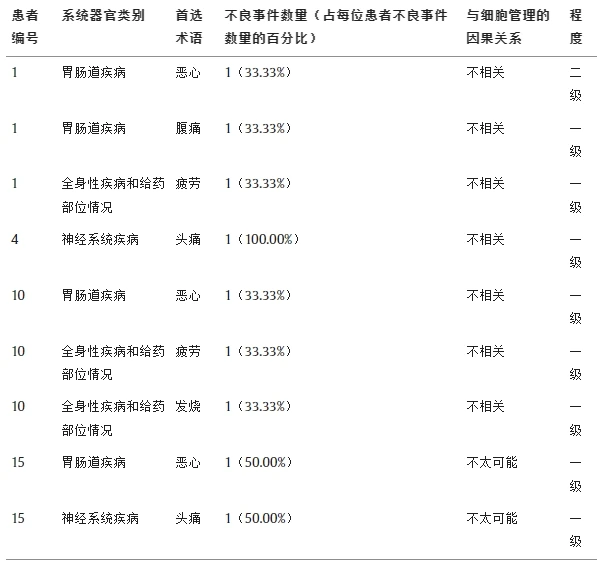
不良事件通用術語標準 (CTCAE) 劃分的不良事件。
結論:所有不良事件均為輕度且與治療無關,表明鞘內重復注射自體骨髓間充質干細胞(hMSC)在痙攣性腦癱患者中具有良好的安全性。
間充質干細胞治療腦癱的安全性總結
綜上所述,間充質干細胞(MSCs)治療腦癱在不同給藥途徑(如靜脈輸注、鞘內注射)和細胞來源(如臍帶、骨髓)中均表現出良好的安全性。短期不良事件多為輕度,如發熱、頭痛、惡心或短暫不適,且無需干預即可自行緩解;長期隨訪(最長5年)未發現腫瘤形成或其他嚴重并發癥。無論是單次治療還是多次重復注射,治療過程中均未觀察到與干細胞移植直接相關的嚴重不良反應,進一步支持其作為腦癱潛在治療方案的安全性基礎,為臨床應用提供了可靠的證據支持。
挑戰與未來方向
標準化制備流程缺失??:當前MSCs培養條件、傳代次數(第4-8代安全性最佳)缺乏統一標準,可能影響批次間一致性。
?長期數據仍需完善??:多數研究隨訪期≤5年,需進一步追蹤青春期及成年后的神經發育與免疫狀態。
聯合治療的安全性評估??:MSCs與康復訓練、抗痙攣藥物聯用可能產生協同效應,但需驗證聯合方案是否增加不良反應風險
結語
現有臨床證據表明,間充質干細胞治療腦癱具有較高的安全性,不良事件以輕微、短暫為主,且無長期腫瘤或功能倒退風險。但是長期安全性仍需大規模隨訪驗證,個體化治療方案和技術創新是未來突破的關鍵。隨著政策支持和技術進步,MSCs有望成為腦癱治療的標準化手段,為全球數百萬患兒提供更安全的康復選擇。
相關閱讀:間充質干細胞治療腦癱療效如何?249例患者告訴你答案
參考資料:
Zhang C, Huang L, Gu J, Zhou X. Therapy for Cerebral Palsy by Human Umbilical Cord Blood Mesenchymal Stem Cells Transplantation Combined With Basic Rehabilitation Treatment: A Case Report. Global Pediatric Health. 2015;2. doi:10.1177/2333794X15574091
Amanat, M., Majmaa, A., Zarrabi, M.?et al.?Clinical and imaging outcomes after intrathecal injection of umbilical cord tissue mesenchymal stem cells in cerebral palsy: a randomized double-blind sham-controlled clinical trial.?Stem Cell Res Ther?12, 439 (2021). https://doi.org/10.1186/s13287-021-02513-4
Mohammadhosein Akhlaghpasand, Maede Hosseinpoor, Bardia Hajikarimloo, Atieh Hajarizadeh, Maryam Golmohammadi, Roozbeh Tavanaei, Ida Mohammadi, Nastaran Ansari Noghlebari, Niloofar MohammadEbrahim, Alireza Zali, Saeed Oraee-Yazdani,Repeated Intrathecal Injections of Autologous Bone Marrow-Derived Mesenchymal Stem Cells for Spastic Cerebral Palsy: Single-Arm Safety and Preliminary Efficacy Clinical Trial,Journal of Neurorestoratology,2025,100207,ISSN 2324-2426,https://doi.org/10.1016/j.jnrt.2025.100207.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信