腎臟疾病的流行正在成為一個公共衛生問題。盡管支持治療取得了重大進展,但患者的死亡率仍然很高。為了尋找刺激腎臟再生的創新療法,基于干細胞的技術被認為是一種潛在有前途的策略。
干細胞在治療腎病中取得哪些進展?未來將面臨哪些挑戰?
干細胞在治療腎臟疾病方面已經取得了顯著的進展,同時也面臨一些挑戰。以下是當前的主要進展和挑戰:
在這里,我們總結了多能和成體干細胞治療在急性和慢性腎損傷實驗模型中的腎臟保護潛力,并探討了干細胞誘導腎臟再生的不同機制。
具體來說,分析了胚胎或誘導多能干細胞以及間充質干細胞和腎前體細胞的細胞植入、并入腎臟結構或旁分泌活性。還討論了將實驗結果轉化為臨床試驗的問題,強調了干細胞治療腎損傷患者的安全性和可行性。
近年來,許多研究試圖確定腎臟修復的潛在機制,以探索腎臟的潛在再生能力。
這項研究的主要目的是確定終末分化細胞是否能夠支持成人腎臟的再生能力、腎臟中是否存在多能祖細胞以及腎外干細胞治療是否有助于腎臟修復,從而有利于腎臟修復。或加速再生過程。
許多論文報道了不同來源的干細胞治療許多不同疾病(包括腎臟疾病)的潛在用途。其功效在不同程度上在急性腎損傷(AKI)和慢性腎臟疾病(CKD)模型中使用不同來源的干細胞的方法已得到實驗證明。
然而,在不久的將來,實驗結果的臨床轉化似乎并不現實,這主要是由于實驗數據缺乏穩健性,而且臨床研究受到結果有限和入組患者數量少的限制。(表1、圖1)。在進入臨床應用之前,仍然必須解決許多問題,包括確定最佳的細胞類型、給藥途徑和時間,以及不同病理條件所需的細胞劑量。
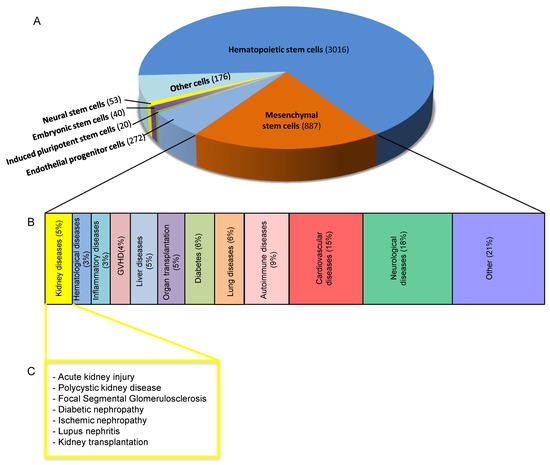
(A) 餅圖顯示使用不同類型干細胞的臨床試驗的相對數量,如美國NIH網站ClinicalTrials.gov所列。(B) 按疾病類型分類的基于MSC的臨床試驗的百分比。(C) 不同腎臟疾病中基于MSC的療法。
| 研究 | 患者數量(隨訪) | MSC(來源、劑量和時間) | 主要結果 | 參考 |
|---|---|---|---|---|
| 急性腎損傷 | ||||
| 托格爾、韋斯特菲爾德和古奇等人。NCT00733876 | 16名接受體外循環心臟手術的患者術后發生AKI的高風險;(16個月) | 同種異體bmMSC(Allocure) 劑量遞增(未指定),即輸注 | 細胞是安全的,可以防止術后早期和晚期腎功能惡化、縮短住院時間和重新入院的需要 | [9 , 10 ] |
| 斯瓦米納坦等人。NCT01602328 | 156例心臟手術后48小時確診AKI的患者;n=77例接受MSC治療,n=79例接受安慰劑治療,(90 天) | 同種異體bmMS(Allocure),單次ia輸注2×106個細胞/kg | MSC輸注安全且耐受性良好。與安慰劑相比,腎功能恢復時間、透析和死亡率沒有差異 | [11] |
| 慢性腎病 | ||||
| 馬赫洛等人。NCT02166489 | 6名常染色體顯性多囊腎病(ADPKD)患者;(12個月) | 自體bmMSC,單次靜脈注射1–2×106個細胞/kg | MSC輸注安全且耐受性良好。eGFR、SCr或腎臟長度無顯著變化 | [12] |
| 貝林蓋里等人。 | 1例腎移植后復發局灶節段性腎小球硬化癥(FSGS)的兒科患者;(22 個月) | 同種異體bmMSC,靜脈注射1×106個細胞/kg/劑,共6劑 | MSC 輸注安全且耐受性良好。并保持穩定的uPr/uCr比值 | [13] |
| 帕克漢姆DK等人。NCT01843387 | 糖尿病腎病(DN)患者30例;n=10較低的bmMPC劑量,n=10較高的bmMPC劑量,n=10 安慰劑;(60 周) | 同種異體bmMPC,單次靜脈注射較低劑量(150×106細胞/患者)或較高劑量(300×106細胞/患者) | bmMPC輸注安全且耐受性良好。bmMPC150×106組eGFR的穩定和改善 | [14] |
| 薩阿德等人。NCT01840540 | 28例患有動脈粥樣硬化性腎血管疾病的患者;n=7較低的adMSC劑量,n=7較高的 adMSC劑量,n=14 安慰劑;(3個月) | 自體adMSCs,單次ia輸注較低劑量 (1×105個細胞/kg)或較高劑量 (2.5×105個細胞/kg) | MSC輸注安全且耐受性良好。皮質灌注和腎血流量增加以及 GFR 穩定 | [15] |
| 狼瘡性腎炎 | ||||
| 孫等人。和梁等人。NTC00698191 | 13例難治性SLE患者;( >12個月) | 同種異體bmMSC,單次靜脈注射1×106個細胞/kg | MSC輸注安全且耐受性良好。SLEDAI 評分和蛋白尿的改善。(兩名患者蛋白尿復發) | [16 , 17] |
| 孫等人。NTC00698191 | 16例難治性SLE患者;(8個月) | ucMSCs,單次靜脈注射 1×106個細胞/kg | MSC輸注安全且耐受性良好。SLEDAI評分和腎功能的改善 | [ 18 ] |
| 鄧等人。NTC01539902 | 狼瘡性腎炎患者18例;n = 12 ucMSC,n = 6 安慰劑;(12 個月) | ucMSC,兩次靜脈注射 2×108個細胞/患者,間隔 7天 | MSC輸注安全且耐受性良好。ucMSCs沒有高于標準免疫抑制的效果 | [ 19 ] |
| 腎移植 | ||||
| 佩里科等人。NTC00752479 | 2名活體腎臟Tx受者;(1 年) | 自體bmMSC,單次靜脈輸注1.7–2×106個細胞/kg, Tx后第+7天 | MSC輸注安全且耐受性良好。MSC輸注后血清肌酐水平短暫升高。增加Treg百分比并抑制記憶CD8+T細胞擴增 | [ 20 ] |
| 佩里科等人。NTC02012153 | 2名活體腎臟Tx受者;(1 年) | 自體bmMSC,單次靜脈輸注2×106個細胞/kg, Tx前第-1天 | MSC輸注安全且耐受性良好。無MSC相關的腎功能不全。循環記憶CD8+T和供體特異性 CD8+T細胞溶細胞反應減少 | [ 21 ] |
| 譚等人。NTC00658073 | 159名活體腎臟Tx受者;n=53bmMSC+標準。劑量CNI;n=52bmMSC+低劑量 CNI(標準的 80%);n=51巴利昔單抗+標準品。CNI;(1 年) | 自體bmMSC,兩次靜脈輸注1–2×106個細胞/kg, Tx后第0天和第+14天 | MSC輸注安全且耐受性良好。與對照組相比,MSC輸注顯示急性排斥反應發生率較低,機會性感染風險降低,腎功能恢復更快。 | [ 22 ] |
| 雷德斯等人。NTC00734396 | 6名活體腎臟Tx受者;(6個月) | 自體bmMSC,兩次靜脈注射0.1–1×106個細胞/kg, 在Tx后6個月間隔7天 | MSC輸注安全且耐受性良好。機會性感染的發生率增加。兩名患者的腎小管炎和間質纖維化/腎小管萎縮得到緩解 | [ 23 ] |
| 穆德拉貝圖等人。NTC02409940 | 4名活體腎臟Tx受者;(6個月) | 自體bmMSC,兩次iv輸注,劑量為0.2–0.8×106個細胞/kg,Tx后第1天和第 +30天 | MSC輸注安全且耐受性良好。調節性T細胞增加,CD4 +T細胞增殖減少 | [ 24 ] |
| 潘等人。 | 32名活體腎臟Tx受者;n=16 MSC+低劑量他克莫司(標準劑量的50%),n=16標準劑量。他克莫司劑量控制;(2歲) | 同種異體bmMSC,兩次輸注:第0天5×106個細胞/kg,Tx后+30天2×106 個細胞/kg | MSC輸注安全且耐受性良好。患者組之間急性排斥反應發生率相當,移植物功能和存活率相似。MSC 允許使用較低劑量的他克莫司 | [ 25 ] |
| 埃爾皮庫姆等人。NCT01429038 | 10 名已故捐腎Tx受者;(1 年) | 同種異體bmMSC,單次靜脈注射:Tx后第+3天1.5× 106–3×106 | MSC輸注安全且耐受性良好。調節性 T 細胞增加并改善早期同種異體移植功能。MSC 的長期影響和免疫接種仍有待研究。 | [ 26 ] |
AKI:急性腎損傷;月:月;ia: 動脈內;d:日;年:年份;iv: 靜脈注射;bmMSC:骨髓來源的間充質基質細胞;CKD:慢性腎臟病;bmMPC:骨髓來源的間充質前體細胞;adMSCs:脂肪組織來源的間充質基質細胞;GFR:腎小球濾過率;eGFR:估計腎小球濾過率;SLE:系統性紅斑狼瘡;SLEDAI:SLE 疾病活動指數;ucMSC:臍帶來源的間充質基質細胞;Tx:移植;標準,標準;CNI:鈣調神經磷酸酶抑制劑;SCr:血清肌酐。
什么是急性腎損傷和慢性腎病
腎臟疾病是一種嚴重的健康問題,影響全球10%以上的人口,每年導致5至1000萬人死亡,主要原因是肥胖、糖尿病、高血壓和心血管疾病的逐漸增加。腎臟疾病傳統上被分為兩種獨立的病理學,即急性腎損傷(AKI)和慢性腎臟疾病(CKD)。
恢復受慢性疾病影響的腎臟的治療選擇很少而且這種疾病往往診斷得太晚,因為初始階段可能沒有癥狀。嚴重受損的腎臟可能會發展為腎纖維化和終末期腎病(ESRD)。ESRD需要腎臟替代療法,旨在替代關鍵的腎功能,包括透析或腎移植。
由于高血壓被認為是CKD的病因之一,目前CKD患者的治療主要基于使用藥物控制血壓和抑制腎素-血管緊張素醛固酮系統,該系統在控制血壓中起著核心作用。只有盡早開始治療,才能延緩ESRD的進展。因此,迫切需要預防和/或延緩CKD進展的新方法。
用于治療腎病的干細胞類型
人們對使用干細胞作為再生受損組織和器官的治療選擇產生了極大的興趣。根據效力可將它們分為兩大類:胚胎干細胞(ESC)和成體干細胞。
多能干細胞治療急性腎損傷的基礎研究
多能干細胞、ESC和iPSC被認為是腎臟疾病組織再生的潛在手段。使用這些細胞進行治療的第一步包括將它們分化為腎前體細胞或更成熟的腎細胞。此步驟對于減少多能干細胞固有的致瘤性和獲得更容易分化為所需靶組織的細胞類型都很重要。
多能干細胞治療慢性腎病的基礎研究
使用多能干細胞治療CKD的治療潛力尚未得到重視。一項研究報告稱,將ESC移植到接受5/6腎切除術的受損腎臟大鼠附近,由于旁分泌因子的釋放而減緩了疾病的進展 。
成體干細胞治療急性腎損傷的基礎研究
在過去的十年中,對幾種不同的成體干細胞/祖細胞群體進行了測試,以確定最有希望刺激腎臟再生能力的細胞。MSC被描述為激活受損腎臟再生最有效的細胞群之一(圖2A)。在此背景下,MSC的治療效果已在不同的AKI臨床前模型中得到證實。
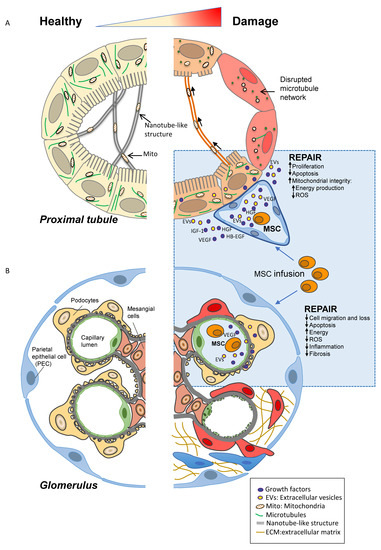
( A ) 注射后,MSC植入受損腎臟,并通過局部釋放具有促有絲分裂、抗炎和抗凋亡作用的生長因子和細胞外囊泡 (EV) 對近端腎小管細胞產生保護作用。此外,間充質干細胞生物產品還可以減少氧化應激,維持相鄰腎小管細胞之間的能量供應和線粒體交換,從而誘導再生過程。(B) 在CKD中,輸注后,MSC定位在受損的腎臟中,并通過釋放生長因子和EV來限制足細胞遷移和丟失、腎小球內皮細胞損傷和壁上皮細胞 (PEC) 激活。通過限制腎小球細胞功能障礙的間充質干細胞治療還可以減少腎小球纖維化和硬化病變的形成。
為了在臨床環境中使用MSC,我們的團隊證明,輸注人bmMSC可以通過增加腎小管細胞增殖、保持微血管完整性和限制順鉑誘導的AKI來改善腎功能并降低免疫缺陷 (NOD–SCID) 小鼠的死亡率。
成體干細胞治療慢性腎病的基礎研究
最近對70多篇文章的系統綜述強調MSC是治療實驗性CKD最有效的細胞群之一。與這些觀察結果一致,我們的小組研究了在ADR誘導的腎病動物中重復注射大鼠bmMSC的影響,該模型的特點是腎小球足細胞遷移和丟失以及微血管稀疏,隨后是粘連形成和腎小球纖維化病變。bmMSC的輸注顯著使腎小球結構改變正常化,從而減少腎小球硬化。
干細胞在治療腎臟疾病中目前取得哪些進展?
從目前的最新綜述中可以看出,大量研究強調了干細胞產品作為各種疾病的新療法所取得的進展和進展。不同干細胞/祖細胞群限制結構和功能損傷以及刺激受損組織和/或器官再生能力的潛力已在臨床前模型中得到廣泛描述。
已經設計了許多臨床試驗來評估間充質干細胞療法的安全性和有效性,并強調在不同疾病中使用這些細胞群的主要批評(圖1)。
迄今為止(2023年8月4日),超過1226項基于MSC的臨床試驗(已完成或正在進行)已在美國國立衛生研究院(www.clinicaltrial.gov)數據庫中注冊,包括血液病、移植物抗宿主病、糖尿病、器官移植、炎癥性疾病、肺、肝、骨疾病以及心血管、神經和自身免疫性疾病(圖1)。
上述大部分臨床試驗均處于早期階段(I-II期),表明MSC治療的有效性仍有待長期進一步研究。這種考慮對于腎臟相關疾病尤其如此,已有30多項I/II期臨床試驗,重點關注來自骨髓、脂肪組織或臍帶來源的同種異體或自體間充質干細胞的安全性和可行性,涵蓋下面簡要總結了多種疾病(圖1、表1)。
案例一:患者,男,20歲,未婚。主因間斷雙下肢輕度水腫及夜尿次數增多2年余于2009 -08 -21入院。患者于2007年7月無明顯誘因出現間斷雙下肢輕度水腫, 夜尿次數增多, 2~3次/晚。經干細胞治療,3個療程后,患者精神、飲食、睡眠可, 夜尿1~2 次/晚, 未訴乏力, 無雙下肢水腫, 尿量約2000 ml, 大便正常。患者治療期間未訴其他不適, 干細胞治療前后肝功能檢查等均未見異常,病情明顯改善。
案例二:一名62歲的印尼籍婦女,被診斷為胸部截癱、慢性腎功能衰竭、糖尿病,長期腎臟受累,慢性腎功能衰竭2年,肌酐水平為11mg/dL,無小便。采用人臍帶間充質干細胞移植方案治療。鞘內注射1.6×107個間充質干細胞,靜脈注射1.6×107個間充質干細胞。鞘內注射和靜脈注射后三周后,患者可以移動腳趾,腎功能得到改善。肌酐水平降至9 mg/dL。8個月后,患者可以抬起腿,肌酐水平是2mg/dL,小便恢復正常。
案例三:患者,男,29歲。6歲時確診為1型糖尿病。2001年出現腎功能異常,診斷為 “ 糖尿病腎病、尿毒癥”,遂開始血液透析,約3次/ 周。在行同種異體腎移植術+門靜脈置管術后,次日及第三日分別給予施行成人胰島及自體骨髓間充質干細胞懸液肝內移植術。
治療后,患者腎功正常,生命體征正常,血糖控制平穩,胰島素用量約15單位/天,比術前減少了近40單位/天。空腹和餐后C肽水平較移植前有明顯的提高。出院后給予密切隨訪,及時調整免疫抑制劑、胰島素劑量。
案例四:2016年,《中華細胞與干細胞雜志》報道了第二軍醫大學福州總院臨床醫學院向15位糖尿病腎病患者進行靜脈輸注臍帶間充質干細胞治療的臨床案例。
在接受治療的3個月后,患者血壓、血糖、C肽值及腎功能指標均有所改善,說明臍帶間充質干細胞靜脈輸注安全有效。與口服纈沙坦+皮下注射胰島素的傳統治療方式相比,間充質干細胞移植改善舒張壓、腎功能方面的臨床療效更優。
干細胞移植臨床試驗證實了干細胞治療腎臟疾病的有效性和安全性,通過MSCs的干預調節可改善腎纖維化,提高腎功能,為腎病患者的臨床治療提供了新方法。相信未來在更多的臨床試驗后,干細胞治療腎臟疾病的技術會更加成熟,讓越來越多的患者受益。
目前國內很多醫療機構都開展了干細胞療法,至于怎么選擇機構可以參考以下幾點:
- 1、看是否有行業資質:細胞行業有細胞庫、制備中心兩種資質,屬于政府批復資質,有這兩種資質的,相對正規;
- 2、合作機構:看是否與國內排名靠前的三級甲等醫院在合作,與大醫院合作的這些機構眼光相對會長遠一些;
- 3、第三方質量檢測:是否通過中檢院(國內食品藥品檢定研究院)檢測。
結論
干細胞療法在腎臟疾病臨床前模型中的前景尚未轉化為更有說服力的臨床療效證據。多項臨床試驗已經證實了干細胞,特別是間充質干細胞療法在腎病和腎移植患者中的安全性和耐受性(表1)。
面臨的挑戰
- 異體移植的免疫排斥反應:
- 異體干細胞移植后可能發生免疫排斥反應,需要尋找有效的克服方法。
- 成瘤性的風險:
- 干細胞移植后可能因分化不徹底形成腫瘤,需要完善定向誘導分化方法并改進篩選純化技術。
- 干細胞突變:
- 干細胞在體外培養過程中可能發生突變,需要加強質量控制,確保干細胞的安全性。
- 干細胞到治療靶區的輸送方式及效率:
- 需要開發更有效、更安全的干細胞輸送方式,提高干細胞到達治療靶區的效率和存活率。
- 腎組織再生的誘導分化以及調控:
- 需要進一步研究腎組織再生的分子機制,找到定向誘導分化以及調控的關鍵物質。
未來發展方向
為了提高干細胞及其衍生物臨床治療的有效性,未來需要重點研究以下幾個方面:
- 提高干細胞治療效率:通過優化干細胞培養條件、開發新型遞送系統等,提高干細胞的存活率、增殖能力和治療效果。
- 選擇合適的外源性干細胞及其衍生物:根據不同的腎臟疾病類型和患者個體差異,選擇最合適的干細胞類型和治療方案。
- 深入研究腎臟發育分子機制:發現定向誘導分化的關鍵物質,提高干細胞分化成腎臟細胞的效率和純度。
- 高效啟動內源性再生細胞的應答:研究內源性再生細胞的激活機制,開發能夠激活內源性再生細胞的治療方法。
- 高效維持專能干細胞的穩態:研究專能干細胞的穩態維持機制,開發能夠維持干細胞穩態的治療方法。
- 研究干細胞修復再生組織形態和功能的新機制:揭示干細胞修復再生組織形態和功能的新機制,為開發新型治療方案提供理論依據。
- 建立與人類更接近的大動物模型:建立與人類更接近的大動物模型,例如猴和小型豬模型,評價干細胞治療的長期療效和安全性。
干細胞治療腎病作為一種新興的治療手段,具有巨大的潛力和廣闊的應用前景。隨著基礎研究和臨床轉化的不斷深入,相信干細胞治療將為腎臟疾病患者帶來新的希望,并為腎臟疾病的治療帶來革命性的變革。
參考資料:
Rota C, Morigi M, Imberti B. Stem Cell Therapies in Kidney Diseases: Progress and Challenges. International Journal of Molecular Sciences. 2019; 20(11):2790. https://doi.org/10.3390/ijms20112790
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加官方微信
掃碼添加官方微信