中國干細胞新藥研發正在以全新的速度前進,?已有近103項干細胞藥物臨床試驗申請獲得受理,?其中多款干細胞新藥已進入臨床研究階段?。?
近年來,?在政策推動下,?我國干細胞產業迅速擴張,?干細胞新藥研發速度明顯加快。?據統計,?截至2024年09月2號,?國內共有103項干細胞藥物臨床試驗申請獲得受理。
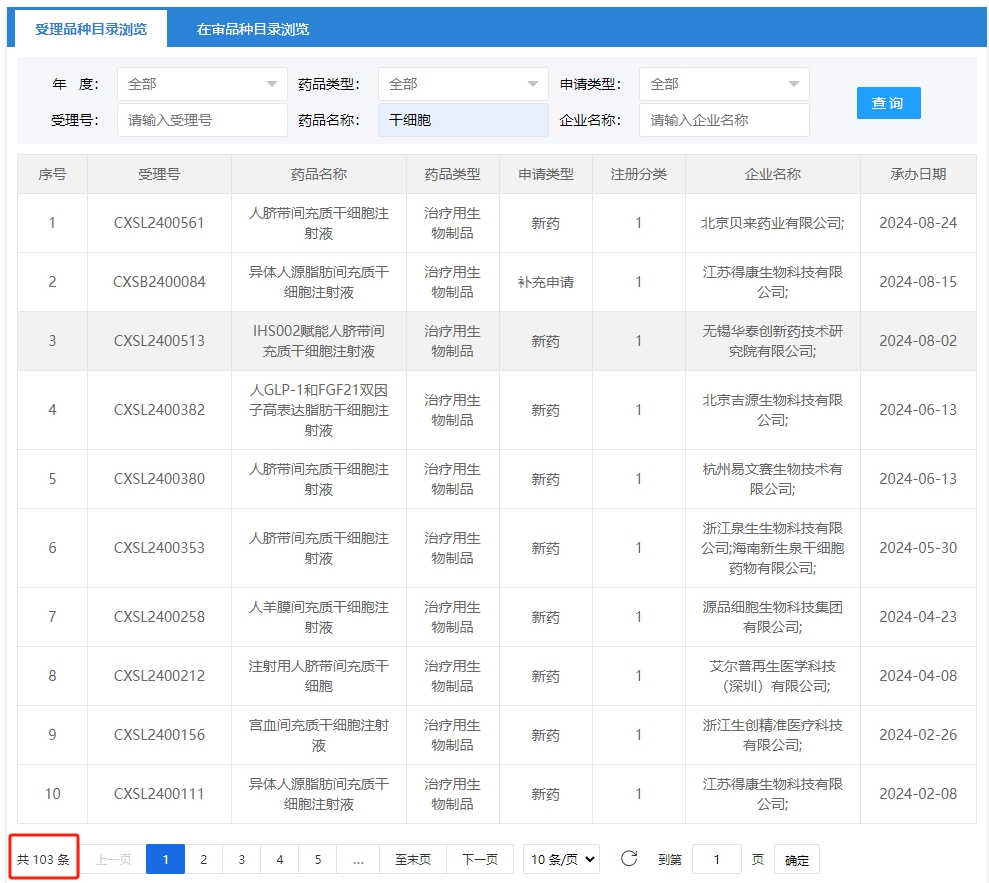
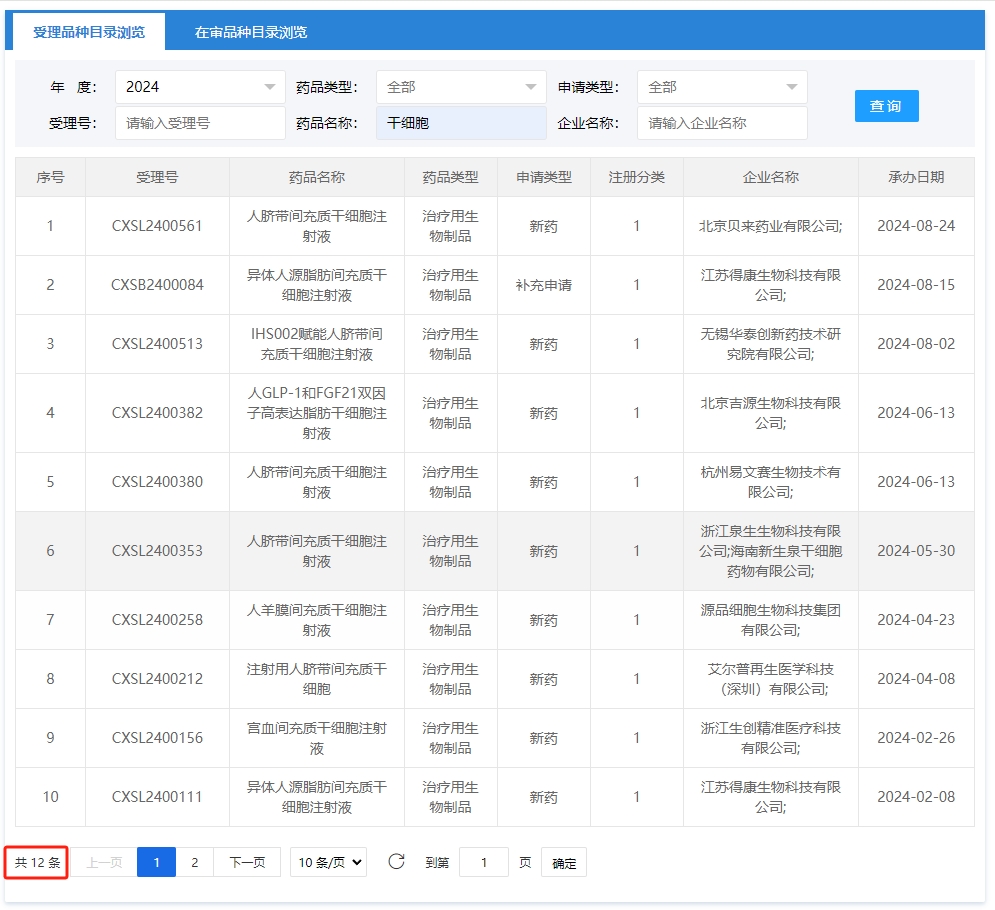
其中截至到2024年1月1號到9月2號新增申報獲受理數量達到12項。
其中,截至2024年9月1號共有54家企業(不含子公司)的110款獲準默許進入臨床試驗(臨床試驗默示許可)。
這些干細胞新藥涵蓋了多種類型,?如間充質干細胞、?造血干細胞、?神經干細胞等,?并廣泛應用于治療神經系統疾病、?心腦血管疾病、?血液系統疾病等。?目前,?已有多個干細胞藥物進入臨床Ⅲ期,?預示著中國干細胞新藥研發即將迎來爆發式增長。
截至2024年9月2號,干細胞新藥受理新增12項
12項干細胞新藥受理的公司是哪些,受理的干細胞新藥適應癥主要是哪些?
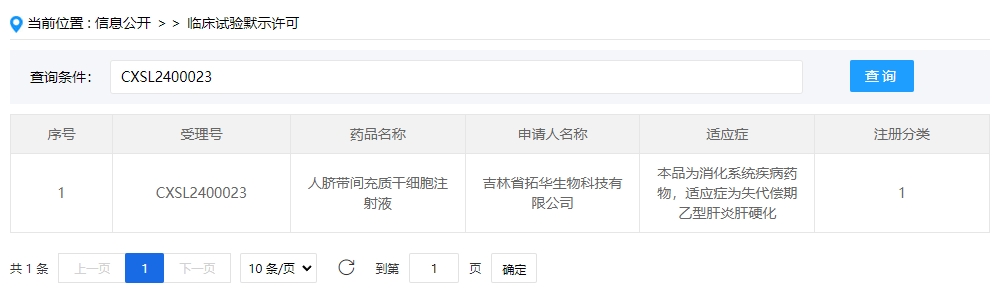
2024年干細胞新藥受理第1項:2024年01月10號,吉林省拓華生物科技有限公司的“人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號為:CXSL2400023)。
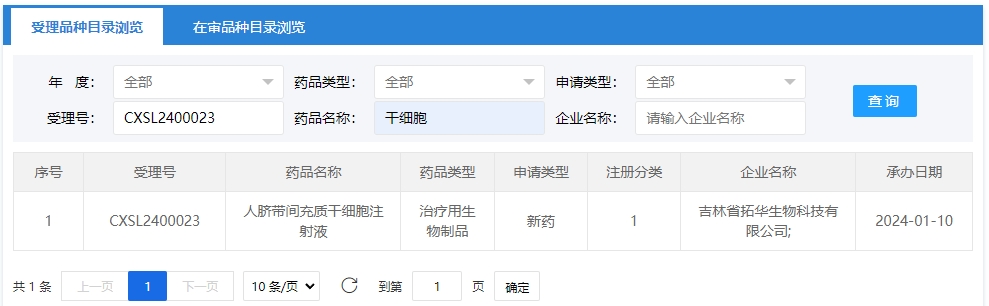
該干細胞新藥的適應癥為消化系統疾病藥物,適應癥為失代償期乙型肝炎肝硬化。
這是該款細胞注射液的第2種適應癥獲得受理,早在2023年02月23日,蘇州拓華生物科技有限公司的“人臍帶間充質干細胞注射液”已獲得默示許可(受理號:CXSL2300152)。該干細胞新藥的適應癥為中/重度急性呼吸窘迫綜合癥。
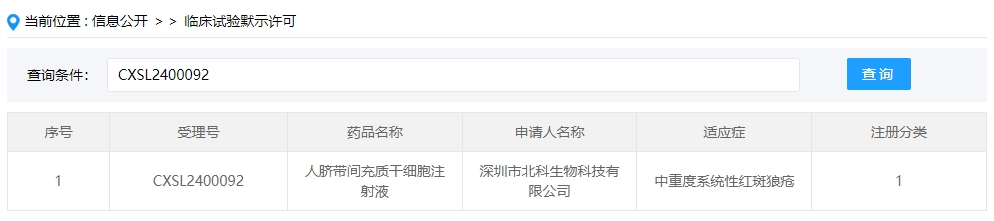
2024年干細胞新藥受理第2項:2024年02月10號,深圳市北科生物科技有限公司的“人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號為:CXSL2400092)。

該干細胞新藥的適應癥為中重度系統性紅斑狼瘡。此前,該款干細胞制劑于2020年6月5日獲得受理(受理號:CXSL2000128),但后續任務進展無法查詢。
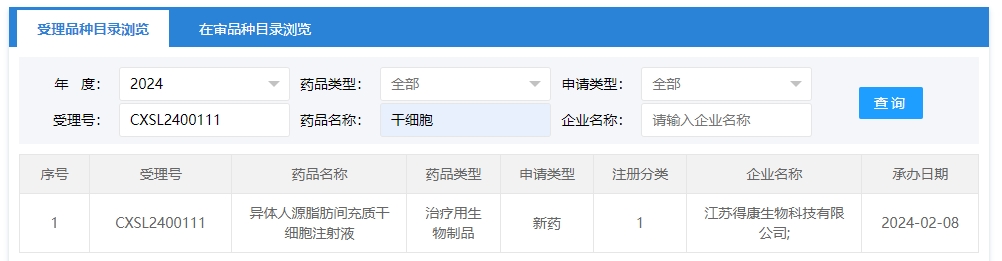
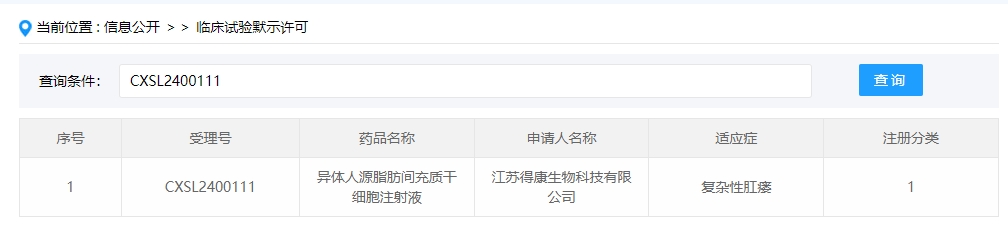
2024年干細胞新藥受理第3項:2024年02月08號,江蘇得康生物科技有限公司的“異體人源脂肪間充質干細胞注射液”的臨床試驗申請獲受理(受理號為:CXSL2400111)。
該干細胞新藥的適應癥為復雜性肛瘺。
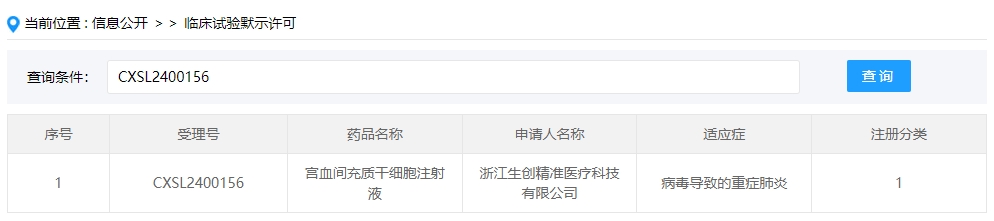
2024年干細胞新藥受理第4項:2024年02月26號,浙江生創精準醫療科技有限公司的“宮血間充質干細胞注射液”的臨床試驗申請獲受理(受理號為:CXSL2400156)。
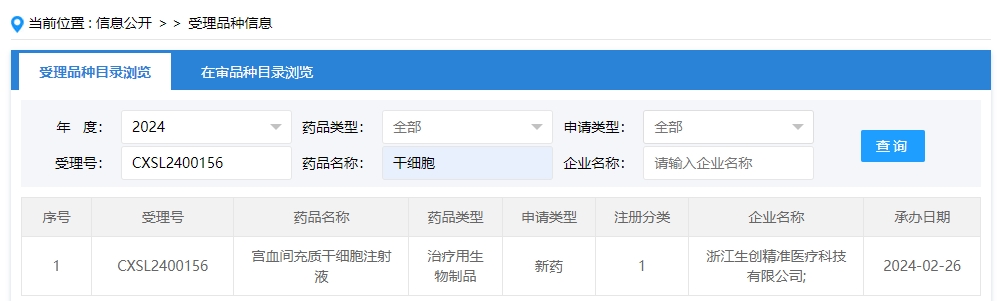
該企業的干細胞新藥的適應癥為病毒導致的重癥肺炎。
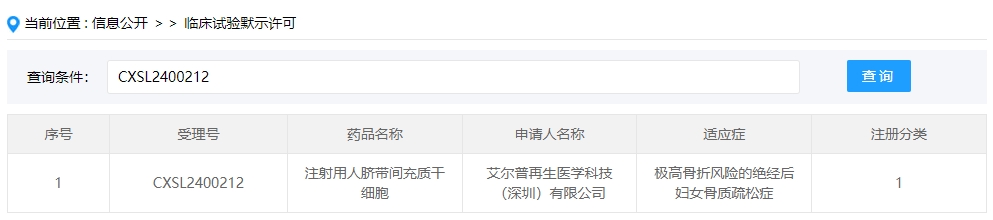
2024年干細胞新藥受理第5項:2024年04月08號,艾爾普再生醫學科技(深圳)有限公司的“注射用人臍帶間充質干細胞”的臨床試驗申請獲受理(受理號為:CXSL2400212)。
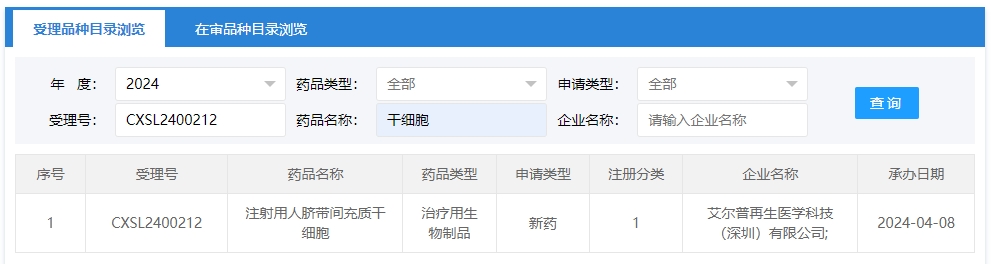
該企業的干細胞新藥的適應癥為極高骨折風險的絕經后婦女骨質疏松癥。
2024年干細胞新藥受理第6項:2024年04月23號,源品細胞生物科技集團有限公司的“人羊膜間充質干細胞注射液”的臨床試驗申請獲受理(受理號為:CXSL2400258)。
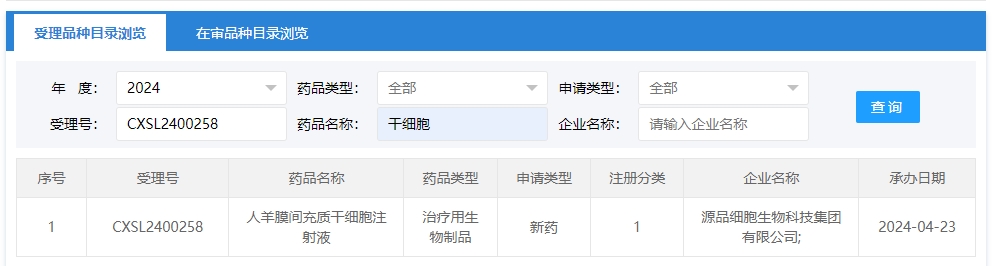
該企業的干細胞新藥的適應癥暫未查詢到。
2024年干細胞新藥受理第7項:2024年05月30號,浙江泉生生物科技有限公司;海南新生泉干細胞藥物有限公司的“人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號為:CXSL2400353)。這是該款細胞注射液第6次獲得受理。
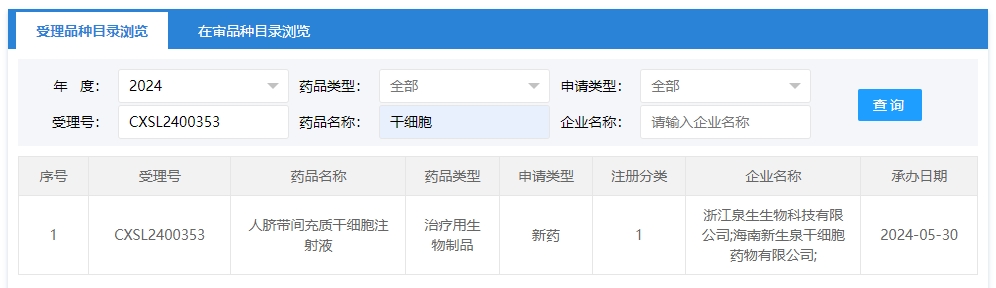
該企業受理的干細胞新藥適應癥為:此前已默示許可開展注射給藥用于輕至中度急性呼吸窘迫綜合征(ARDS)患者的治療(受理號:CXSL2200114)、注射給藥用于強直性脊柱炎(受理號:CXSL2200299)、注射給藥用于Ⅱ度燒傷(受理號:CXSL2200301)、注射給藥用于失代償期乙肝病毒肝硬化(受理號:CXSL2200457)、注射給藥用于慢性阻塞性肺疾病(受理號:CXSL2300795)的臨床試驗。
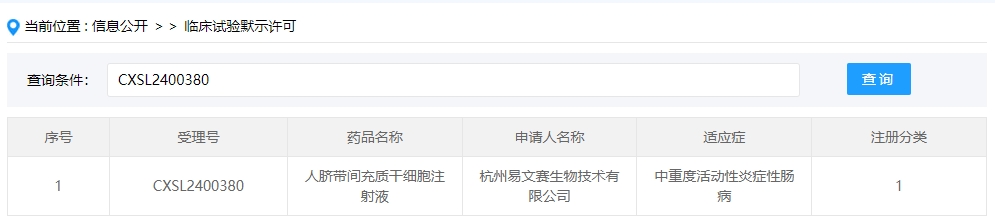
2024年干細胞新藥受理第8項:2024年06月13號,杭州易文賽生物技術有限公司;的“人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號為:CXSL2400380)獲得受理。
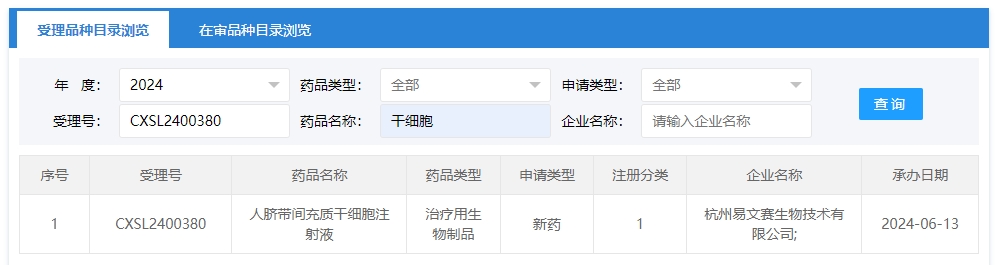
該企業的干細胞新藥的適應癥為中重度活動性炎癥性腸病。
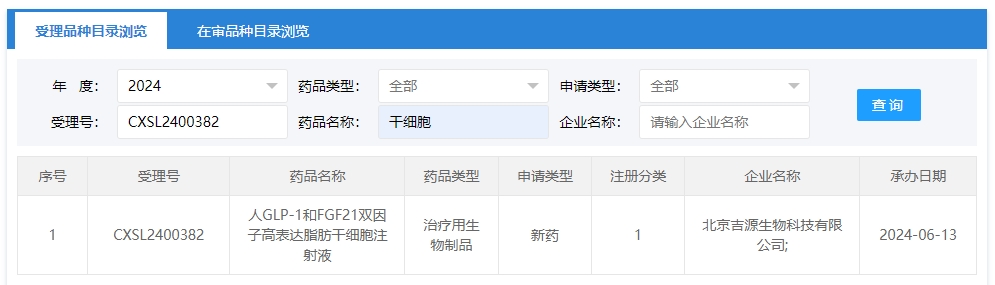
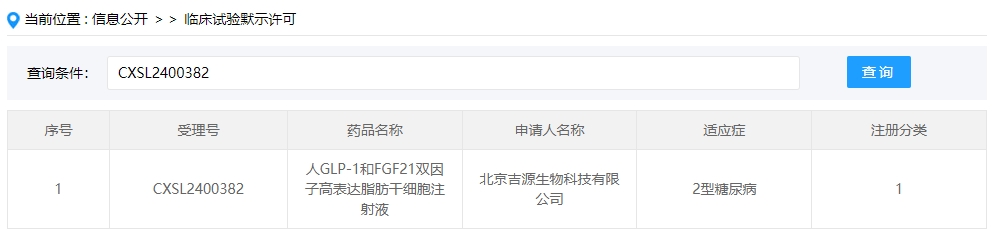
2024年干細胞新藥受理第9項:2024年06月13號,北京吉源生物科技有限公司的“人GLP-1和FGF21雙因子高表達脂肪干細胞注射液”的臨床試驗申請獲受理(受理號為:CXSL2400382)獲得受理。
2024年干細胞新藥受理第10項:2024年08月02號,無錫華泰創新藥技術研究院有限公司的“IHS002賦能人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號為:CXSL2400513)獲得受理。
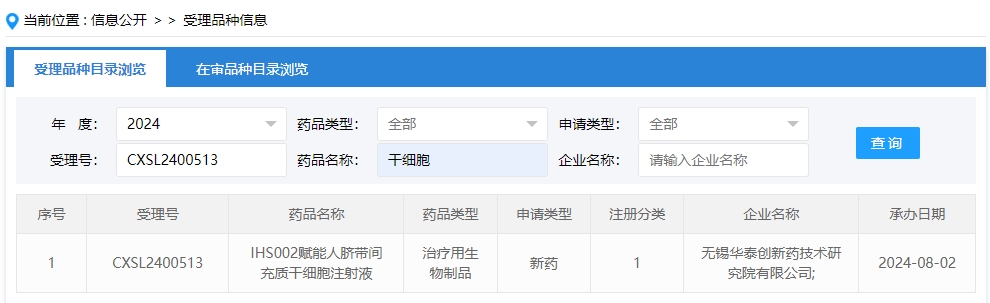
該企業的干細胞新藥的適應癥暫未查詢到。
2024年干細胞新藥受理第11項:2024年08月15號,江蘇得康生物科技有限公司的“異體人源脂肪間充質干細胞注射液”的臨床試驗申請獲受理(受理號為:CXSB2400084)獲得受理。
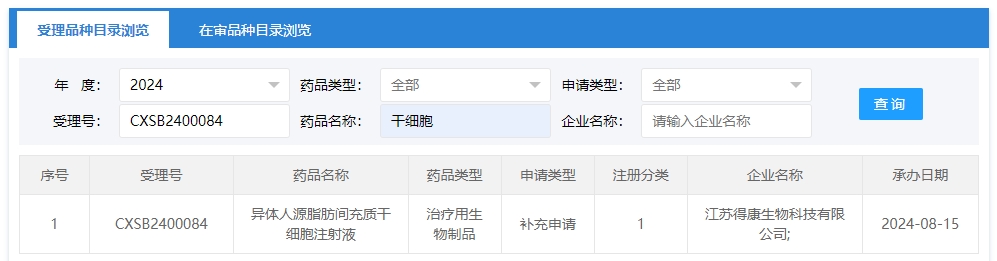
該企業的干細胞新藥的適應癥暫未查詢到。
2024年干細胞新藥受理第12項:2024年08月24號,北京貝來藥業有限公司的“異體人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號為:CXSL2400561)獲得受理。這是該款細胞注射液第5次獲得受理。
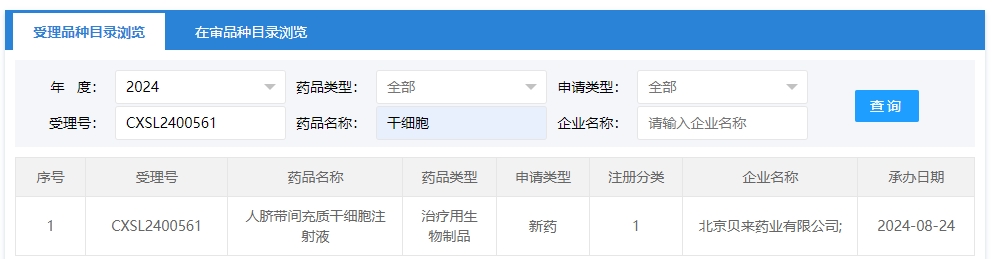
該企業受理的干細胞新藥適應癥為:這是該款干細胞注射液的第5種適應癥獲得受理,(受理號為:CXSL2400561,適應癥未知),(受理號為:CXSL2300776,適應癥未知),類風濕關節炎(CXSL2000005),特發性肺纖維化(CXSL2200370),阿爾茨海默病(CXSL2300129)。
展望未來
全球細胞治療領域在基礎研究領域已取得諸多重大原創性成果,我國名列前茅。
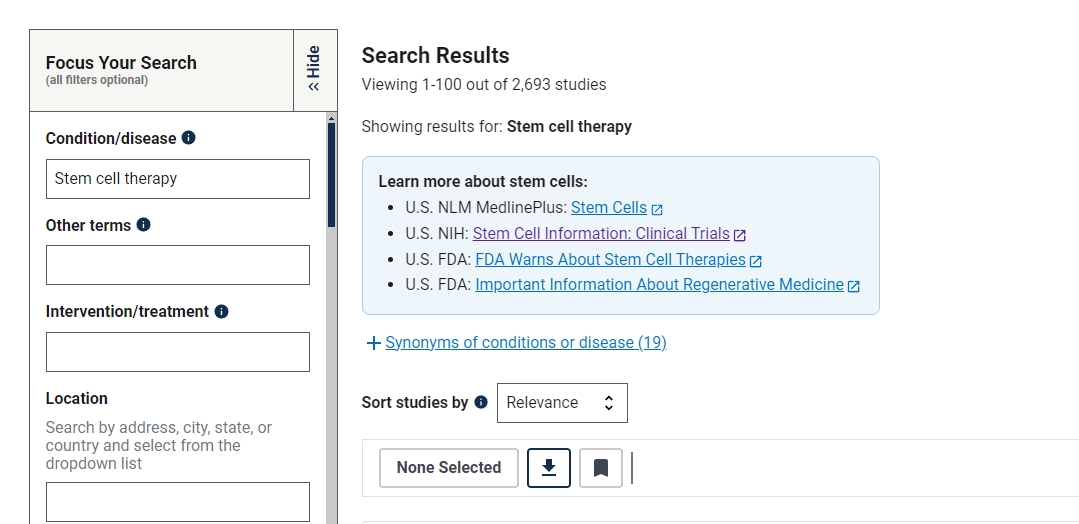
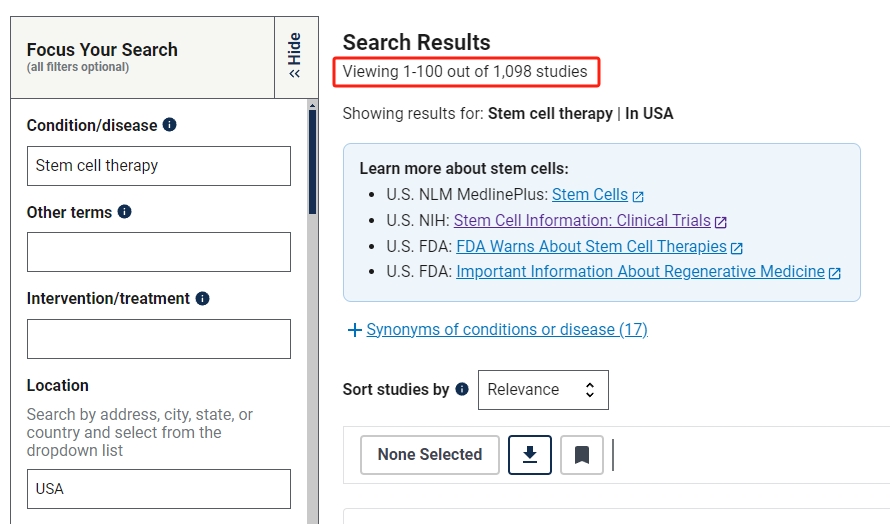
截止2024年9月,在美國國立衛生研究院的最大臨床試驗注冊庫clinicaltrials.gov網站上注冊的有關干細胞治療的臨床研究項目有2693項。
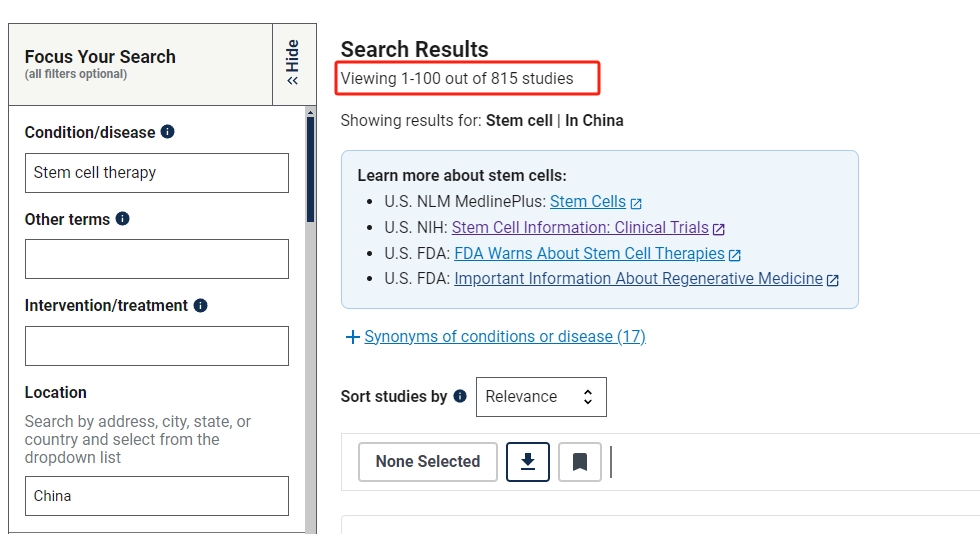
其中在中國進行的干細胞臨床研究的項目有815項,美國為1098項,中美兩國在干細胞工程技術與基因工程技術并駕齊驅。
相信2024年度會是干細胞藥物研發的爆發期,會有更多針對新適應癥的細胞藥物進入臨床試驗階段。同時,正在開展干細胞藥物Ⅰ期/Ⅱ期臨床試驗也將逐步產生結果,相信隨著干細胞技術研發的不斷深入,干細胞作為治療藥物離上市將在不遠的未來。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信