
截至5月15日,國家藥品監督管理局藥品審評中心發布的臨床試驗默示許可顯示,共有62款間充質干細胞新藥獲得臨床試驗許可。
干細胞新藥匯總:通過CDE審評的干細胞新藥多達62款
這些藥品的干細胞主要來源包括臍帶、脂肪、宮血、羊膜、骨髓、牙髓、胎盤等,涉及到30多家公司。
適應癥涵蓋了多個疾病類型,包括神經科(腦卒中、脊髓損傷、老年癡呆癥)、骨科(膝骨關節炎、股骨頭壞死)、肝病、肺病、腸病、風濕免疫科(狼瘡、硬皮病、強直性脊柱炎、皮炎、類風濕關節炎)、皮膚病與燒傷、內分泌科(糖尿病足潰瘍)、牙科、婦產科、心內科、血液內科(GvHD)等。
受理號藥品名稱與適應癥明細如下:
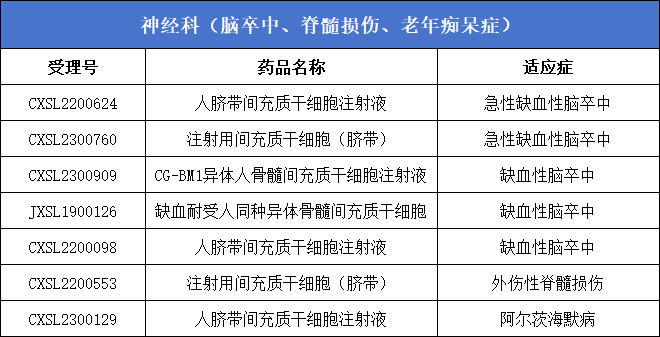
1、神經科(腦卒中、脊髓損傷、老年癡呆癥)7款
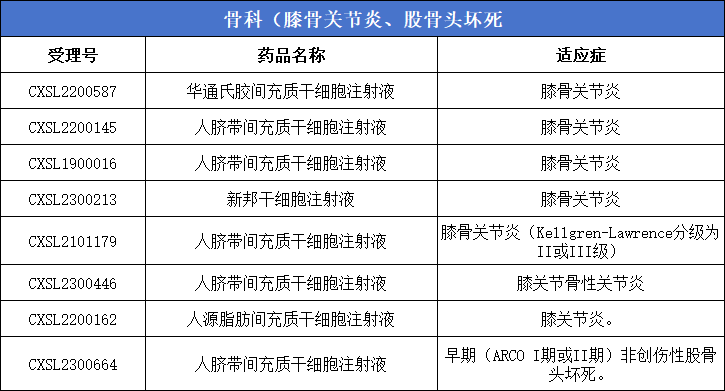
2、骨科(膝骨關節炎、股骨頭壞死)8款
3、肝病:6款

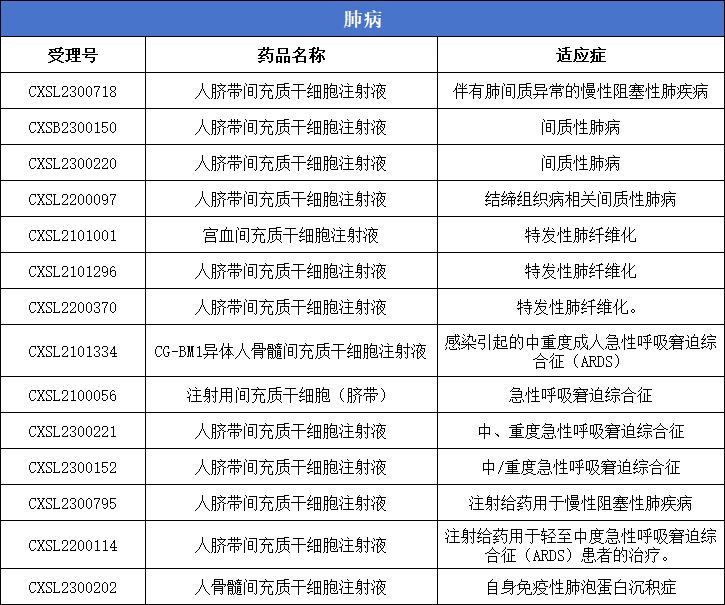
4、肺病:14款
5、腸病:5款

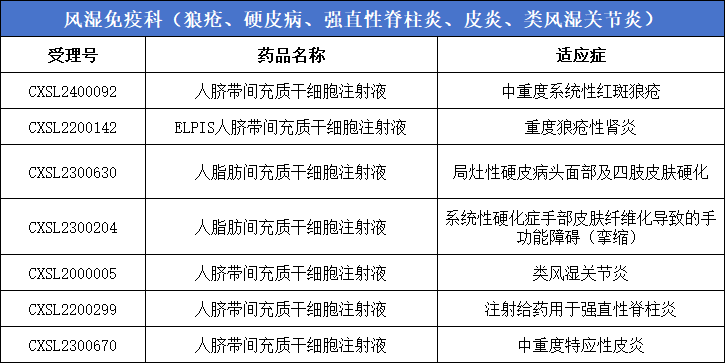
6、風濕免疫科(狼瘡、硬皮病、強直性脊柱炎、皮炎、類風濕關節炎)7款
7、皮膚病與燒傷:2款

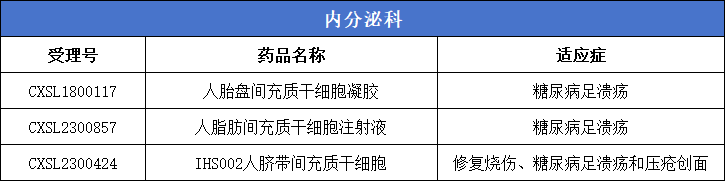
8、內分泌科(糖尿病足潰瘍)3款
9、牙科:1款

10、婦產科:1款

11、心內科:2款

13、血液內科(GvHD)

在全球范圍內目前獲批的干細胞產品主要集中在日本、韓國、美國、歐盟等地。然而,近幾年我國也在大力扶持干細胞技術的發展,目前已將干細胞發展列入“十四五”發展規劃。雖然目前干細胞療法還存在很多爭議,但相信在不久的將來,干細胞療法將會像“細管嬰兒技術”一樣,被廣泛的醫生及大眾認可并接受。
信息來源:國家藥品監督管理局藥品審評中心
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信