帕金森病是一種極其復(fù)雜的疾病,治療起來非常困難。雖然目前已有藥物可以緩解癥狀,但尚無獲批的療法能夠減緩潛在疾病的進(jìn)展。然而,生物技術(shù)行業(yè)并未放棄尋找可能改變這種令人衰弱的疾病患者預(yù)后的新型療法,而最近干細(xì)胞療法早期取得的積極成果,為帕金森病患者帶來了新的希望。
帕金森病的病因和目前的治療方法是什么?
雖然帕金森病的根本病因尚不清楚,但科學(xué)家們知道,這種疾病是由大腦黑質(zhì)區(qū)域神經(jīng)元的損失引起的,而黑質(zhì)區(qū)域負(fù)責(zé)產(chǎn)生化學(xué)物質(zhì)多巴胺。多巴胺在大腦的獎勵系統(tǒng)中起著至關(guān)重要的作用,影響著愉悅感、動力和運動,同時也會影響情緒、注意力、學(xué)習(xí)能力和記憶力。這些神經(jīng)元的損失會導(dǎo)致多巴胺水平驟降,這最終是患者最終出現(xiàn)這些令人困擾的癥狀的驅(qū)動因素——這些癥狀通常發(fā)生在約80%的神經(jīng)元衰竭時。
目前,帕金森病的主要治療方法是提高大腦中的多巴胺水平。左旋多巴被認(rèn)為是最有效的選擇,并且經(jīng)常與其他藥物聯(lián)合使用以增強(qiáng)其療效并減少副作用。然而,并非所有患者都對這些藥物有反應(yīng),在某些情況下,醫(yī)生甚至?xí)M(jìn)行手術(shù),將電極插入大腦深處,以幫助緩解震顫和其他癥狀。
干細(xì)胞療法如何治療帕金森病?
干細(xì)胞療法治療帕金森病的核心機(jī)制是通過移植多能干細(xì)胞分化的多巴胺能神經(jīng)元前體細(xì)胞,替代患者大腦中退化的神經(jīng)元,恢復(fù)多巴胺分泌功能,從而改善運動癥狀并延緩疾病進(jìn)展。
01、神經(jīng)元替代與功能重建:帕金森病的核心病理是黑質(zhì)區(qū)多巴胺能神經(jīng)元退化導(dǎo)致紋狀體多巴胺水平下降。干細(xì)胞通過分化為多巴胺能神經(jīng)元前體細(xì)胞,移植到患者大腦殼核或紋狀體區(qū)域,重建神經(jīng)通路。移植細(xì)胞可存活并整合到宿主神經(jīng)網(wǎng)絡(luò)中,分泌多巴胺以恢復(fù)運動功能。
02、神經(jīng)營養(yǎng)因子分泌:移植的干細(xì)胞不僅直接替代神經(jīng)元,還能分泌腦源性神經(jīng)營養(yǎng)因子(BDNF)、膠質(zhì)細(xì)胞源性神經(jīng)營養(yǎng)因子(GDNF)等,促進(jìn)殘存神經(jīng)元存活、內(nèi)源性神經(jīng)干細(xì)胞增殖,并改善移植細(xì)胞的存活率與功能整合。
03、減少藥物依賴與副作用:傳統(tǒng)藥物(如左旋多巴)長期使用會導(dǎo)致療效減退和“開關(guān)現(xiàn)象”。干細(xì)胞療法通過恢復(fù)多巴胺水平,減少患者對藥物的依賴。
這三大機(jī)制正是干細(xì)胞療法治療帕金森病的目標(biāo)所在。干細(xì)胞具有發(fā)育成體內(nèi)任何細(xì)胞的潛力,包括腦細(xì)胞。如今,研究人員能夠?qū)⒏杉?xì)胞轉(zhuǎn)化為產(chǎn)生多巴胺的神經(jīng)細(xì)胞。從本質(zhì)上講,這意味著干細(xì)胞可以被植入大腦,取代已經(jīng)丟失的細(xì)胞——這是一種有望徹底改變帕金森病的治療方法。
雖然替換帕金森病導(dǎo)致死亡的神經(jīng)元的想法并不新鮮,但直到現(xiàn)在才開始取得一些成功。早在20世紀(jì)80年代,研究人員就開始嘗試將胎兒組織移植到帕金森病患者體內(nèi),但結(jié)果并不一致,還出現(xiàn)了一些令人不安的副作用,比如運動失控。
此后不久,干細(xì)胞開始嶄露頭角。盡管干細(xì)胞有望帶來更好的治療效果,但這項技術(shù)發(fā)展緩慢,耗費了很長時間才發(fā)展到現(xiàn)在的水平。
在接受采訪時,紐約斯隆凱特琳研究所干細(xì)胞生物學(xué)中心主任Lorenz Studer博士表示,其中一個原因是,由于干細(xì)胞具有分化成多種不同類型細(xì)胞的潛力,因此需要在恰當(dāng)?shù)臅r間以恰當(dāng)?shù)幕瘜W(xué)物質(zhì)組合產(chǎn)生產(chǎn)生多巴胺的神經(jīng)元。此外,制備和包裝大量易于送達(dá)外科醫(yī)生的干細(xì)胞也是一個挑戰(zhàn)——直到研究人員開發(fā)出可以冷凍干細(xì)胞的技術(shù)。
現(xiàn)在,許多技術(shù)障礙已被克服,干細(xì)胞最終可能能夠在帕金森病治療中發(fā)揮其真正的潛力。
臨床試驗取得進(jìn)展:2025年1-5月的研究表明干細(xì)胞治療帕金森病顯示出巨大潛力
2025年1月至5月,國內(nèi)外在干細(xì)胞治療帕金森病(PD)領(lǐng)域取得了多項重要研究進(jìn)展,涵蓋細(xì)胞療法技術(shù)創(chuàng)新、臨床試驗突破以及機(jī)制探索等方面。
干細(xì)胞治療帕金森病的國內(nèi)方面的研究進(jìn)展
誘導(dǎo)多能干細(xì)胞衍生的間充質(zhì)干細(xì)胞對對帕金森病具有治療作用
2025年1月1號,湖南大學(xué)化學(xué)化工學(xué)院進(jìn)行了一項誘導(dǎo)多能干細(xì)胞衍生的間充質(zhì)干細(xì)胞治療帕金森病小鼠模型的研究。該研究結(jié)果發(fā)表在“IUBMB Life”研究主頁。

結(jié)果顯示,iMSC可增加小鼠體重,抑制桿測試中下桿潛伏期的延長、握力測試中握力的下降以及高架十字迷宮測試中張臂進(jìn)入次數(shù)的增加,并有減輕紋狀體多巴胺丟失的趨勢。這表明,iMSC可能通過保留帕金森病患者的紋狀體多巴胺來部分改善其功能。
- (1) 我們首次發(fā)現(xiàn)iMSC對帕金森病具有治療作用;
- (2) 在帕金森病細(xì)胞療法中專門測試了肌肉強(qiáng)度,發(fā)現(xiàn)其可提高肌肉強(qiáng)度;
- (3) 發(fā)現(xiàn)細(xì)胞療法可緩解帕金森病患者進(jìn)入開放臂的次數(shù)增加。這表明 iMSC是帕金森病臨床研究和藥物開發(fā)的有希望的候選對象。
iPSC衍生細(xì)胞藥臨床試驗獲中美雙批準(zhǔn)
2025年1月8號,士澤生物自主研發(fā)的全球首個異體通用“現(xiàn)貨型”iPSC衍生多巴胺能神經(jīng)前體細(xì)胞注射液(XS-411)在治療帕金森病方面取得突破。
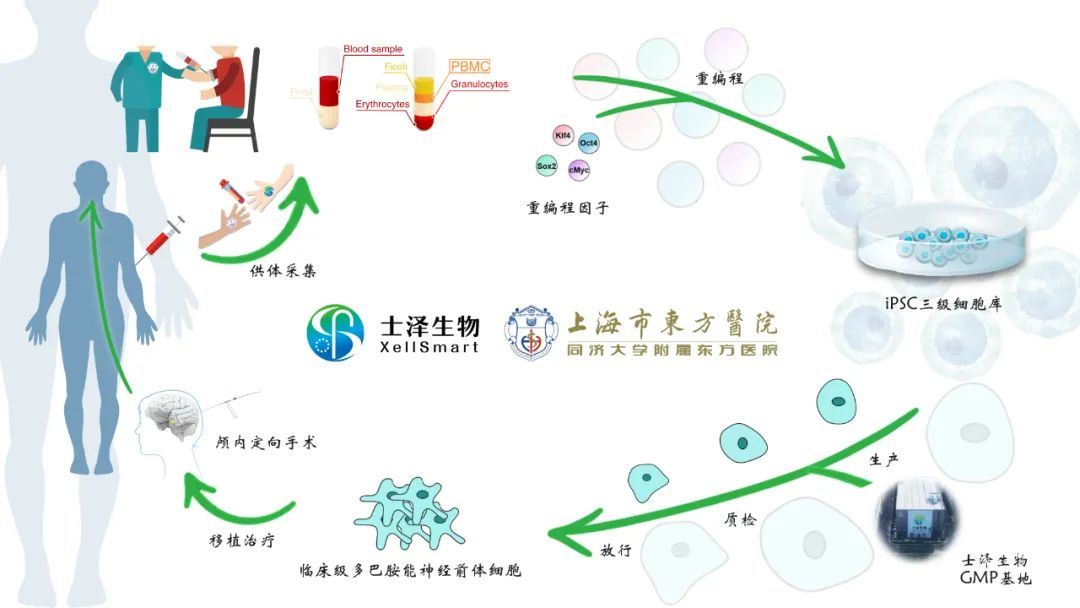
該藥物于2025年1月同步獲得中國NMPA和美國FDA的臨床試驗批準(zhǔn),并已在國內(nèi)完成首例受試者治療,隨訪12個月顯示:患者M(jìn)DS-UPDRS評分降低40%,開關(guān)期異常波動時間縮短60%,且無嚴(yán)重不良事件。該療法計劃于2028年提交新藥上市申請(NDA)。
自體iPSC治療中重度帕金森病的臨床突破:上海市東方醫(yī)院與士澤生物合作的自體iPSC來源多巴胺能神經(jīng)前體細(xì)胞療法,在臨床試驗中顯著改善患者運動功能和生活質(zhì)量。治療后12個月,患者帕金森病量表評分減少超過20分,部分患者實現(xiàn)功能性逆轉(zhuǎn)病程。
醫(yī)學(xué)里程碑!上海瑞金醫(yī)院實現(xiàn)帕金森病治療重大突破
2025年3月1日,上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院神經(jīng)內(nèi)科劉軍團(tuán)隊聯(lián)合中國科學(xué)院團(tuán)隊,成功完成全國首例GCP級自體干細(xì)胞移植治療帕金森病手術(shù)。66歲患者沈女士,患病14年且藥物失效,成為首例受試者。

全國首個!華山醫(yī)院啟動干細(xì)胞治療早期帕金森病隨機(jī)雙盲對照試驗
4月28日,國家神經(jīng)疾病醫(yī)學(xué)中心、復(fù)旦大學(xué)附屬華山醫(yī)院啟動再生多巴胺神經(jīng)前體細(xì)胞(iPSC)治療早發(fā)性帕金森病注冊臨床試驗,該試驗是國內(nèi)首個干細(xì)胞治療帕金森病的隨機(jī)雙盲對照試驗(具有臨床最高的證據(jù)級別)。
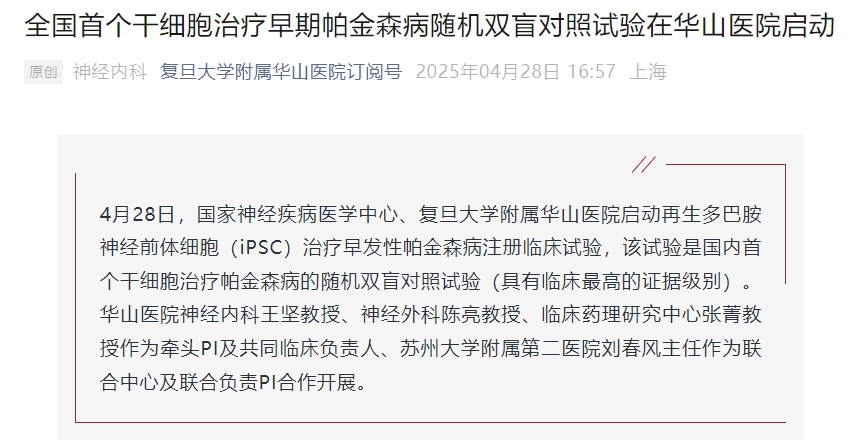
華山醫(yī)院神經(jīng)內(nèi)科王堅教授、神經(jīng)外科陳亮教授、臨床藥理研究中心張菁教授作為牽頭PI及共同臨床負(fù)責(zé)人、蘇州大學(xué)附屬第二醫(yī)院劉春風(fēng)主任作為聯(lián)合中心及聯(lián)合負(fù)責(zé)PI合作開展。
干細(xì)胞治療帕金森病國外方面的研究進(jìn)展
人誘導(dǎo)多能干細(xì)胞衍生品用于帕金森病自體細(xì)胞療法的臨床前安全性與有效性研究
2025年2月13日,哈佛醫(yī)學(xué)院麥克萊恩醫(yī)院聯(lián)合韓國大田韓國科學(xué)技術(shù)院進(jìn)行了一項“人誘導(dǎo)多能干細(xì)胞衍生品用于帕金森病自體細(xì)胞療法的臨床前安全性與有效性研究”。研究結(jié)果發(fā)表在期刊雜志“Cell Stem Cell”上。

研究結(jié)果表明:已經(jīng)成功從四名PD患者體內(nèi)生成臨床級hiPSC,這些hiPSC衍生的mDA細(xì)胞在長達(dá)9個月的小鼠體內(nèi)沒有表現(xiàn)出任何不良反應(yīng),同時mDA細(xì)胞移植表現(xiàn)出不同的療效,凸顯個體差異。目前,正在進(jìn)行自體I期臨床試驗,治療8名PD患者。
hES細(xì)胞衍生多巴胺能神經(jīng)元治療帕金森病的I期試驗
2025年4月16日,美國紐約州紐約市紀(jì)念斯隆凱特琳癌癥中心神經(jīng)外科部在自然期刊雜志上發(fā)表了一篇“Phase I trial of hES cell-derived dopaminergic neurons for Parkinson’s disease”。
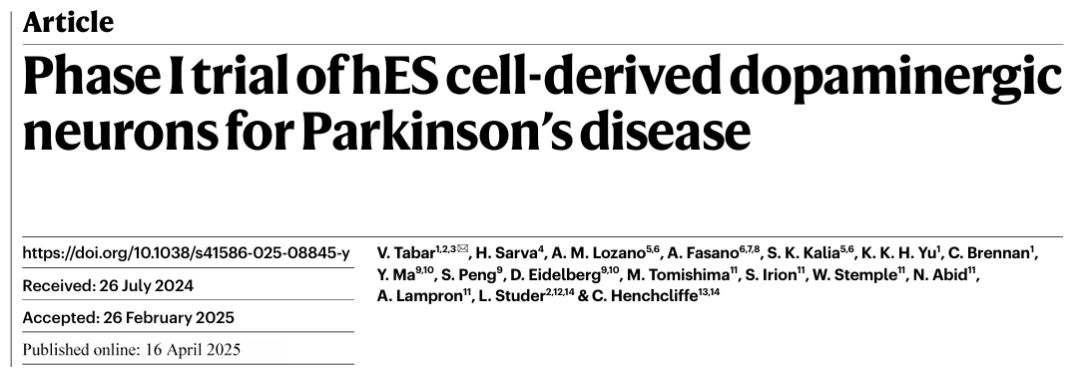
據(jù)悉這項胚胎干細(xì)胞衍生的多巴胺能神經(jīng)元細(xì)胞產(chǎn)品簡稱叫 (bemdaneprocel),是制藥巨頭拜耳的子公司BlueRock Therapeutics研發(fā),目前在該領(lǐng)域處于領(lǐng)先地位,該公司在2025年1月獲得美國食品和藥物管理局 (FDA) 的批準(zhǔn),順利將其用于治療帕金森氏癥的干細(xì)胞療法bemdaneprocel推進(jìn)到第3階段試驗。

此前,該候選藥物由來自人類胚胎干細(xì)胞的未成熟腦細(xì)胞多巴胺能神經(jīng)元祖細(xì)胞組成,在美國和加拿大12名帕金森病患者參與的一項小規(guī)模1期研究中取得了積極成果。?
參與者通過注射低劑量或高劑量的貝姆丹普羅塞(bemdaneprocel)到大腦中負(fù)責(zé)學(xué)習(xí)和運動控制的結(jié)構(gòu)。術(shù)后18個月進(jìn)行的PET掃描顯示,移植的細(xì)胞正在產(chǎn)生多巴胺,使用帕金森病進(jìn)展標(biāo)準(zhǔn)評定量表進(jìn)行的評估表明,該治療也緩解了癥狀。
最終,該試驗達(dá)到了其主要終點——耐受性,以及次要和探索性臨床結(jié)果顯示改善或穩(wěn)定,包括高劑量組運動障礙協(xié)會統(tǒng)一帕金森病評定量表 (MDS-UPDRS) 第三部分OFF評分平均提高23分。沒有移植物引起的運動障礙。這些數(shù)據(jù)證明了安全性并支持未來確定性的臨床研究。
在宣布FDA批準(zhǔn)bemdaneprocel進(jìn)入第3階段開發(fā)時,BlueRock表示預(yù)計將在2025年上半年的某個時間點開始bemdaneprocel的第3階段注冊試驗,這意味著我們很快就會聽到這個消息。
京都大學(xué)-iPS細(xì)胞衍生的多巴胺祖細(xì)胞的同種異體移植治療帕金森病
2025年4月19日,京都大學(xué)醫(yī)院和日本iPS細(xì)胞研究與應(yīng)用中心(CiRA)最近開展的一項1/2期臨床試驗,其自主研發(fā)的多巴胺能祖細(xì)胞取得了積極成果。

此次試驗的細(xì)胞來源于誘導(dǎo)性多能干細(xì)胞,而非像BlueRock的候選產(chǎn)品那樣來源于胚胎干細(xì)胞。然而,結(jié)果卻非常相似。
研究中,七名年齡在50至69歲之間的男性和女性患者,每人都接受了多巴胺能祖細(xì)胞移植,移植部位均為大腦兩側(cè)。在為期兩年的監(jiān)測期內(nèi),沒有出現(xiàn)嚴(yán)重不良反應(yīng)的報告,但出現(xiàn)了一些輕度至中度的不良反應(yīng),例如注射部位瘙癢和短暫性運動障礙(一種通常由某些藥物引起的運動障礙)。
研究結(jié)果還顯示,多巴胺的產(chǎn)生有所增加,這主要基于殼核對18F-多巴胺的攝取量增加了44.7%,尤其是在高劑量組。更令人鼓舞的是,六分之四的參與者報告稱,停藥后運動評分提高了20%,服藥后平均提高了4.3分,這表明移植的細(xì)胞已經(jīng)融入大腦回路,并發(fā)揮著新的多巴胺來源的作用。
日本制藥公司住友制藥配合京都大學(xué)的試驗,目前計劃向政府申請商業(yè)化生產(chǎn)細(xì)胞的許可。
值得注意的是,過去幾十年來,日本一直是干細(xì)胞研究的先驅(qū),其基礎(chǔ)是諾貝爾獎得主山中伸彌的研究成果。山中伸彌于2006年發(fā)現(xiàn),成體細(xì)胞可以被重新編程為類似胚胎的狀態(tài),從而能夠發(fā)育成幾乎任何類型的組織。自那時起,日本政府已投入超過1100億日元(7.7億美元)用于再生醫(yī)學(xué)的研發(fā),同時私人投資者和企業(yè)也投入了數(shù)十億美元。
隨著日本早期干細(xì)胞試驗近期取得成功,包括京都大學(xué)針對帕金森氏癥的1/2期研究,日本對干細(xì)胞研究的巨大投入可能即將獲得回報。
帕金森病治療的“重大飛躍”?
帕金森病是繼阿爾茨海默病之后第二大常見的神經(jīng)退行性疾病,其發(fā)病率逐年上升。2022年的一項研究顯示,美國每年有近9萬人被診斷患有帕金森病,較之前估計的每年6萬人的診斷率大幅增長。
事實上,預(yù)計到2040年,美國確診帕金森病的人數(shù)將翻一番。鑒于發(fā)病率的驚人上升,如果說有哪個時機(jī)能夠找到帕金森病的突破性治療方法,那么現(xiàn)在就是最佳時機(jī)。幸運的是,干細(xì)胞療法已被公認(rèn)為帕金森病治療的“一大飛躍”,只要它在后期試驗中繼續(xù)取得成功,就有可能成為亟需的突破性治療方法。
但該領(lǐng)域仍有很長的路要走。德克薩斯大學(xué)休斯頓分校神經(jīng)病學(xué)教授Mya Schiess博士說,干細(xì)胞療法仍可能存在風(fēng)險,這意味著科學(xué)家需要繼續(xù)監(jiān)測上述試驗中移植到患者大腦中的干細(xì)胞。她還指出,干細(xì)胞無法治愈像帕金森病這樣的潛在疾病,因此新生的神經(jīng)元有可能在一段時間后最終因相同的疾病過程而死亡。
盡管如此,它比目前的治療方法更進(jìn)了一步,因為它仍然可以阻止病情發(fā)展并改善運動功能,并且可能是科學(xué)家們在潛在病理方面仍未完全了解的疾病的最佳解決方案。
雖然本文提到的試驗規(guī)模較小,且旨在證明其安全性,但臨床上已見證的改善已極具前景。盡管該領(lǐng)域目前尚未開展大規(guī)模臨床試驗,國內(nèi)上海市東方醫(yī)院、瑞金醫(yī)院、華山醫(yī)院以及國外BlueRock Therapeutics和京都大學(xué)的積極數(shù)據(jù)或?qū)楦喙具M(jìn)入該治療領(lǐng)域鋪平道路,從而可能以前所未有的方式改變帕金森病患者的治療結(jié)果。
主要參考資料:來源于各大官方網(wǎng)站,可以后臺留言獲取
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信