2025年1月13日,據美通社報道Aspen Neuroscience已成功完成ASPIRO研究的劑量遞增和前兩組患者的治療,ASPIRO研究是針對干細胞治療帕金森病 (PD) 的1/2a期臨床試驗。

研究結果表明ANPD001及其給藥方式耐受性良好,在ASPIRO研究中前兩組患者中未觀察到嚴重不良事件。
Aspen Neuroscience宣布完成ASPIRO干細胞治療帕金森病患者的第一和第二組患者的1/2a期臨床試驗
帕金森氏癥研究性再生療法的自體衍生研究 (ASPIRO) 于2024年啟動,旨在評估ANPD001對中度至重度PD患者的療效。

2024年4月17日,AspenNeuroscience, Inc宣布,ASPIRO試驗的第一位患者已接受給藥,該試驗是一項1/2a期開放標簽臨床試驗,旨在評估ANPD001的安全性和耐受性,ANPD001是一種自體多巴胺能神經元細胞替代療法,適用于中度至重度帕金森病 (PD) 患者。
這項研究正在研究逐漸增加的劑量,主要終點是ANPD001的安全性和耐受性。次要終點包括“開機”時間的改善,即患者經歷癥狀控制期,以及基于標準PD評分量表的運動癥狀和生活質量的改善。
干細胞療法ANPD001對前2次試驗的帕金森病患者來說是安全的
Aspen Neuroscience首席醫療官Edward Wirth III醫學博士、哲學博士表示:“這是帕金森病自體療法首次多患者、多中心臨床試驗的一個重要里程碑。我們很高興地宣布,到目前為止,ANPD001及其給藥方式耐受性良好,在ASPIRO研究中前兩組患者中未觀察到嚴重不良事件。所有患者均按照方案在48小時內出院。我們現在正在推進該計劃,以研究我們的新商業配方。”
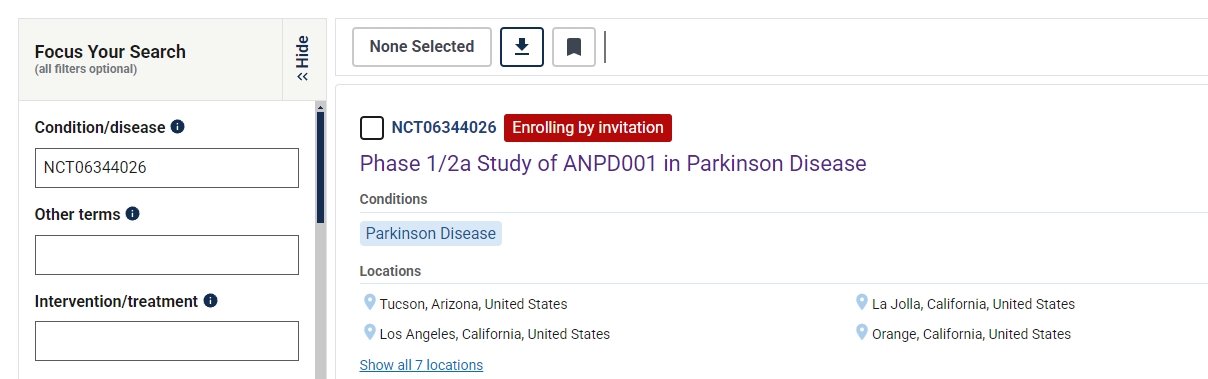
ANPD001是美國最先進的治療帕金森病的自體研究性新細胞療法。有關1/2a期試驗的更多信息,請訪問clintrials.gov (NCT06344026)。
這項研究試驗的患者年齡為50-70歲,不包括患有認知障礙和其他可能阻礙治療的合并癥的患者。所有入選患者均由運動障礙專家護理。
測試ANPD001
去年啟動的開放標簽ASPIRO試驗 (NCT06344026)旨在測試ANPD001在50-70歲患者中以遞增劑量注射一年后的安全性和耐受性。研究人員還將觀察一年內運動癥狀得到控制時的變化。
“這是自體干細胞療法治療帕金森病的多患者、多中心臨床試驗的一個重要里程碑,”Wirth表示“我們現在正在推進該項目,以研究我們的新商業配方,”如果ANPD001將來獲得批準,該配方可能會大規模投入市場。
帕金森癥的運動癥狀是由于多巴胺能神經元(大腦中產生多巴胺的神經細胞)的喪失而發生的。多巴胺是一種信號化學物質,作用于負責運動控制的大腦區域。多巴胺減少會導致動作遲緩、震顫、僵硬和平衡問題。
ANPD001旨在用新的多巴胺能神經元取代丟失的多巴胺能神經元。由于ANPD001使用患者自己的細胞,因此無需使用免疫抑制劑來阻止免疫系統排斥細胞療法。這使得它更安全、更個性化。
第一步是采集患者的皮膚細胞樣本,這些細胞被轉化為干細胞,然后給予化學信號,發育成多巴胺能神經元的前體。通過MRI引導注射,這些細胞被注入患者大腦的殼核區域,預計在那里它們會發育成功能齊全的多巴胺能神經元。
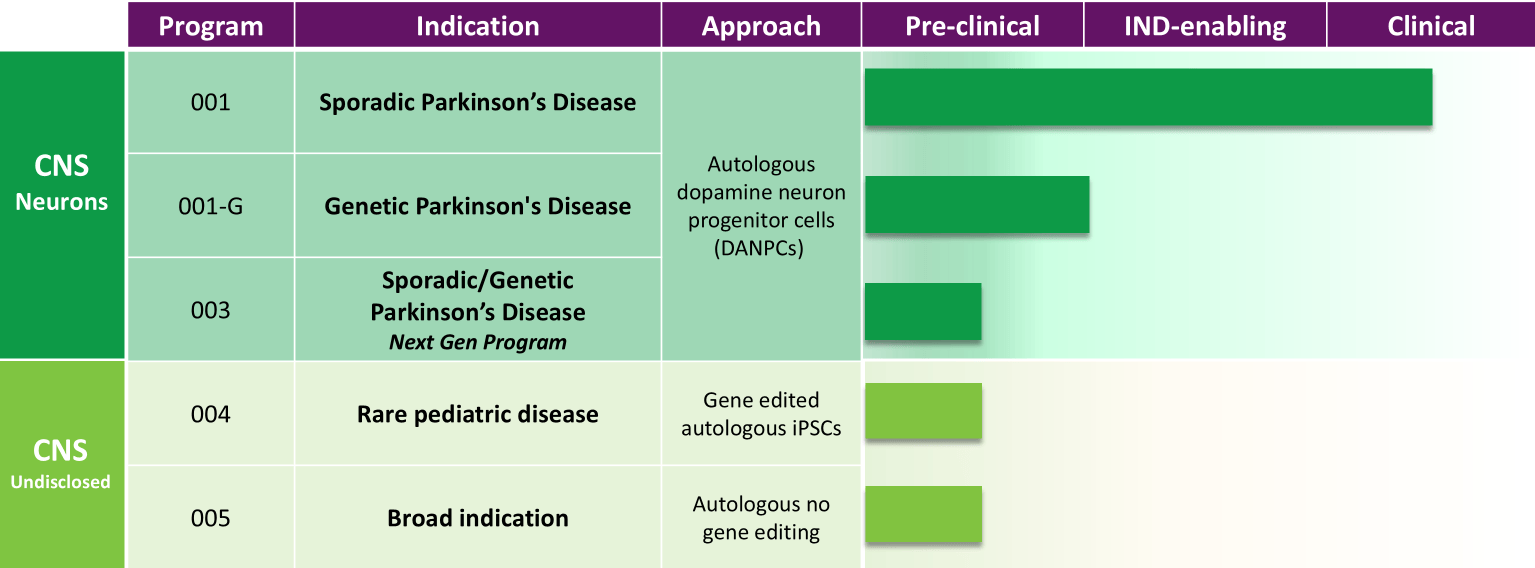
關于ANPD001
ANPD001是一種研究性自體多巴胺能神經元前體細胞 (DANPC) 療法,正在研究作為PD的再生療法。Aspen的個性化方法意味著患者不需要使用免疫抑制藥物來抵消身體對外來細胞的免疫反應。
Aspen 的制造過程從患者自身皮膚細胞的一小部分樣本開始,然后重新編程為誘導性多能干細胞 (iPSC),然后將iPSC分化為DANPC。這些DANPC被移植到殼核中,取代因疾病而丟失或受損的細胞。在每個制造階段,Aspen都會使用其專有的基于機器學習的基因組學測試來評估每個人的細胞質量。
ANPD001已獲得美國食品藥物管理局 (FDA) 的快速通道認證。
參考資料:https://aspenneuroscience.com/aspen-neuroscience-announces-completion-of-first-and-second-cohorts-in-aspiro-phase-1-2a-trial-for-parkinsons-disease/
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信