概述:在這篇綜述中,總結了不同種類干細胞在漸凍癥研究領域中的應用情況,包括間充質干細胞、神經干祖細胞、多能誘導干細胞,評估了干細胞來源、細胞量、干細胞修飾手段及給藥途徑等臨床前研究關鍵,為未來干細胞治療的應用奠定了基礎。
漸凍癥又稱為肌萎縮側索硬化癥,是一種影響中樞神經系統的神經退行性疾病,主要損害控制肌肉運動的上下運動神經元。患者通常會出現肌肉無力、萎縮、痙攣和運動功能逐漸喪失,最終導致呼吸衰竭。肌萎縮側索硬化癥的發病機制復雜,涉及多種遺傳和環境因素。
- 相關閱讀請瀏覽(肌萎縮側索硬化癥體征和癥狀是什么?及其治療方法)

近年來干細胞治療漸凍癥癥的相關研究已成為一大研究熱點。研究證實,間充質干細胞(MSCs)和神經干細胞等干細胞在臨床上有潛力幫助漸凍癥患者緩解病情。那么,針對漸凍癥,這些干細胞在臨床上是如何使用的呢?
影響干細胞治療漸凍癥效果的4大因素,你都了解嗎?
近日,首都醫科大學基礎醫學院神經生物學系聯合北京航空航天大學生物與醫學工程學院,生物材料與神經再生北京市重點實驗室在期刊《中國組織工程研究》上發表了一篇關于干細胞治療肌萎縮側索硬化癥:細胞來源、數量、修飾手段及給藥途徑的文章。【1】
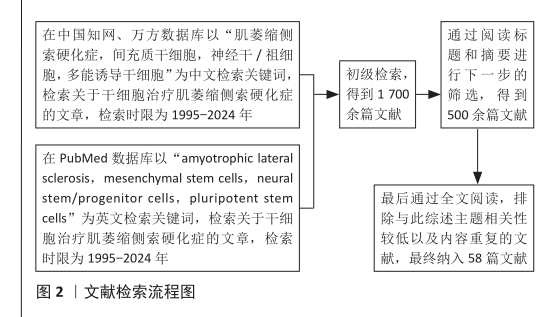
方法:以“肌萎縮側索硬化癥,間充質干細胞,神經干/祖細胞,多能誘導干細胞;amyotrophic lateral sclerosis,mesenchymal stem cells,neural stem/progenitor cells,pluripotent stem cells”為關鍵詞,在PubMed、中國知網、萬方數據庫進行檢索,檢索時限為1995-2024年。共檢索到1700余篇文獻,最終納入58篇文獻用于綜述。
結果
本次研究的目的是評估干細胞治療漸凍癥的來源、細胞量、干細胞修飾手段及給藥途徑等應用情況。
1.影響干細胞治療漸凍癥效果的細胞來源因素
1.1 間充質干細胞來源
間充質干細胞是一種多能干細胞,具有干細胞的所有共性,即自我更新和多向分化能力,可以分化為中胚層組織,如肌肉、肌腱、韌帶及脂肪組織等。由于間充質干細胞具有神經保護、免疫調節和神經再生特性,使其在漸凍癥等神經退行性疾病治療中具有較好的潛力。
1.2 神經干/祖細胞來源
神經干/祖細胞存在于胚胎期腦組織中,能夠分化為神經元。由于神經干/祖細胞具有神經發生的特性,使得很多研究人員期待將其作為細胞療法,移植到患者體內發揮代替治療的作用。
漸凍癥是運動神經元退行性疾病,隨著疾病進展運動神經元發生不可逆的退行性變,但由于運動神經
元及其祖細胞的形態特殊性,以及無特異表面蛋白等因素,導致該類細胞不易獲得。因此很多研究人員希望通過移植神經干細胞替代死亡的運動神經元從而實現替代治療。
1.3 誘導多能性干細胞來源
誘導性多能干細胞是指通過導入特定的轉錄因子將終末分化的體細胞重編程為多能性干細胞,具有類似于胚胎干細胞的全能性。誘導性多能干細胞無道德倫理爭議,來源廣泛,且避免了免疫排斥反應,為整個干細胞領域帶來了革命性的改變,對漸凍癥的機制探究及藥物開發具有深遠的意義。但通常誘導性多能干細胞只是作為細胞模型在漸凍癥機制研究中廣泛應用。
2.影響干細胞治療漸凍癥效果的細胞數量問題
2.1 間充質干細胞移植治療細胞數量
已有大量研究應用間充質干細胞治療漸凍癥,但治療效果不一。一些研究認為間充質干細胞具有明顯的時
效性,治療效果與給藥頻次相關,雖有研究發現單次間充質干細胞移植具有一定的收益,但多次細胞移植的治療效果遠優于單次移植。
2.2 神經干細胞移植治療細胞數量
在臨床方面, Svendsen團隊進行了一項Ⅰ/Ⅱa期臨床試驗,
- 第一劑量隊列 (n=9) 接受了10次單側注射,每個注射點200000個細胞,總共2000000個細胞;
- 第二個劑量隊列 (n=9) 每個注射點500000個細胞,總計5000000個細胞。
結果發現,與動物實驗一致,hNPCs(GDNF) 可在體內存活長達42個月,且分化為星形膠質細胞分泌GDNF;所有受試者均達到安全性的主要終點,沒有出現與產品相關的嚴重不良事件。
雖然研究發現兩項神經干細胞移植組均具有一定的收益,但第二劑量細胞移植的治療效果優于第一劑量組移植。
3.影響干細胞治療漸凍癥效果的給藥方式因素
3.1 間充質干細胞移植治療漸凍癥的給藥方式
一些研究認為給藥途徑亦為影響治療效果的重要因素之一,常見的給藥途徑包括靜脈注射、肌肉注射、側腦室注射 ( 鞘內注射 )。
- 靜脈注射:該方法的優點是無創、感染風險小、臨床應用時患者更易接受。研究發現,單次靜脈注射間充質干細胞可有效抑制血腦屏障的破壞,并且移植的間充質干細胞通過釋放神經營養因子發揮了神經保護作用。
- 肌肉注射:由于漸凍癥早期的臨床改變主要發生在外周,即神經肌肉接頭和神經纖維,而間充質干細胞釋放的神經營養因子為靶源性吸收,因此肌肉內注射間充質干細胞被認為可能對延緩 ALS 疾病進展更為有效。
- 側腦室注射 ( 鞘內注射 ):相較于以上兩種方式,該方式更為直接。側腦室注射 ( 鞘內注射 ) 間充質干細胞能夠有效減少因藥物無法透過血腦屏障而導致的藥物濃度降低等問題。
綜上,不同給藥途徑因治療的靶標不同,治療效果不同。(見表1)

此外,部分學者結合以上不同給藥途徑的優勢,采用了聯合給藥的方式:如重復鞘內和肌肉內組合注射間
充質干細胞可以通過減少細胞凋亡和自噬來保護運動神經元和神經肌肉接頭,抑制SOD1G93A大鼠脊髓壞死性凋亡的激活。相比于單一給藥方式,聯合給藥的治療方式可能具有更好的轉化意義。
3.2 神經干細胞移植治療漸凍癥的給藥方式
一些研究認為神經干細胞治療的注射方式不同是可能影響治療效果的。
神經干細胞移植治療漸凍癥給藥方法主要有以下幾種:
- 立體定向腦內注射移植:這是最常用的移植方法,通過CT/MRI掃描定位后,利用計算機規劃移植靶點和手術路徑,局部麻醉后鉆孔并注射干細胞。
- 脊髓局部注射移植:在脊髓損傷的節段進行手術,注射干細胞,同時可以起到減壓作用,促進部分脊髓功能的恢復。
- 經腦脊液途徑移植:通過腰椎穿刺蛛網膜下腔注射干細胞,這種方法適用于廣泛的腦部損傷或疾病。
- 經血液循環注射移植:干細胞通過靜脈或動脈注射進入血液循環,然后遷移到受損的神經系統部位。
- 鞘內注射:將干細胞注射到脊髓的鞘內空間,這種方法可以使干細胞更接近中樞神經系統。
研究表明,在肌萎縮側索硬化模型小鼠中,不同途徑移植神經干細胞對神經炎癥的影響存在差異。例如,側腦室內注射神經干細胞在起病后超早期可能是更好的移植途徑,因為它能夠更有效地進入中樞神經系統,發揮抗炎作用,并減緩運動功能損害的進展。
此外,干細胞的給藥途徑可能會影響其在體內的分布和治療效果,例如脊髓內注射可能直接作用于受損的脊髓,而靜脈注射則可能通過血液循環到達全身。
綜上,不同的注射方式可能影響干細胞的遷移、存活和分化,從而影響最終的治療效果。
4.修飾誘導性多能干細胞的應用
由于誘導性多能干細胞能夠更好地模擬漸凍癥的發病機制,使得目前采用患者來源誘導性多能干細胞誘導的運動神經元模型進行藥物篩選,可能獲得更好的轉化效果。目前正在進行臨床試驗的藥物羅匹尼羅和博舒替尼就是基于此方法研發的藥物。
- 羅匹尼羅作為治療帕金森病的藥物。日本慶應義塾大學醫學院進行了一項對照試驗,結果發現:在所有不良事件中,羅匹尼羅組受試者的胃腸道疾病 ( 主要為暫時性輕度惡心和腹瀉 ) 的發生率高達76.9%( 安慰劑組為14.3%)。
- 博蘇替尼是一種酪氨酸激酶抑制劑。日本京都大學的Inoue小組將患者來源誘導性多能干細胞誘導分化為運動神經元,并用于藥物篩選,結果提示篩選得到的藥物均以Src/c-Abl通路為靶標。作者發現無論是通過藥理學抑制還是基因抑制誘導性多能干細胞衍生運動神經元中的Src/c-Abl通路,均可發揮良好的治療效果,最終選擇了Src/c-Abl激酶抑制劑博舒替尼。
Src/c-Abl通路是指由Src家族激酶和c-Abl激酶組成的信號傳導通路。這兩種激酶都屬于非受體酪氨酸激酶家族,它們在細胞的生長、分化、遷移和存活等多種生物學過程中發揮作用。

患者來源誘導性多能干細胞是很好的藥物篩選模型,但漸凍癥中運動神經元的退行性變是多種因素共同介導的,所以誘導性多能干細胞冰不能在漸凍癥治療中發揮很好的作用。
結論
該綜述涵蓋了多種干細胞治療漸凍癥的研究進展,分析了不同干細胞治療漸凍癥的優劣勢,結合了臨床前研究與臨床試驗的成果,為從實驗室到臨床的轉化提供了橋梁。同時深入探討了干細胞治療的關鍵問題,如細胞來源、數量、修飾手段、給藥途徑及細胞模型的現狀,為未來干細胞治療漸凍癥提供了研究方向,也為藥物篩選提供了思路。
相關閱讀:了解更多關于干細胞治療漸凍癥的新聞資訊!
【1】趙文,畢玉琳,付旭陽,等.干細胞治療肌萎縮側索硬化癥:細胞來源、數量、修飾手段及給藥途徑[J].中國組織工程研究,2025,29(19):4083-4090.
【2】LEE HJ, KIM KS, AHN J, et al. Human motor neurons generated from neural stem cells delay clinical onset and prolong life in ALS mouse model. PLoS One. 2014;9(5):e97518.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。
版權說明:本文來自杭吉干細胞科技內容團隊,歡迎個人轉發至朋友圈,謝絕媒體或機構未經授權以任何形式轉載至其他平臺,轉載授權請在網站后臺下方留言獲取。



 掃碼添加官方微信
掃碼添加官方微信