骨科疾病(如骨關節炎、骨折)及腫瘤(如骨肉瘤)因高致殘率與治療瓶頸,成為全球公共衛生挑戰。傳統療法(藥物、手術)僅能緩解癥狀,無法實現組織再生。細胞療法憑借其修復潛能,為骨科疾病提供了從‘姑息治療’向‘功能重建’跨越的新范式。
4種細胞療法運用免疫調節和再生機制為治療骨科疾病開辟了新方向
近日,期刊雜志“Frontiers in Immunology”(免疫學前沿)刊發了一篇“Advances in cell therapy for orthopedic diseases: bridging immune modulation and regeneration”(骨科疾病細胞療法的進展:免疫調節與再生的橋梁)的綜述[1]。

這篇綜述討論了骨科疾病細胞療法的進展和潛在應用,尤其側重于骨關節炎、骨折、軟骨退化和骨科腫瘤的治療。我們探索間充質基質細胞(MSCs)、軟骨細胞移植、工程免疫細胞和誘導多能干細胞等4種細胞療法治療骨科疾病的潛力,發現其主要通過調節免疫反應和解決炎癥問題來促進骨組織再生。
最終,尖端細胞療法、免疫調節和分子靶向策略的整合將徹底改變骨科疾病和腫瘤的治療,為尋求長期解決衰弱問題的患者帶來希望。
骨科疾病和再生治療的需求
骨科疾病(如骨關節炎、骨折、軟骨退化及骨肉瘤、軟骨肉瘤等骨科腫瘤)因高發病率、致殘性及傳統療法的局限性,成為全球公共衛生挑戰。其中骨肉瘤、軟骨肉瘤和尤文氏肉瘤等骨癌雖然較為罕見,但在診斷和治療方面都面臨著巨大的臨床挑戰,需要更專業的護理。這些疾病的特點是關節、軟骨和骨骼逐漸退化,導致疼痛、活動能力下降和功能受損 (表1)。
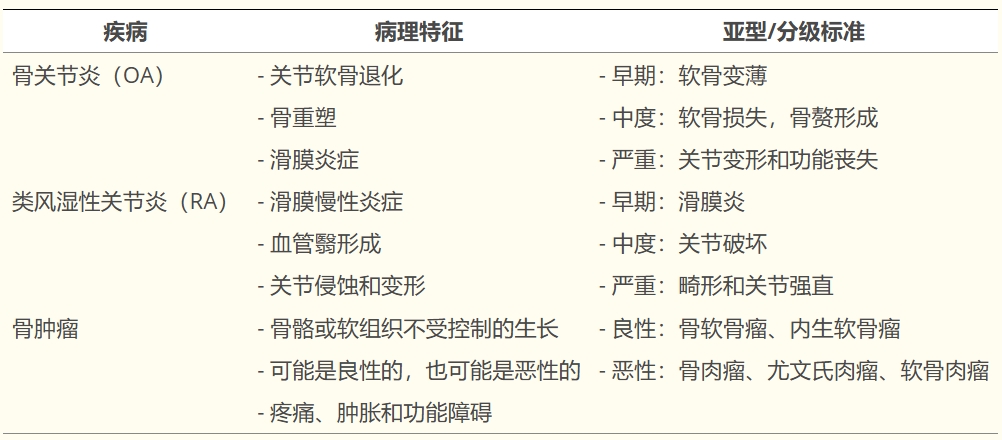
目前傳統藥物(如非甾體抗炎藥、皮質類固醇)和關節置換術僅能緩解癥狀,無法實現組織再生;骨科腫瘤的治療(手術、放化療)則面臨復雜的微環境調控與功能重建難題。近年來,細胞療法通過調節免疫微環境、促進組織修復,成為突破傳統瓶頸的核心方向。
三大工程細胞療法在骨科疾病的應用
細胞療法已成為一種有希望的解決方案,可解決骨科疾病(包括退行性疾病和腫瘤)常規治療的局限性。目前主要的工程細胞療法分為三種 :
間充質基質細胞(MSCs):免疫調節與多向分化的基石
間充質干細胞可從骨髓、脂肪等組織獲取,通過旁分泌(釋放IL-10、TGF-β等抗炎因子)抑制T/B細胞活化、誘導巨噬細胞向抗炎M2表型極化,同時分化為軟骨/骨細胞促進組織修復。
- 骨關節炎治療:臨床研究表明,靶向軟骨下骨病變的MSC注射(對比關節腔注射)可顯著延緩全膝關節置換術(TKA)需求(15年TKA發生率:軟骨下組20%vs關節腔組70%),證實精準定位對療效的關鍵作用。
- 骨科腫瘤修復:MSC通過分泌外泌體遞送miRNA或化療藥物(如阿霉素),協同促進骨缺損再生并增強抗腫瘤效果,但需解決炎癥微環境中的細胞存活率問題。
- 盤點干細胞治療骨關節炎:自體效果好還是異體好?高劑量還是低劑量安全?
軟骨細胞與工程化免疫細胞:精準修復與免疫調控
- 自體軟骨細胞移植(ACI/MACI):通過體外擴增患者軟骨細胞并回植,修復局灶性軟骨缺損,延緩關節退變。新型支架材料(如3D生物打印水凝膠)的應用提升了新生軟骨的力學性能,但體外去分化及纖維軟骨化仍是主要挑戰。
- 工程化免疫細胞(CAR-T/CAR-NK/CAR-M):基因改造免疫細胞靶向清除腫瘤細胞(如GD2陽性骨肉瘤)或調控炎癥微環境(如誘導M1→M2巨噬細胞極化),兼具抗腫瘤與促修復雙重功能。I期臨床試驗證實CAR-T治療骨科腫瘤的安全性,但非腫瘤性疾病(如OA)的靶點篩選(如MMP、RANKL)仍需優化。
誘導多能干細胞(iPSCs):個體化再生的未來
iPSCs可分化為軟骨/成骨細胞,為自體修復提供無限細胞來源,尤其適用于復雜骨缺損或個性化疾病建模(如OA病理機制研究)。然而,分化效率、腫瘤形成風險及規模化制備是臨床轉化的核心瓶頸。
關鍵分子通路調控骨科疾病細胞治療效果
骨科疾病細胞療法的療效受關鍵分子通路調控,其中免疫反應與炎癥微環境的調節至關重要。Toll樣受體(TLR)家族(尤其是TLR3)通過激活NF-κB和干擾素調節因子3(IRF3)信號級聯,驅動促炎因子及I型干擾素釋放,加劇軟骨退化、骨吸收及腫瘤進展。
TLR3被雙鏈RNA激活后,在骨關節炎等疾病中呈現雙重作用:一方面促進關節退變,另一方面可能參與骨重塑及抗腫瘤免疫調控。靶向TLR3等通路以平衡炎癥與修復過程,成為優化細胞治療策略的關鍵方向。
細胞療法治療骨科疾病的研究進展
基于細胞的療法在再生醫學領域展現出巨大的潛力,為治療骨關節炎、軟骨退化、骨折甚至骨科腫瘤等骨科疾病提供了潛在的解決方案。這些療法旨在利用不同細胞類型的再生特性來修復、再生或替換受損組織。
本文章探討了幾種關鍵方法,包括間充質干細胞 (MSC) 療法、基于軟骨細胞的方法、工程化免疫細胞療法和誘導多能干細胞 (iPSC),每種方法都具有獨特的優勢和挑戰(圖1)。
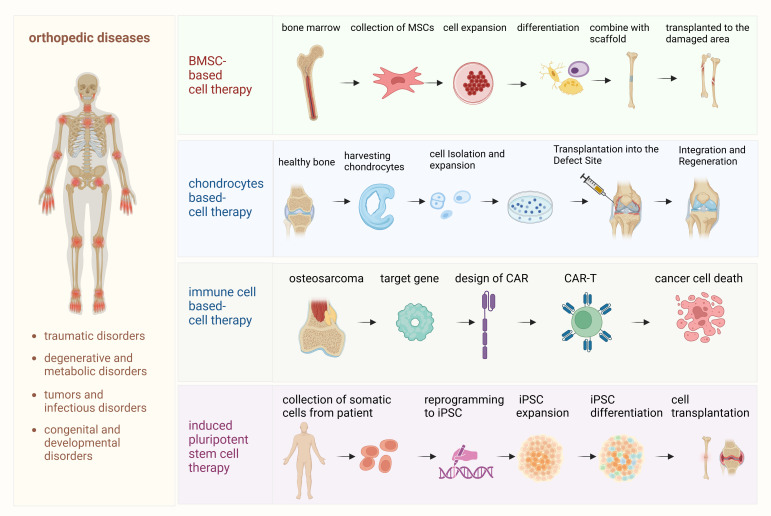
- (1)間充質干細胞 (MSC) 療法:該過程始于從骨髓或脂肪組織中分離MSC。然后,MSC 在培養中擴增,并根據需要的特定組織再生分化為成骨細胞、軟骨細胞或其他細胞類型。將這些分化的細胞移植到受損的骨骼或軟骨中,以促進愈合和再生。
- (2)軟骨細胞療法:在此過程中,從患者自身的軟骨中提取自體軟骨細胞,在體外擴增,然后重新植入受損的軟骨區域。該療法旨在修復軟骨缺損,特別是在骨關節炎或創傷性損傷的情況下。?
- (3)免疫細胞療法(骨肉瘤和CAR-T細胞療法):闡述了嵌合抗原受體T (CAR-T) 細胞療法在骨肉瘤治療中的應用。患者來源的T細胞經過基因工程改造,可表達靶向骨肉瘤細胞腫瘤抗原的CAR。這些經過基因工程改造的CAR-T細胞經擴增后回輸至患者體內,識別并攻擊腫瘤細胞,調節免疫反應,并可能改善骨肉瘤患者的預后。
- (4)誘導多能干細胞 (iPSC) 療法:iPSC是通過將體細胞(例如皮膚成纖維細胞)重編程為多能細胞而生成的。這些iPSC隨后分化為成骨細胞或軟骨細胞,從而再生骨骼和軟骨組織,為多種骨科疾病提供潛在的治療方法。
1、間充質基質細胞(MSCs)作為再生療法治療骨科疾病的核心優勢
間充質基質細胞(MSCs)因其多向分化能力(可生成軟骨細胞、成骨細胞和脂肪細胞)及免疫調節特性,成為骨科再生治療的重要候選。其來源廣泛,包括骨髓、脂肪組織、滑液及臍帶血等。
MSCs主要通過旁分泌作用釋放生長因子、抗炎因子(如IL-10、TGF-β)及細胞外基質成分,抑制炎癥并激活內源性祖細胞以促進軟骨修復和骨再生。同時,MSCs通過調控T細胞、B細胞及巨噬細胞等免疫細胞功能,抑制過度炎癥反應。
- 如在骨關節炎中通過外泌體誘導巨噬細胞向抗炎M2表型極化,從而緩解疾病進展。
- 在骨折領域,缺氧誘導的MSC外泌體(如miR-126)可激活內源性修復;
- 在骨肉瘤術后,其通過MT1G調控氧化應激促進骨再生。
此外,同種異體MSC的‘即用性’與胎兒MSC的高增殖特性,進一步拓展了臨床適用場景,但需解決細胞存活與功能維持問題。
這些特性使其在慢性炎癥驅動的骨科疾病中展現出獨特治療潛力。基于MSC的骨科疾病療法在臨床前研究和早期臨床試驗中已顯示出良好的效果。
間充質干細胞在治療骨關節炎的應用
MSC正被視為OA的潛在療法,2016及2019年的I/II期臨床試驗顯示其可緩解疼痛并改善功能。然而,仍然存在諸如炎性關節中細胞存活率低和治療持續時間有限等挑戰。
兩項臨床研究強調了干細胞治療骨關節炎輸送部位的重要性。
2020年,在一項研究中,雙側膝關節OA患者通過關節內 (IA) 注射或直接向軟骨下骨病變部位注射BMSC。15年后,IA組70%的膝關節需要全膝關節置換術 (TKA),而軟骨下組只有20%,這強調了BML(骨髓病變)靶向治療在預防OA進展中的作用。
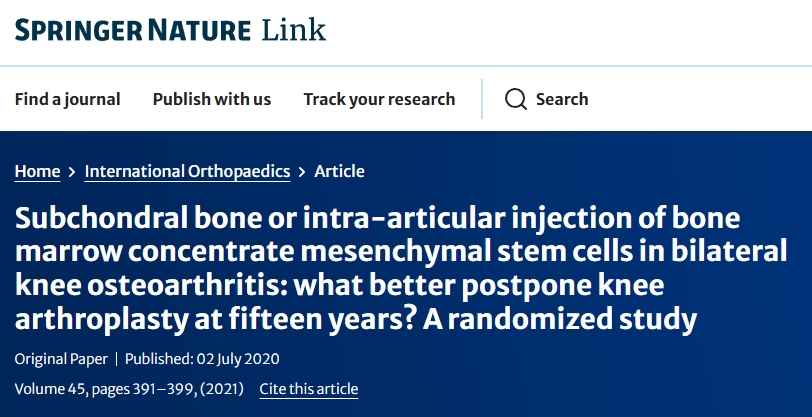
同年,另一項針對140例晚期OA患者的研究比較了軟骨下BMSC移植與全膝關節置換術(TKA) 。15年后,兩組的膝關節評分(約80分)和TKA發生率(約1%/年)相似,這表明BML再生可使膝關節置換術延遲十多年。這些發現強調了BMSC治療的潛力以及軟骨下骨在OA治療中的關鍵作用。

間充質干細胞在骨折與骨科腫瘤治療中的應用
間充質基質細胞(MSC)在骨折治療中展現出顯著潛力,尤其針對骨不連或大段骨缺損的復雜病例。研究表明,缺氧條件下MSC分泌的外泌體可通過傳遞miR-126促進骨愈合,而其旁分泌作用還能刺激內源性修復機制。
在骨科腫瘤領域,MSC不僅參與術后骨再生(如骨肉瘤骨缺損修復),還通過調控腫瘤微環境發揮雙重作用:例如,金屬硫蛋白1G(MT1G)通過調節抗氧化狀態影響MSC分化與骨再生,成為骨肉瘤的潛在治療靶點;MSC衍生的外泌體還可作為納米載體靶向遞送阿霉素,通過SDF1-CXCR4軸增強化療效果。
2、軟骨細胞療法的應用與臨床實踐
基于軟骨細胞的療法通過移植自體或同種異體軟骨細胞修復受損軟骨,成為治療局灶性軟骨缺損(尤其是年輕患者)的重要策略。典型流程包括從非負重區獲取健康軟骨細胞,體外擴增后回植至損傷區域,以恢復軟骨結構與功能,延緩關節退變。
自體軟骨細胞植入(ACI)及其改良技術(如基質輔助軟骨細胞植入MACI)已成功應用于膝關節大范圍軟骨損傷,顯著改善關節功能并減少疼痛,同時降低免疫排斥風險,為骨關節炎患者延緩關節置換提供可能。
技術局限與支架材料的創新
該療法仍面臨挑戰,如手術需分步操作、供體部位并發癥及新生軟骨機械性能不足等問題。為解決這些限制,支架材料(如天然聚合物、合成水凝膠、脫細胞組織及絲素蛋白基材料)被廣泛開發,以模擬軟骨生物力學特性并提供結構支撐。3D生物打印技術進一步優化支架設計,增強細胞分布與組織再生效率。此外,聯合間充質干細胞(MSC)或誘導多能干細胞(iPSC)的策略,可通過協同作用提升軟骨再生質量與長期療效。
體外培養挑戰與再生效果爭議
關鍵瓶頸在于體外擴增過程中軟骨細胞的去分化傾向,導致其喪失合成軟骨特異性基質(如Ⅱ型膠原)的能力,且細胞數量難以滿足臨床需求。此外,再生組織的性質存在爭議:部分研究觀察到透明樣軟骨形成,但多數新組織更接近纖維軟骨,其力學性能與耐久性顯著低于天然軟骨。這引發對療法本質的探討——是真正實現再生,還是僅促進纖維性修復。
未來需聚焦維持細胞分化狀態、優化擴增技術及精準評估再生效果,以推動該療法的臨床轉化。
3、工程化免疫細胞療法的概念與骨科應用潛力
工程化免疫細胞療法(如CAR-T、CAR-NK、CAR-M)通過基因改造賦予免疫細胞精準靶向能力,成為骨科疾病治療的新興方向。傳統上用于癌癥免疫治療的CAR-T細胞(如靶向GD2的CAR-T)已在骨肉瘤、尤文氏肉瘤等骨科腫瘤中展現出臨床潛力,I期試驗證實其安全性與可行性。
此外,這類細胞還可通過靶向炎癥巨噬細胞或促退變分子(如MMP、RANKL),調控骨關節炎等疾病的炎癥微環境,兼具抗炎與促修復雙重功能,為骨科疾病提供多維度干預策略。
CAR技術在不同免疫細胞中的機制拓展
CAR-NK細胞通過增強自然殺傷細胞的細胞毒性,靶向清除慢性炎癥中的異常免疫細胞,同時激活間充質干細胞(MSC)等再生細胞活性,協同促進組織修復。
CAR-M(工程化巨噬細胞)則聚焦巨噬細胞表型調控,通過促使其從促炎M1型向抗炎M2型極化,釋放VEGF、PDGF等生長因子,驅動血管生成與膠原合成,加速骨與軟骨愈合。這類療法通過精準干預免疫微環境,平衡炎癥消退與組織再生,為骨科退行性疾病和腫瘤術后修復提供新思路。
臨床轉化挑戰與未來方向
盡管CAR-T在骨科腫瘤中已進入臨床試驗階段(如NCT03635632針對GD2陽性骨肉瘤),但其在非腫瘤性骨科疾病(如骨關節炎)的應用仍處于探索期。
未來需優化靶點選擇(如針對軟骨降解通路分子),并解決工程化細胞在復雜骨微環境中的持久性與安全性問題。同時,結合多組學技術解析免疫細胞-組織互作網絡,開發智能化調控策略(如可誘導開關CAR系統),將是推動該療法從腫瘤向廣泛骨科疾病拓展的關鍵。
4、iPSC在軟骨修復與疾病模型中的潛力
誘導性多能干細胞(iPSC)憑借其無限增殖能力和多向分化特性,成為再生醫學的革命性工具。通過重編程患者體細胞獲得的iPSC,可定制化為患者特異性軟骨細胞或成骨細胞,避免免疫排斥并構建個體化治療策略。
在軟骨修復領域,iPSC衍生的軟骨細胞不僅為骨關節炎等疾病提供功能性修復潛力,還可作為研究軟骨退變機制及藥物篩選的精準模型。例如,利用骨關節炎患者來源的iPSC分化軟骨,可模擬病理進程并探索靶向治療。
iPSC在骨再生與復雜骨科難題中的應用前景
iPSC在骨組織工程中同樣展現突破性潛力,其分化的成骨細胞可高效促進骨缺損修復。臨床前研究證實,iPSC衍生成骨細胞聯合生物支架可顯著提升骨再生效率,其宿主整合性優于傳統療法。
未來需結合基因編輯與生物材料技術,優化iPSC定向分化流程,并建立嚴格的安全性評估體系,以推動其在骨科疾病中的轉化落地。
如上文所述,目前已開發出一系列基于細胞的療法來治療骨科疾病,每種療法都具有獨特的機制和治療潛力。為了全面評估這些方法的優勢和局限性,有必要對幾種關鍵療法進行比較分析,包括MSC療法、軟骨細胞療法、免疫細??胞療法(特別是針對骨肉瘤的CAR-T細胞療法)和iPSC療法。通過這種比較,可以全面評估它們在促進組織再生、靶向腫瘤和實現最佳治療效果方面的有效性(表2)。
| 方面 | 間充質干細胞治療 | 軟骨細胞療法 | 免疫細胞療法 | 誘導多能干細胞治療 |
|---|---|---|---|---|
| 細胞來源 | 骨髓、脂肪組織、臍帶等。 | 軟骨組織(自體或同種異體) | 免疫細胞(如T細胞、巨噬細胞) | 患者來源的體細胞重編程為iPSC |
| 分化潛力 | 多能性,可分化為軟骨、骨或脂肪組織 | 已經分化為軟骨細胞 | 無分化;直接針對免疫調節 | 多能性,可分化為任何細胞類型,包括軟骨細胞 |
| 主要機制 | 通過分化和旁分泌信號進行再生和修復 | 直接再生軟骨組織 | 調節炎癥并促進修復 | 生成用于移植的功能細胞 |
| 目標疾病 | 骨關節炎、骨缺損、軟骨損傷 | 軟骨損傷、骨軟骨缺損 | 自身免疫相關骨科疾病、炎癥相關損傷 | 骨關節炎、軟骨和骨再生 |
| 臨床應用 | 經過廣泛研究,一些療法已進入臨床試驗或獲得批準 | 已在臨床應用中證實(例如 ACI) | 新興,僅限于臨床前/早期試驗 | 實驗性,主要在臨床前研究 |
| 優勢 | 易于收獲,具有免疫調節特性,無腫瘤發生風險 | 高度針對軟骨修復,臨床已證實的方法 | 針對免疫驅動的炎癥和TME調節 | 高分化潛能,可產生無限的細胞供應 |
| 挑戰 | 分化效率有限,在惡劣環境中生存能力差 | 增殖潛力有限,供體部位發病率 | 成本高、脫靶效應、工程復雜 | 腫瘤發生風險、高成本、倫理問題 |
| 監管狀況 | 一些療法已獲批準;其他療法正在評估中 | 完善的臨床指南 | 臨床前和早期試驗 | 實驗性,面臨嚴格的監管審查 |
細胞療法通過免疫調節與再生機制修復骨科疾病
炎癥與再生的動態平衡調控:骨科修復與再生的核心挑戰在于精準調節免疫微環境,平衡促炎與抗炎反應以實現有效愈合。急性炎癥初期清除損傷碎片并啟動修復,但過度或慢性炎癥(如TNF-α、IL-1β持續升高)會加劇軟骨退化、骨愈合延遲及術后纖維化。抗炎因子(如IL-10、TGF-β)及調節性T細胞(Treg)通過抑制過度炎癥、促進細胞遷移分化,營造有利于組織再生的微環境。
- 在骨關節炎、骨折及腫瘤術后修復中,調控這一平衡成為優化細胞治療的關鍵,例如靶向促炎信號或增強抗炎通路,以同步抑制病理損傷并激活再生潛能。
TLR3的雙重免疫調節功能:Toll樣受體3(TLR3)作為模式識別受體,通過感知損傷相關雙鏈RNA激活NF-κB和IRF3通路,驅動促炎因子及I型干擾素釋放,在骨科疾病中呈現矛盾作用:一方面加劇骨關節炎的軟骨退變與炎癥,另一方面通過增強間充質干細胞(MSC)的遷移、分化能力促進軟骨修復。
- 例如,TLR3激動劑預處理MSC可提升其軟骨發生效率,而靶向抑制TLR3則能緩解炎癥性關節損傷。這種雙重性使其成為精準免疫調節的潛在靶點——通過時空特異性干預,既可抑制病理炎癥,又能利用其再生增強效應,為骨科疾病治療提供“雙向調控”新策略。
結論與觀點
綜上所述,細胞療法在骨科疾病治療方面取得了顯著進展,為骨關節炎、軟骨退化、骨折以及骨肉瘤、軟骨肉瘤和尤文氏肉瘤等骨科腫瘤提供了潛在的解決方案。這些療法能夠促進組織修復、恢復功能并減輕炎癥,為主要控制癥狀的傳統療法提供了一種有前景的替代方案。
未來研究需聚焦四大核心問題:
- 如何優化細胞存活與功能(如通過基因編輯或生物材料增強耐受性);
- 如何精準調控免疫微環境以平衡促修復與抗炎(如靶向TLR3時空特異性激活);
- 如何建立標準化細胞制備流程以實現規模化應用;
- 以及如何解析再生相關分子網絡以設計靶向增強策略。整合免疫調節(如Treg細胞干預)、分子靶向(如抑制IL-1β/TNF-α)與新興技術(3D生物打印、AI驅動細胞篩選)將成為提升療效的關鍵。
個性化治療與臨床轉化愿景
總而言之,盡管細胞療法在骨科疾病和腫瘤治療中前景廣闊,但克服剩余挑戰仍需要多學科合作。整合免疫調節、先進技術以及對分子通路的深入理解,將是增強這些療法療效和取得更佳臨床療效的關鍵。骨科疾病和腫瘤治療的未來很可能是個性化、定制化的治療方案,將細胞療法、免疫調節和新興技術的優勢結合起來,為患者提供最佳解決方案。
主要參考資料:
[1]Wang J, Xu S, Chen B, Qin Y. Advances in cell therapy for orthopedic diseases: bridging immune modulation and regeneration. Frontiers in Immunology. 2025 ;16:1567640. DOI: 10.3389/fimmu.2025.1567640. PMID: 40276505; PMCID: PMC12018241.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信