盡管雙相情感障礙和重度抑郁癥等情緒障礙在全球普遍存在,但其發病機制在很大程度上仍被誤解。情緒穩定劑和抗抑郁藥雖然對某些人有用且有效,但對這些疾病患者的反應率并不高。對這些藥物反應不佳的原因之一是患者的異質性,即與遺傳學、病因學和環境有關的患者特征的多樣性會影響治療。
在過去二十年里,新型誘導多能干細胞(iPSC)研究和技術使人源腦細胞成為研究人類疾病的新模型,有助于解釋患者的差異。人類iPSC技術是一種新興工具,可用于更好地了解這些疾病的分子機制,同時也是測試新型療法和現有藥物的平臺。
人類干細胞探索發現情緒障礙(雙相情感障礙-重度抑郁癥)的治療方案
本文獻綜述介紹了誘導多能干細胞技術在雙相情感障礙和重度抑郁障礙模型中的應用、治療這些障礙的常用藥物、過去發表的針對無應答患者的新型患者衍生替代治療方法,以及從這些模型中獲得的新數據。
介紹
2006年,山中伸彌和他的研究生高橋和俊發現了如何將小鼠成纖維細胞轉化為誘導多能干細胞(iPSCs)。隨后不久,研究人員又發現人類皮膚細胞也可以重編程為iPSCs。
隨著時間的推移,研究人員能夠將人類誘導多能干細胞(iPSCs)誘導分化成其他細胞類型,如神經元祖細胞(NPCs)和神經元,為研究特定疾病(如重度抑郁障礙(MDD)或雙相情感障礙(BD))的神經疾病發病機制和目標細胞類型提供了工具。
通常無法獲得的細胞,如情緒障礙患者的神經元,現在可以利用源自血液和皮膚等體細胞組織的iPSC重編程技術生成。由于對情緒障礙的細胞和分子病理學缺乏了解,導致診斷工具效率低下,患者無法獲得現有的治療方案。
iPSC技術有助于探索這些疾病的分子機制和病因,并對替代治療方法進行無創測試。使用源自患者的細胞作為人類疾病模型,可促進探索替代治療方案,以治療那些對傳統藥物治療無反應或不能耐受的患者。對于情緒障礙而言,由于患者的多樣性和基因組學相關因素,藥物反應性可能存在很大差異。利用源自患者的iPSC模型探索這些差異有助于闡明藥物療效,了解與用于個體化治療情緒障礙的藥物相關的細胞通路。
本綜述探討了使用誘導多能干細胞技術研究雙相情感障礙和重度抑郁癥細胞病理學的歷史,以及使用常見藥物治療這些疾病的研究(圖1和表1、表2)。
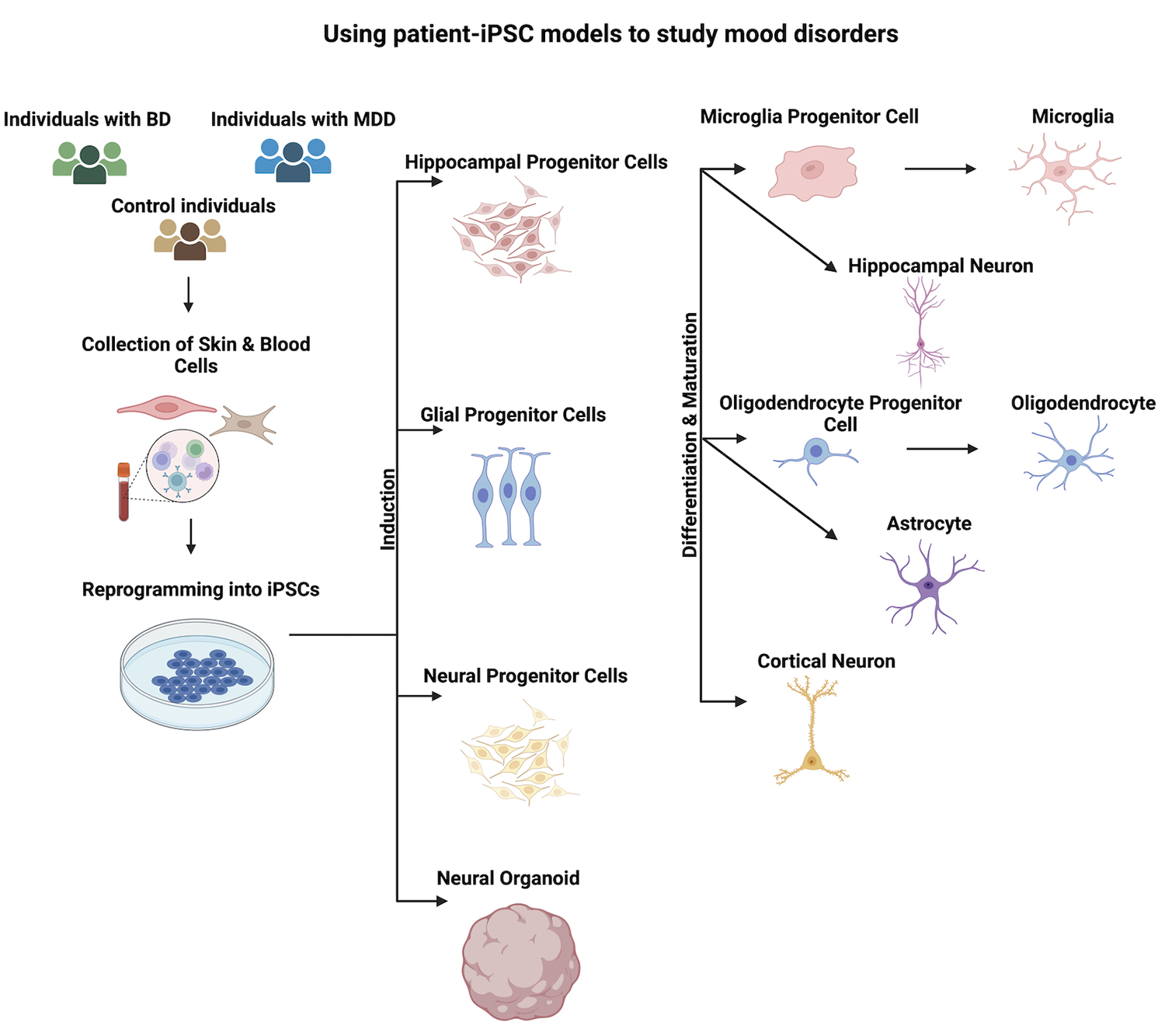
雙相情感障礙 (BD)
雙相情感障礙(BD)是一種精神病學診斷,適用于持續出現情緒波動和躁狂、躁郁和重度抑郁發作等癥狀的人。它通常被描述為一種情緒障礙,主要分為兩種類型:I型和II型。I型與較高的躁狂發作發生率相關,而II型則強調較高的抑郁發作可能性。
在診斷上,雙相情感障礙還有其他亞型,如物質/藥物誘發的雙相情感障礙和周期性雙相情感障礙。躁郁癥影響著數百萬人,約占全球人口的2%。躁郁癥被認為會在個體發育的早期影響神經元的正常成熟,盡管報告的平均發病年齡約為20歲。
迫切需要找到可行的雙相情感障礙診斷和治療替代方案,因為雙相情感障礙可能導致比情緒波動和抑郁發作更嚴重的健康并發癥。患有雙相情感障礙的人在青年和成年期患心血管疾病的可能性更高以及導致糖尿病和高血壓的慢性炎癥。雙相情感障礙還會損害認知能力,包括記憶力、反應時間和執行功能。
抗精神病藥物也與雙相情感障礙患者的認知障礙有關這些損傷會導致殘疾,對個人造成不利影響,影響個人生活的經濟、家庭和社會方面。調查數據顯示,對于那些患有雙相情感障礙的人來說,從癥狀出現到獲得診斷和治療方案之間的時間間隔約為五年。
躁郁癥與遺傳和環境風險因素相關,如家族病史和童年創傷。躁郁癥也是遺傳率最高的精神疾病,發病率約為85%。對有躁狂癥病史的家庭進行的研究發現,遺傳風險因素與躁狂癥的發展有關。這些遺傳風險因素并不是雙相情感障礙的明確生物標志物,但卻提供了對該疾病的病因和發病機制的深入了解,指出了該疾病在神經元發育過程中的早期作用。躁郁癥在大腦中的表現似乎依賴于涉及細胞信號通路、鈣信號、炎癥反應、組蛋白和免疫通路以及微RNA和激素通路的基因失調。
在下一節中,我們將討論雙相情感障礙的iPSC模型案例研究,并在使用以人為本的方法對情緒障礙進行建模的更大框架下對這些研究進行背景分析,以及這些研究如何解決雙相情感障礙治療、發病機制和神經生物學方面的認識差距。
01利用誘導多能干細胞建立雙相情感障礙模型
Chen等人的論文是利用iPSCs建立BD模型的首批研究之一。他們研究了一組確診為BD患者的iPSCs的發育途徑和細胞行為,并與健康人進行了對比,發現與對照組神經元相比,患者來源的神經元表達了更多的膜受體和離子控制基因。這些基因的失調會影響中樞神經系統(CNS)的功能和鈣信號轉導,這進一步證明了建立模型以研究受該疾病影響的發育途徑的必要性。
隨后的一項研究支持了之前的結果,發現與對照組相比,BD患者的離子通道表達增加,患者的NPCs和神經細胞在Wnt和GSK3信號通路中顯示出變化。
一些證據表明,炎癥信號傳遞失衡與BD之間存在聯系。BD患者患有心血管疾病、糖尿病和與免疫相關的 “代謝綜合征 “等炎癥并發癥的比例較高。
Vadodaria等人比較了一組健康人和BD患者的整個轉錄組,發現與對照組相比,BD患者iPSC衍生的星形膠質細胞中白細胞介素-6(IL-6)這種促炎癥細胞因子上調。隨后,BD星形膠質細胞對另一種促炎細胞因子–白細胞介素-1b(IL-1b)的反應顯示了對炎癥的獨特轉錄反應,IL-6的分泌進一步增加,直接對共培養神經元的活性產生了負面影響。
這些研究支持這樣一種假設,即在BD患者的早期胎兒大腦發育過程中,炎癥系統相關基因的表達會發生失調,從而導致神經元功能受損。這些發現共同凸顯了研究抗炎化合物作為BD輔助治療方法的巨大潛力。
我們的結果表明,IL-1b或TNF-a促炎刺激物增加了對照組和BD組中表達IL-6的星形膠質細胞的百分比,而芹菜素治療可逆轉這一現象(圖2B和2C)。如之前觀察到的,雙相情感障礙星形膠質細胞的促炎反應明顯高于對照組(圖2B和2C)。這些數據為探索抗炎化合物作為治療雙相情感障礙的補充治療方法提供了令人信服的證據。
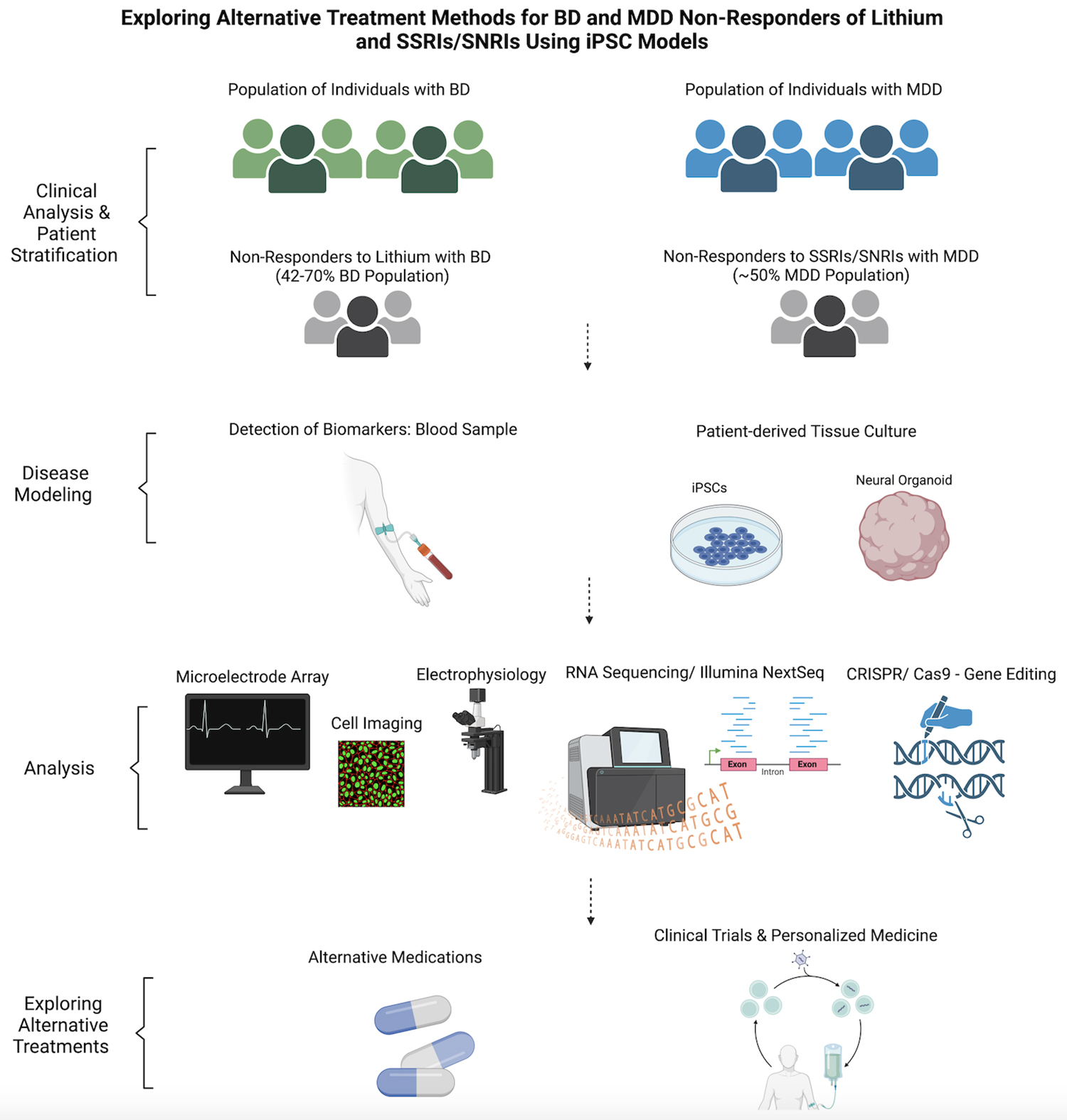
圖2:芹菜素更有效地減弱了BD患者iPSC衍生星形膠質細胞的炎癥反應。
02利用誘導多能干細胞了解鋰治療雙相情感障礙的方法
鋰 (Li) 是一種常用的處方情緒穩定劑,已用于治療躁郁癥超過70年,但在iPSC建模之前,研究人員尚不清楚它如何減少某些雙相情感障礙患者的躁狂發作的機制。
Malhi等人的BD的iPSC模型表明,鋰在某些患者中起作用,因為它可以挽救細胞水平上關鍵過程的失調。
重要的是,對鋰治療有反應的BD神經元系子集來自在臨床環境中也對鋰治療有反應的BD患者,這證實了患者的藥物反應可以在體外疾病建模環境中使用患者衍生的細胞重現。
總結:由于鋰對某些BD患者有效,但對其他患者無效,當用鋰治療時,只有對鋰有反應者得以挽救。此外,與對照NPC相比,BD NPC中具有高線粒體膜電位 (MMP) 的細胞較少,這表明細胞活力是鋰反應的一個重要方面。使用iPSC模擬鋰反應途徑已被證明有助于拼湊雙相情感障礙所涉及的機制和該疾病的治療。BD的IPSC模型還強調了對治療該疾病的某些處方藥(如鋰)沒有反應的人群。
03探索使用誘導多能干細胞治療雙相情感障礙的替代療法
雖然鋰有助于減少躁狂發作的發生,但它的副作用可能會導致長期的胃腸道損傷,并且該藥物對患有急性躁郁癥(一種不太嚴重的BD表現)的患者有效。此外,一旦患者接受診斷治療,他們可能不會出現癥狀減輕,因為藥物的有效性因遺傳學和神經生物學的不同而不同。因此,迫切需要探索除鋰之外的替代藥物及其對BD患者的影響。
使用iPSC使研究人員能夠在不對患者造成潛在傷害或負擔的情況下測試藥物的有效性,并為探索治療BD的其他藥物提供體外見解。例如,一項研究觀察了線粒體呼吸以及三種情緒穩定劑(鋰、丙戊酸鈉和拉莫三嗪)對鋰應答者、鋰無應答者和未接受治療者的iPSC模型的影響。這三種藥物都誘導了一種轉錄特征,主要在核糖體和氧化磷酸化途徑中得到增強。
研究人員指出,接受鋰治療的響應者NPC具有更好的耗氧率。當暴露于丙戊酸時,未接受治療的NPC表現出最大呼吸和儲備能力,從而產生更好的耗氧率。
一項研究博爾托拉斯奇等人發表了一份報告,利用iPSC衍生的神經元和星形膠質細胞,通過在接觸BD藥物后產生基因表達特征來篩選與BD相關的靶基因,并發現曲美他嗪在他們的分析中是合適的匹配。
眾所周知,這種藥物可以作用于人體的代謝過程,并有增加三磷酸腺苷 (ATP) 產生的趨勢,ATP被認為是BD缺陷的一個組成部分。已發表的研究報告稱,BD患者的線粒體呼吸功能存在異常,已知該通路受曲美他嗪的影響。盡管Bortolasci及其同事并未嚴格重現iPSC模型中的藥物暴露情況,但研究團隊能夠證明,接觸曲美他嗪可減輕大鼠的BD樣癥狀,顯示出iPSC建模有望解決BD治療計劃中的差距。
一些研究呼吁使用iPSC模型,強調了探索BD替代療法的必要性和實用性。這些模型提供了寶貴的見解,讓我們了解情緒穩定劑反應的信號通路,以及鋰反應者和無反應者在細胞過程中存在的差異,例如線粒體呼吸。
重度抑郁癥(MDD)
重度抑郁癥給個人帶來的成本和負擔非常大,但最緊迫的可能是,MDD是一些國家自殺的主要原因。MDD的傳統診斷過程始于患者被轉診給有執照的專業人士,診斷依據是患者情緒變化和抑郁發作時間超過14天。這些發作極有可能在人的一生中反復發生,但可以通過藥物、治療和其他綜合和持續的醫療干預來緩解。
全球研究表明,青春期后女性患MDD的可能性是男性的兩倍。類似研究發現,MDD的平均發病年齡約為25歲。跨國研究指出,患有MDD的個體存在特定風險因素,包括近期經歷過創傷和不良生活事件。

經歷過童年創傷的人患MDD的可能性是正常人的兩倍,慢性壓力也是導致重度抑郁癥的一個重要風險因素,了解MDD患者的神經生物學、遺傳學和環境之間的相互作用對于獲得更有效、更便捷的治療方案至關重要。
目前,關于MDD在個體中如何發展以及導致該疾病的原因的共識是遺傳、心理和環境因素共同作用的結果。
MDD作用于大腦,最顯著的是影響前腦區域的神經遞質和突觸活動的過程。血清素、去甲腎上腺素和多巴胺等神經遞質對于調節中樞神經系統 (CNS) 至關重要。SSRI(選擇性血清素再攝取抑制劑)和SNRI(血清素和去甲腎上腺素再攝取抑制劑)是用于治療MDD的常用抗抑郁藥,它們作用于神經遞質并能改變突觸活動。
然而,約有一半的MDD患者對抗抑郁藥物沒有反應,并且還受到導致該疾病的進一步風險因素的影響,這促使研究人員研究受影響個體的替代治療方法。
被診斷患有MDD的患者中,很大一部分被認為具有遺傳易感性,因為在某些情況下,MDD甚至會影響整個家庭。基因研究表明,MDD與其他精神疾病相關的基因有顯著的重疊。重度抑郁癥的遺傳學揭示了個體的多基因風險評分,但沒有通過個人基因提供官方的治療或診斷方式。
以下部分詳細介紹了患者來源的iPSC神經元建模如何成為研究MDD藥物反應和潛在治療方法的途徑,并可能深入了解患有或不患有該疾病的個體之間的神經生理學差異。
04利用誘導多能干細胞建立重度抑郁癥模型
有關抑郁癥的iPSC研究的早期重點是捕捉與抑郁癥相關的風險因素(如炎癥和慢性壓力)的影響,通常使用暴露于皮質醇和地塞米松作為在健康人的海馬祖細胞(HPCs)中建立抑郁癥模型的手段。
一項研究發現,當比較暴露于低劑量和高劑量皮質醇對海馬祖細胞的影響時,細胞增殖增加了16%,神經發生減少,但星形膠質細胞分化沒有增加。眾所周知,糖皮質激素會在模擬壓力和類似抑郁情景的大鼠模型和MDD患者的血液樣本中增加,過多的糖皮質激素會阻止神經發生。
Anacker等人利用HPCs發現,血清和糖皮質激素調節激酶1(SKG1)確實在調節皮質醇暴露所帶來的影響方面發揮作用,這表明抑制SKG1可能是未來治療抑郁癥患者的一種可能途徑。
Heard等人的一項研究發現,當長期暴露于皮質醇時,來自多發性硬化癥患者的神經膠質細胞(星形膠質細胞)與無病史的患者相比,具有大量不同表達的基因。多發性硬化癥患者的不同調控基因與G蛋白偶聯受體(GPCR)、配體結合、突觸信號轉導和離子穩態有關。這些數據突顯了星形膠質細胞在慢性應激條件下的中樞神經系統中的重要作用。抑郁癥患者體內會誘發促炎癥細胞因子白細胞介素-1b(IL-1b),而抑郁癥與炎癥和神經發生減少有關。
使用iPSC研究調節炎癥誘發抑郁癥的途徑的趨勢也出現在一系列實驗中。
Borsini及其同事的其他研究表明,將人類海馬祖細胞暴露于抑郁癥患者的血清中,會誘導細胞凋亡,并且神經發生率會低于暴露于非抑郁癥患者的血清,并且這些影響在用干擾素-a治療后會加劇。隨后,作者還評估了IL-6的雙峰作用,即對人類海馬干細胞系具有促炎和抗炎作用,這取決于其濃度水平以及周圍環境中其他促炎細胞因子的共存情況。總之,這些結果為個體的系統環境在炎癥調節海馬神經發生及其對神經精神狀況的影響中的作用提供了證據。
05使用SSRI、SNRI和iPSC了解重度抑郁癥
研究MDD治療途徑的一個重要依據是記錄SSRI藥物對人類神經元模型影響的實驗。
一項使用hAD-SCs(人脂肪衍生干細胞)進行的研究發現,舍曲林(SSRI)可促進細胞增殖,但不會促進這些培養物的神經膠質生成。與之前的研究不同,Razavi等人沒有檢測到對MAP2陽性神經元的影響。一項類似的實驗注意到了某些抗抑郁藥對細胞增殖和分化的挽救作用,該實驗測試了一種名為帕羅西汀的常用抗抑郁藥對hAD-SCs的作用。他們的研究結果表明,帕羅西汀確實改變了整個細胞培養過程中的增殖率,導致了神經元分化,而且暴露于帕羅西汀誘導了Nestin和MAP2陽性神經元的整體增加,以及膠質酸性纖維蛋白(GFAP)陽性細胞的減少。
Horowitz等人(2015年)的一項研究使用IL-1b作為炎癥刺激物,比較了抗抑郁藥和脂肪酸對HPCs炎癥免疫反應的調節能力。文拉法辛(SNRI)和二十碳五烯酸(EPA)具有抗炎作用。這些研究結果提醒人們,進一步確定單胺類抗抑郁藥和脂肪酸的作用機制對于了解抑郁癥患者的免疫過程至關重要。
Zhong等人(2020年)對一種常見的SSRI所產生的發育神經毒性很感興趣,他們利用從人類iPSCs衍生的已建立的腦器官模型證明,帕羅西汀(SSRI)影響了神經毒性的幾個方面,包括與對照組相比,處理細胞中少突膠質細胞的數量差異,以及神經元生長特性和突觸標記表達的減少。此外,細胞數量減少了40%-75%之間,神經元生長和突觸標記表達的減少分別約為60%和80%。這項研究概述了一種利用人體細胞條件測試胎兒發育過程中抗抑郁藥神經毒性的可靠模型。
利用SSRIs和iPSCs來了解MDD的治療機制很有見地,但對這些傳統治療方法無反應的人群也為利用新型人體組織培養技術發現藥物提供了一條途徑。
06探索利用誘導多能干細胞治療重度抑郁癥的替代療法
通常,患者必須嘗試多種藥物組合才能持久緩解MDD癥狀。抗抑郁藥的副作用和低反應率凸顯了患有MDD的人需要替代治療方案。難治性抑郁癥(TRD)一種對其他藥物沒有反應的重度抑郁癥患者。診斷與患者的慢性壓力和大腦結構可塑性失調有關。然而,使用氯胺酮作為難治性抑郁癥患者的治療選擇,在緩解MDD癥狀方面取得了一些成功,這鼓勵了研究人員使用iPSC模型來了解該藥物與其他化合物相比對無反應者的效果。
患者通常需要嘗試多種藥物組合才能持久緩解MDD癥狀。抗抑郁藥的副作用和低反應率凸顯了為MDD患者提供替代治療方案的必要性。耐藥性抑郁癥(TRD)指對其他藥物治療無效的MDD患者,與長期壓力和受影響者大腦結構可塑性失調有關。不過,將氯胺酮作為治療耐藥性抑郁癥患者的一種選擇,在解決MDD癥狀方面取得了一些成功。這促使研究人員使用iPSC模型來了解這種藥物與其他化合物相比對無應答者的影響。
Cavalleri等人發現,氯胺酮確實增加了小鼠和人類iPSCs衍生的多巴胺能(DA)神經元的結構可塑性。根據觀察和先前的研究結果,研究人員一致認為,氯胺酮暴露能夠進入由a-氨基-3-羥基-5-甲基-4-異惡唑丙酸受體(AMPAR)誘導的腦源性神經營養因子(BDNF)和哺乳動物雷帕霉素靶標(mTOR)信號轉導的通路,進而影響小鼠和人類DA神經元的結構神經可塑性。
卡瓦萊里等人發現氯胺酮的有效性與完整的D3多巴胺受體之間存在相關性,從而產生抗抑郁作用。羅匹尼羅和普拉克索這兩種藥物通常用于治療帕金森病患者,它們被認為作用于D2和D3受體,可能在調節結構可塑性方面發揮作用,可能為TRD患者提供緩解,類似于氯胺酮暴露的效果。
探索MDD的影響和機制的研究,特別是在難治性抑郁癥中,已經顯示出對各種化合物的應用方式和測試藥物反應性的方式的理解有所增加,這些化合物可用于之前被標記為“無反應者”的患者。
討論與結論
BD和iPSC研究的傳統始于使用BD患者的細胞系直接模擬該疾病,并比較神經細胞與對照組的分子和功能差異。與此同時,研究人員對BD的遺傳風險因素也很感興趣,他們利用源自患者的iPSC株系對有該疾病病史的家族進行比較。
該領域的一個分支是利用iPSCs對治療BD的藥物(主要是鋰劑)所影響的通路進行建模,因為鋰劑具有持續的處方使用歷史和部分成功。利用iPSCs分析與BD相關的靶基因和替代治療方案,可以創建一個藥物有效性研究模型,而不會使參與者承受臨床試驗中的過重負擔(圖3)。
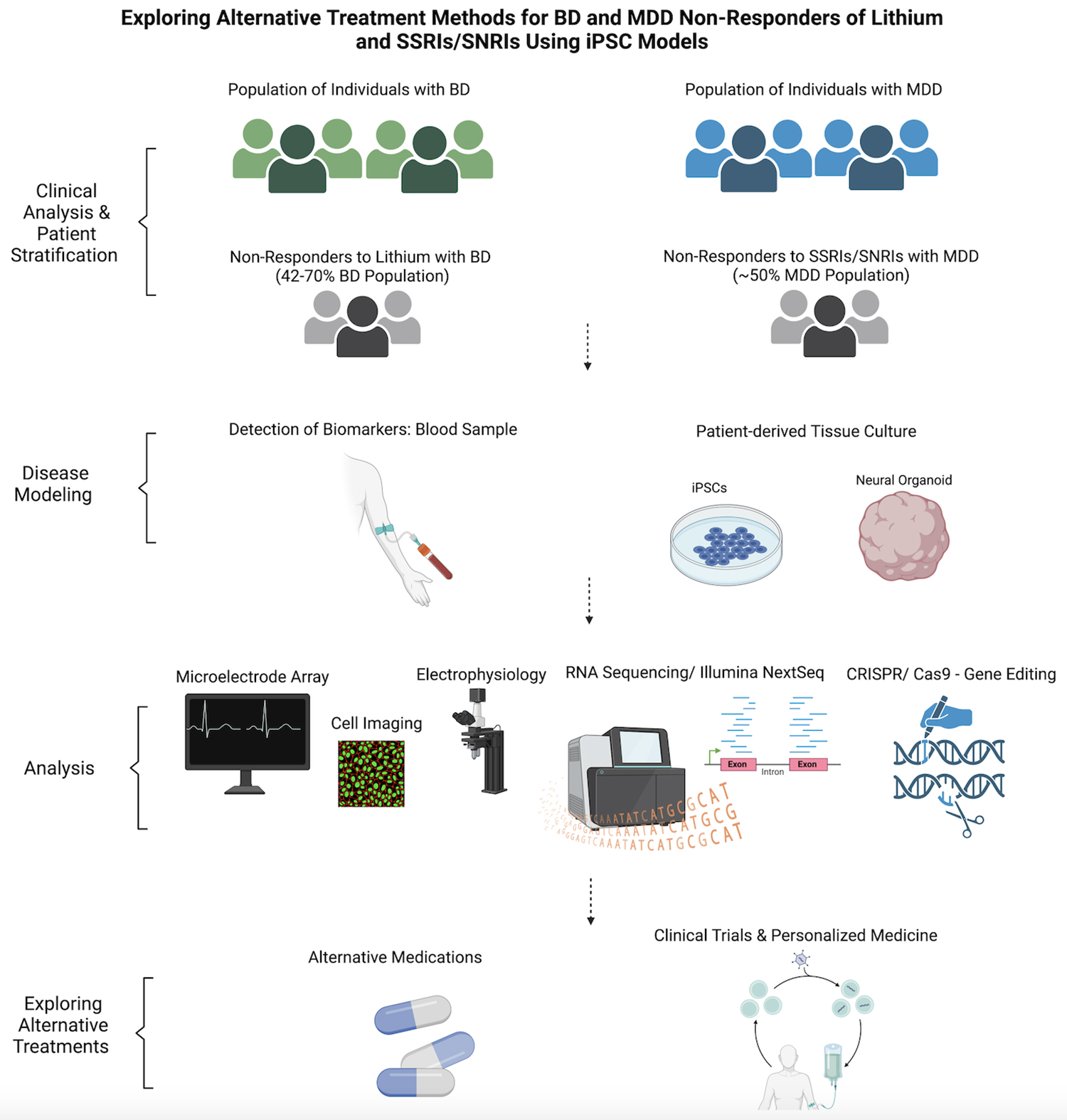
該圖描繪了研究人員用于探索除鋰和SSRI/SNRI之外的替代治療方法的途徑,用于對BD和MDD無反應患者進行治療,因為他們占同時患有這兩種疾病的人口的一半左右。從收集細胞開始,研究人員可以尋找與藥物反應相關的生物標志物,并建立可進行各種分析的患者個性化神經元模型。這些數據有助于探索已經上市的新化合物和替代藥物,從而減輕傳統治療方法無反應患者的痛苦。
使用iPSC建立BD模型的其他研究表明,炎癥在與該疾病相關的表型的表現和治療中發揮了作用,同時與對照組相比還存在各種分子和電生理學差異。最近,研究人員利用iPSC模型探索了針對BD患者的替代藥物治療方法,重點是鋰無應答者。此外,圖2中的新數據表明,利用芹菜素等抗炎化合物針對與BD相關的炎癥反應,可為該疾病患者提供另一種治療方法。
這項研究使用并比較了用SSRIs、SNRIs和其他與治療抑郁癥有關的化合物處理過的細胞,以調查無反應者、反應者和對照組在接觸不同化合物時的不同表現。動物模型和死后組織分析提供了大量信息,但iPSC模型為在人類和無害環境中測試BD和MDD的機制和治療方法提供了一條途徑(圖3)。
期待基于誘導多能干細胞建立的雙相障礙及抑郁癥的疾病模型能夠早日突破疾病病因學研究的瓶頸,為干細胞治療精神疾病的基礎研究和臨床治療帶來曙光。
參考資料:https://doi.org/10.1590/1678-4685-GMB-2023-0305
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信