二十一世紀,干細胞研究和治療技術取得了長足進步,全球范圍內開展了大量臨床前研究,支持了數千項人體臨床試驗。這些臨床前研究取得了令人鼓舞的結果,表明眾多干細胞療法具有廣泛的治療潛力。再生醫學研究中的新證據表明治療安全性,但其實際治療潛力、療效和作用機制仍需深入研究。此外,未經批準且監管不力的干細胞療法會給患者帶來風險,包括嚴重不良事件的風險,以及新再生醫學療法引入帶來的聲譽損害。向患者介紹干細胞療法背后的科學原理至關重要,這不僅能加深他們對干細胞療法的理解,還能防止不良療法的出現。
間充質干細胞的簡介:起源、表型鑒定和分離、免疫相容性
近日,期刊雜志“Cell Therapy”刊發了一篇“Mesenchymal Stem Cells”的文章。該文章章將對干細胞的多種特性和潛力進行基礎性理解,為深入探討其在再生醫學和生物醫學研究中的關鍵作用奠定基礎。本章將概述以間充質干細胞 (MSC) 為中心的人類損傷和疾病治療,包括人類多能干細胞的定義、歷史和臨床應用。

1、間充質干細胞的簡介
間充質基質/干細胞(MSCs)作為新興再生醫學療法的核心工具,目前主要被定位為調控炎癥過程的關鍵角色。盡管在動物疾病模型及早期人類I/II期試驗中顯示出廣泛療效,但后續更大規模的III期臨床試驗卻鮮能完全復現其在小規模研究中的顯著優勢。這一矛盾源于MSCs生物學特性的復雜性(如依賴炎癥環境激活免疫抑制功能)及臨床操作中的多重變量(包括給藥時機、劑量、遞送方式及細胞制劑類型),而后者又與細胞來源(自體或異體)、培養條件(新鮮/復蘇、氧濃度、傳代次數等)密切相關。
早期研究聚焦于MSCs向中胚層譜系(如脂肪細胞、軟骨細胞和成骨細胞)定向分化的能力。隨著技術進步,科學家發現MSCs可從多種器官(骨髓、腦、肺、肝等)及大血管(主動脈、腔靜脈)至微血管(腎小球)中分離擴增,揭示其分布與血管周圍微環境密切相關。這一發現重塑了MSCs的起源認知。
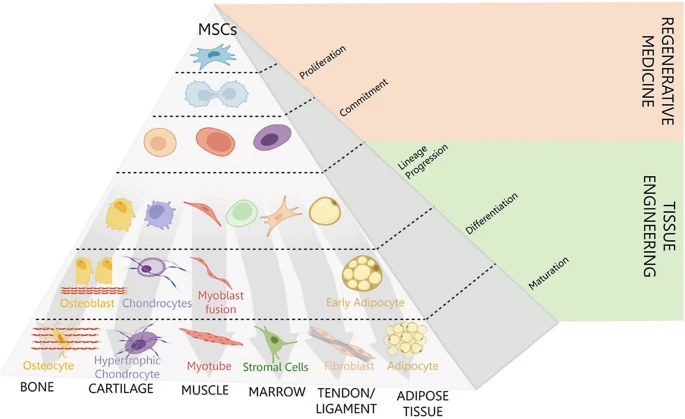
MSCs的命名始于20世紀80年代末Arnold I. Caplan提出的“間充質干細胞”概念,強調其從成人骨髓中分離擴增的多能性特征(圖1)。
后續研究逐步完善其定義,國際細胞治療學會(ISCT)更制定了MSCs鑒定的最低標準。最新證據表明,符合MSCs標準的細胞普遍存在于人體血管外膜層,其標志物(如CD146)與周細胞高度共定位,暗示二者在生物學上的深層聯系。這一發現為解析MSCs的再生機制提供了關鍵線索。
周細胞與MSCs的生物學關聯:Crisan等人發現,從不同組織分離培養的血管周圍細胞(周細胞)與骨髓來源的MSCs具有核心共性,包括標志性的中胚層多向分化潛能。這一關聯性進一步通過兩者的免疫表型相似性得到強化:周細胞表達典型的MSCs表面標志物(如CD90、CD73、CD105和CD44),且這些標志物在其原生組織中已存在,而非僅在培養條件下獲得。這一證據表明,MSCs與周細胞在發育起源上存在內在聯系,提示周細胞可能是MSCs的體內前體細胞。
MSCs功能定義的范式轉變:MSCs的重新定義還源于其獨特的治療機制:這些細胞能夠定向遷移至炎癥或損傷部位,并通過釋放高濃度營養因子與免疫調節因子發揮治療作用(圖2)。這一特性與傳統的多向分化能力關聯較弱,促使Caplan提出將MSCs更名為“藥用信號細胞”(Medicinal Signaling Cells),保留原縮寫以強調其核心功能從“干細胞分化”向“生物活性分子遞送”的轉變。盡管多能性仍是組織工程的重要基礎,但MSCs的免疫調節功能已開辟了獨立于分化的治療路徑,標志著其臨床應用范式的革新。
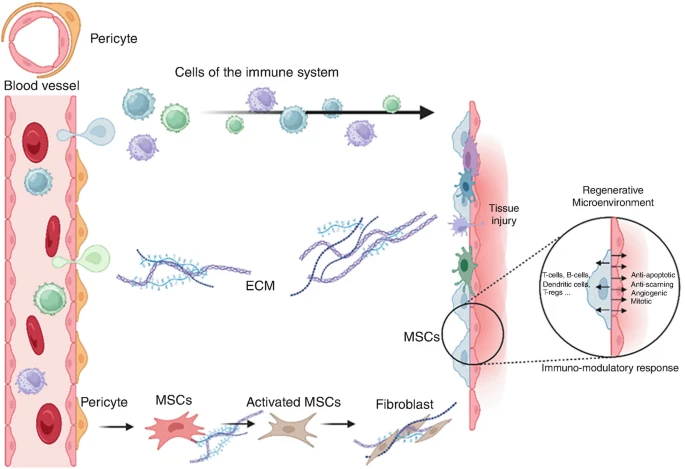
在生理條件下,MSCs/周細胞在維持組織健康方面發揮作用,并通過阻止不必要的免疫反應來維持體內平衡。組織損傷會導致已建立的周細胞-內皮細胞相互作用被破壞,從而導致血液外滲到組織中。免疫系統被激活,促使周細胞/MSCs向傷口部位遷移,被激活并進行劇烈增殖。
這些細胞分泌具有抗凋亡作用的生物活性分子,從而對抗免疫反應。最終,原位內皮細胞與循環祖細胞一起修復內皮及其相關的基底膜。部分細胞恢復其原始的周細胞表型以穩定血管,而另一些細胞則發生凋亡。一些細胞保持其原始的祖細胞狀態,位于周細胞和組織特異性細胞之間,并可能發生分化,尤其是在骨骼或肌肉等間充質組織中。
這項開創性的研究也修訂了干細胞可塑性的概念。可塑性是指干細胞在某些微環境條件下獲得受譜系限制較少的替代性細胞命運的能力。事實上,目前已鑒定出多種途徑,通過這些途徑,干細胞以及譜系定型細胞能夠獲得替代性細胞命運。例如,轉決定、轉分化、直接/間接分化以及融合。所有這些機制都與細胞可塑性的更廣義概念有關,同時也打破了此前認為成體干細胞具有固有組織特異性的觀點。
出于本介紹中簡要提到的所有這些原因,我們將討論改善MSC在臨床應用中的挑戰和機遇,包括考慮MSC的來源和分離、培養條件、表型、免疫調節能力以及應用途徑和劑量。
2、間充質干細胞起源
間充質干細胞(MSCs)的研究源頭可追溯至19世紀。Tavassoli與Crosby于1960年代發現,將無骨結構的骨髓片段異位移植后,可形成包含血管化髓腔與骨殼的異位“骨化結構”,其內含有造血細胞、脂肪細胞及骨小梁。這一實驗不僅驗證了局部微環境對造血維持的重要性,還首次暗示了骨髓中非造血成分的成骨潛能,為“造血微環境”[15]和“間充質干細胞”兩大研究領域奠定了基礎。
1970年代,Friedenstein團隊突破早期研究中全骨髓片段移植的局限性,通過細胞貼壁特性分離出骨髓基質中的成骨前體細胞,并發現單細胞可形成“成纖維細胞集落單位”(CFU-Fs),其克隆后代能分化為骨、脂肪、軟骨等多譜系組織。這一單細胞多能性證據直接催生了骨髓基質中存在“非造血干細胞”的理論,成為現代MSCs概念的原型。
與此同時,Caplan與Marshall Urist在1970-1980年代的研究形成互補:Caplan通過雞胚肢芽培養闡明特定條件下骨、軟骨及肌肉的分化機制,而Urist則從脫礦骨基質中分離出誘導間充質前體細胞聚集的“骨形態發生蛋白”(BMPs)。兩者共同揭示了MSCs分化調控的分子基礎。
基于這些發現,Haynesworth優化培養體系,首次實現人骨髓MSCs的高純度分離與擴增,標志著MSCs研究從理論探索邁向臨床應用的關鍵轉折。
3、間充質干細胞的表型鑒定和分離
間充質干細胞(MSCs)的表型鑒定與分離是確保其研究及臨床應用有效性的關鍵步驟。以下基于國際標準與研究進展,系統闡述其方法及注意事項:
3.1、分離流程與核心技術
3.1.1、組織來源選擇
經典來源:骨髓(BM)仍是金標準,但需權衡侵入性操作(穿刺獲取)與細胞產量(僅占BM有核細胞的0.001%-0.01%)。
替代來源:
- 脂肪組織:通過吸脂術獲取,細胞產量高(約5%有核細胞為MSCs),但成脂傾向顯著。
- 臍帶華通膠/胎盤:無倫理爭議,免疫原性低,適合異體治療。
- 牙髓/經血:易獲取且具神經分化潛力,但需驗證長期安全性。
3.1.2.?樣本處理與初步分離
- 物理消化:機械剪切組織后,聯合膠原酶/胰酶消化(如骨髓需紅細胞裂解液去除造血細胞)。
- 密度梯度離心:常用Ficoll-Paque分離單核細胞層,去除碎片及紅細胞。
- 貼壁篩選法:利用MSCs的塑料貼壁特性,在含10%胎牛血清(FBS)的培養基中培養72小時,棄去未貼壁細胞(主要為造血系)。
3.1.3.?高效分選技術
- 流式分選(FACS):基于表面標志物(CD105+/CD73+/CD90+,CD45-/CD34-/HLA-DR-)分選高純度群體,但可能損傷細胞活力。
- 免疫磁珠分選(MACS):通過抗CD271或CD49a抗體富集MSCs,操作溫和,適合臨床級生產。
- 微流控芯片:新興技術,通過物理特性(大小/變形性)或標志物特異性捕獲細胞,實現無損分選。
3.2、表型鑒定標準
3.2.1、國際細胞治療學會(ISCT)最低標準
迄今為止,大多數研究人員采用的標準是國際細胞治療學會間充質和組織干細胞委員會的標準:
形態學:貼壁生長,呈紡錘狀或成纖維樣形態。
表面標志物:
- 必選陽性:CD105(Endoglin)、CD73(外核苷酸酶)、CD90(Thy-1)。
- 必選陰性:CD45(造血系)、CD34(內皮/造血祖細胞)、CD14/CD11b(單核/巨噬細胞)、CD79a/CD19(B細胞)、HLA-DR(活化標志,靜息態需陰性)。
功能驗證:體外誘導成骨(茜素紅染色)、成脂(油紅O染色)、成軟骨(阿爾新藍染色)三系分化能力。
3.2.2、擴展標志物與功能分析
陽性補充:CD29(整合素β1)、CD44(透明質酸受體)、CD166(ALCAM)與干細胞干性相關[39]。
功能性標志:
- 免疫調節:檢測IDO(吲哚胺2,3-雙加氧酶)、PD-L1表達,或與PBMC共培養抑制T細胞增殖。
- 旁分泌能力:ELISA檢測VEGF、HGF、IL-10等因子分泌水平。
4、培養條件對間充質干細胞周期的作用
培養條件對間充質干細胞(MSCs)的細胞周期具有顯著調控作用,主要通過影響細胞增殖、停滯或分化狀態來改變其周期進程。以下是關鍵培養條件及其作用機制的詳細分析:
??4.1、培養基成分??
血清濃度??:
高血清(如10-20%胎牛血清,FBS)??:提供豐富的生長因子(如IGF-1、PDGF),促進細胞從G0/G1期進入S期,加速增殖。
無血清/低血清??:誘導細胞周期停滯(G0/G1期),常用于維持干細胞特性或誘導分化。
??生長因子添加??:FGF-2(堿性成纖維細胞生長因子)??:通過激活MAPK/ERK通路,上調細胞周期蛋白(Cyclin D1、CDK4),促進G1/S期轉換。
??EGF、PDGF??:協同增強DNA合成,縮短細胞周期時間。
4.2、氧氣濃度??
常氧(21% O?)??:可能誘導氧化應激,導致細胞周期停滯或衰老(通過p53/p21通路)。
??低氧(2-5% O?)??:模擬體內生理環境,通過HIF-1α上調促增殖基因(如VEGF、Cyclin E),促進G1/S期過渡。減少活性氧(ROS)積累,延緩細胞衰老,延長增殖能力。
??4.3、細胞密度??
??低密度培養??:減少接觸抑制,增強生長因子信號(如Wnt/β-catenin通路),促進細胞周期進程。
??高密度培養??:細胞間接觸增多,激活Hippo通路(YAP/TAZ抑制),導致G1期停滯,抑制增殖。
4.4、基質材料??
??剛性基質??:激活機械信號(如RhoA/ROCK通路),促進細胞骨架重組,推動G1/S期轉換。
??軟性基質或3D培養??:模擬體內微環境,可能誘導G0/G1期停滯,維持干細胞靜息狀態或促進分化。
4.5、機械刺激??
拉伸力或流體剪切力??:通過整合素-細胞骨架信號傳導,激活ERK或PI3K/Akt通路,促進細胞周期蛋白表達,加速增殖。
??4.6、代謝調控??
葡萄糖/氨基酸限制??:抑制mTOR通路,導致細胞周期停滯(G1期),誘導自噬或分化。
??高營養條件??:激活代謝酶(如乳酸脫氫酶LDH),促進能量代謝和DNA合成,縮短細胞周期。
??4.7、細胞傳代次數??
?早期傳代(P3-P5)??:細胞周期短,增殖活躍(高Cyclin D1/CDK4水平)。
??長期傳代(>P10)??:端酶縮短和表觀遺傳變化導致衰老相關基因(p16INK4a)激活,細胞周期停滯。
??4.8、綜合作用??
??增殖優化條件??:低氧(5% O?)+ 高FGF-2(10 ng/mL)+ 低密度培養,可顯著縮短細胞周期時間,提高擴增效率。
??維持靜息狀態??:無血清+軟基質+高密度培養,用于保持MSCs的未分化特性。
??4.9、應用意義??
通過調控培養條件,可實現MSCs的大規模擴增(如再生醫學需求)或定向誘導分化(如成骨/軟骨分化),同時避免衰老或基因組不穩定。例如,低氧聯合FGF-2的培養方案常用于臨床級MSCs生產,而高密度無血清培養則用于儲存或運輸前的靜息態維持。
5、間充質干細胞的免疫相容性
5.1、功能范式的革命性轉變
間充質干細胞(MSCs)的治療效應曾被認為源于其分化能力,但Arnold Caplan提出的“藥用信號細胞”(Medicinal Signaling Cells)新命名,強調其核心機制實為旁分泌信號與細胞間直接接觸(近分泌作用)。這一認知革新將研究焦點從細胞替代轉向微環境調控,奠定了MSCs免疫治療的生物學基礎。
5.2、周細胞起源與損傷響應機制
MSCs普遍被認為源自血管周細胞(周細胞),其特性受局部微環境塑造。當組織損傷發生時,周細胞脫離血管壁分化為MSCs,表面分子(如免疫調節蛋白)形成“第一道防線”抑制過度免疫反應,同時分泌再生相關因子構建修復微環境[5-6,9]。這種雙重功能使MSCs不僅作為效應細胞,更成為損傷部位免疫-再生平衡的調控樞紐。
5.3、分泌組:多效性治療工具
MSCs的核心治療價值在于其分泌組(Secretome),包含細胞因子(如VEGF、HGF)、外泌體包裹的核酸及免疫調節分子(如IL-10、TGF-β)。這些成分通過激活內源干細胞增殖分化、抑制纖維化與凋亡、促進血管新生等協同作用實現組織修復。其中,免疫調節能力尤其關鍵,推動靜脈輸注MSCs治療自身免疫病與移植物抗宿主病(GVHD)的臨床探索。
5.4、免疫相容性的分子基礎
臨床前研究表明,異體MSCs通過抑制淋巴細胞增殖、阻斷T細胞凋亡及補體通路激活發揮免疫調節作用。其表面高表達HLA-I類抗原(維持低免疫原性),而HLA-II類抗原僅在炎癥刺激下上調。這種“可調控的免疫沉默”特性,使其在異體移植中無需嚴格配型,成為通用型細胞藥物的理想候選。
5.5、關鍵免疫調節分子網絡
Caplan團隊系統鑒定MSCs分泌的免疫抑制分子庫(圖3),包括HGF、TGF-β、IL-10、前列腺素E2(PGE2)、吲哚胺2,3-雙加氧酶(IDO)等。這些分子通過抑制T細胞活化、促進調節性T細胞(Treg)擴增、抑制NK細胞毒性等多途徑,形成多層次免疫調控網絡,為臨床精準干預提供靶點圖譜。
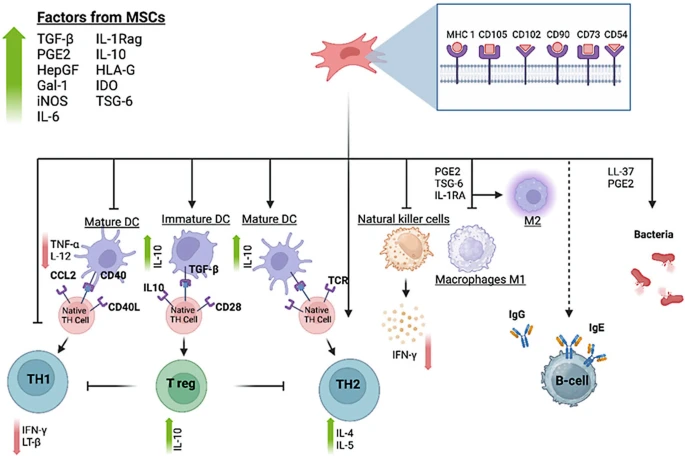
早期研究側重于使用自體 MSC 進行治療,但后來發現 MSC 可以避免免疫系統的排斥反應。這一發現促使人們探索將供體 MSC 用于各種治療。目前已鑒定出至少11種 MSC 釋放的影響免疫細胞的因子。MSC 與 T 細胞相互作用時,會減少炎癥細胞,增加調節細胞和輔助細胞,同時降低某些細胞因子。MSC 與樹突狀細胞相互作用時,會減少促炎細胞,增加具有不同細胞因子譜的未成熟細胞。MSC 還能降低自然殺傷細胞和巨噬細胞的炎癥反應,同時促進抗炎反應。它們可以抑制 B 細胞產生抗體,并防止細菌生長。
5.6、免疫細胞表型的雙向調控
間充質干細胞(MSCs)通過直接接觸與旁分泌作用,重塑免疫細胞組成:促進調節性T細胞(TReg)、抗炎TH2細胞及DC2細胞擴增,同時抑制促炎TH1細胞、DC1細胞及NK細胞活性。在靜息狀態下,MSCs部分抑制NK細胞功能;激活狀態下則降低其細胞毒性[88]。此外,MSCs阻斷骨髓或外周血CD34+細胞向成熟樹突細胞分化[89],并通過調控巨噬細胞極化(促炎M1→修復型M2表型)減少B細胞IgG分泌,協同促進組織修復與血管生成[90-94]。
5.7、炎癥因子平衡與T細胞功能重編程
在MSCs-淋巴細胞共培養體系中,MSCs顯著抑制活化CD4+/CD8+ T細胞及B細胞功能,表現為促炎因子(TNF-α、IFN-γ)分泌減少,抗炎因子(如IL-4)水平升高。Glennie等[95]進一步揭示,MSCs通過誘導T細胞“無反應性”(anergy),阻止初始CD4+ T細胞分化為致病性Th17細胞,并驅動其向CD4+CD25+調節性T細胞分化,形成免疫耐受微環境。
5.8、組織修復與免疫穩態的全局協調者
基于上述多維度調控,MSCs在體內的核心功能被重新定義為“損傷后修復指揮者”與“自身免疫防御者”。其通過動態平衡促炎/抗炎信號、重塑免疫細胞亞群比例,不僅促進局部組織再生(如血管新生、纖維化抑制),還系統性地預防過度免疫反應導致的繼發性損傷,為開發基于MSCs的廣譜免疫調節療法提供理論基石。
6、申請和設計路線
6.1、MSCs的生物學本質爭議
盡管間充質干細胞(MSCs)已被廣泛研究,但其體內是否真正作為干細胞存在仍存疑。關鍵問題在于:現有體外分離與培養方法是否選擇性擴增了特定前體細胞,抑或人為創造了具有治療價值的“人工產物”?這一爭議直接關聯到MSCs的生物學定義及其臨床應用的科學基礎。
6.2、臨床生產的標準化挑戰
十多年來,全球已制定了用于臨床應用的間充質干細胞生產規范,旨在保證使用者的安全。 在獲得批準的 “良好生產規范”(GMP)條件下生產細胞療法產品,可獲得具有特殊屬性和高度安全性的細胞產品。 由于間充質干細胞在損傷、疾病或炎癥部位發揮的作用多種多樣,因此開發預測間充質干細胞多種功能的檢測方法,加上它們對當地環境的快速適應性,是一項具有挑戰性的工作。
因此,盡管間充質干細胞作為臨床療法的潛力已得到廣泛證實,但其特性仍受到生產、處理和給藥方式的影響。 因此,有必要對間充質干細胞衍生療法的開發、分配和有效性進行優化。
Manetti討論了 “工藝即產品 “的概念,強調了通過規劃設計因素(如材料選擇、工藝參數、制造條件和其他相關變量)準確可靠地預測產品的質量屬性的重要性。
6.3、功能評估的創新策略
Galipeau團隊開發“組合矩陣”系統,整合RNA陣列分析MSCs分泌組(如CXCL10、VEGF)與免疫調節功能(抑制T細胞增殖)的關聯[98]。Phinney等則基于Twist-1表達水平建立“臨床適應癥預測量表”[99],高Twist-1預示促血管生成,低水平則關聯抗炎作用,為精準治療提供分子標志。
Galipeau小組[97]率先提出了 “組合矩陣 “的概念,將其作為整合各種檢測方法的復雜系統的基礎。 在最初的研究中,他們利用基于 RNA 的陣列分析了間充質干細胞的分泌組,并評估了間充質干細胞的免疫調節能力及其與外周血單核細胞(PBMC)的相互作用。 他們發現 CXCL10、VEGF、CXCL9 和 CCL2 的分泌和表達與 T 細胞增殖抑制之間存在相關性。
6.4、自體MSCs的臨床局限性
雖然最初的策略涉及自體間充質干細胞的制造,但這種方法也存在挑戰。 這些挑戰包括:從老年或體弱患者身上獲得足夠數量的細胞需要相當長的時間,以及從患有各種病癥的患者身上體外培養間充質干細胞存在困難。 盡管低溫保存對細胞的影響不小,但作為一種解決方案,低溫保存通常被用來促進延遲治療或適應異體供體。
冷凍保存在臨床實踐中的 MSC 儲存中起著至關重要的作用,但其對 MSC 生物學特性的影響仍存在爭議;一些研究表明效力降低,而另一些研究則發現對免疫調節特性沒有顯著影響。多次冷凍步驟(≥4)可能會加速MSC衰老,與新鮮培養的 MSC 相比,冷凍和解凍后MSC的免疫抑制潛力會降低約50%,這與冷凍步驟的數量無關。各種用于延長MSC儲存時間的技術,采用不同的冷凍保存培養基配方和冷凍/解凍程序,已被證明可能會影響MSC效力。
因此,必須進行進一步研究,以改善冷凍保存條件并保存MSC的固有生物學特性,從而拓寬MSC儲存的范圍,以供未來的細胞治療應用。
6.5、異體MSCs的免疫風險再評估
臨床上使用異體間充質干細胞還是自體間充質干細胞也存在爭議。臨床前和臨床研究表明,出于免疫原性的考慮,越來越多的人傾向于使用異體間充質干細胞。 雖然人們認為異體間充質干細胞的免疫原性極低或沒有免疫原性,但新的研究結果表明,間充質干細胞有可能引發宿主的先天性和適應性免疫反應,盡管與其他異體細胞相比程度較低。
因此,間充質干細胞的免疫原性與免疫抑制因子的分泌之間的相互作用(受特定局部微環境的影響)極大地影響了間充質干細胞的行為及其在免疫抑制中的功效。
6.6、歸巢能力的工程化增強
MSCs向損傷組織的歸巢涉及多步驟(內皮黏附、跨遷移等),但體外擴增導致歸巢分子(如趨化因子受體)下調,效率低下。基因編輯(如過表達歸巢相關受體)在實驗模型中展現潛力,但臨床轉化需權衡安全性與長期效應。
另一個值得注意的方面是間充質干細胞的歸巢能力。 與白細胞和造血干細胞等其他類型的細胞類似,間充質干細胞向受損組織遷移是一個多步驟過程。 這包括初始減速附著、與內皮細胞滾動接觸、整合素激活、跨內皮遷移和間質遷移。 盡管機制復雜,但間葉干細胞向受損器官歸巢的效率仍然很低,而且長時間的體外擴增會導致歸巢分子(包括趨化因子受體)下調,從而限制其趨化反應。 對治療應用而言,操縱影響間充質干細胞行為的所有因素是不切實際的,這就要求把重點放在增強特定分子上。 考慮到最常見的基因療法的局限性,間充質干細胞工程在實驗模型中似乎更有前景,但成功的臨床轉化還需要進一步的研究和時間。
6.7、功能預處理的策略革新
除基因工程外,3D培養、低氧預處理等物理調控可增強MSCs干性、旁分泌(促血管生成、抗氧化)及抗凋亡能力。例如,低氧通過HIF-1α通路維持干細胞特性,為定制化治療提供無創優化方案。
6.8、工程化治療的未來方向
綜合基因編輯、微環境模擬與功能預處理的MSCs工程化策略,正推動個體化治療發展。此類“設計型MSCs”可針對特定病理(如自身免疫病、缺血性損傷)優化功能模塊,加速FDA審批并降低成本,但仍需大規模臨床驗證其安全性與長效性。
7、結論
20世紀80年代末,Arnold Caplain提出“間充質干細胞”(MSCs)這一術語,開啟了再生醫學的新紀元。盡管最初認為其治療潛力源于多向分化能力,但后續研究揭示其療效與分化潛能關聯微弱,促使Caplain將其重新定義為“藥用信號細胞”(medicinal signaling cells)。
間充質組織的胚胎起源涉及軀干與頭部中胚層的協同作用,這種復雜性(尤其在心等器官中)解釋了MSCs的顯著可塑性——其命運由局部微環境信號動態塑造,成為理解其多功能性的關鍵。
7.1、定義標準化與異質性挑戰
國際細胞治療學會(ISCT)雖致力于制定MSCs的全球最低標準,但其定義仍面臨多重挑戰:從發育來源多樣性(如骨髓、脂肪、臍帶等)到供體個體差異(年齡、性別)、培養條件(氧濃度、凍存步驟)及微環境信號(基質硬度、炎癥因子)的交互影響,均導致MSCs功能異質性。生態位(niche)的核心作用被確立,其通過調控細胞間相互作用與代謝狀態,指導MSCs在組織穩態維持與修復中的行為[2]。
7.2、治療范式的革新與未來方向
MSCs的核心治療機制從“細胞替代”轉向“信號調控”,通過旁分泌與近分泌作用激活內源干細胞,并分泌免疫調節因子(如IL-10、VEGF)協調修復進程。其角色從“分化執行者”轉變為“修復指揮者”,凸顯微環境響應能力的重要性。盡管臨床轉化仍需克服生產標準化(如凍存損傷、異體免疫風險)與歸巢效率等瓶頸,但學界已形成共識:MSCs的療效高度依賴生產工藝與給藥策略的優化。
未來,結合單細胞組學與工程化修飾(如低氧預處理、基因編輯),有望實現“精準定制”的MSCs療法,推動再生醫學從實驗室邁向臨床常規應用。
參考資料:Citro, V., Dale, T.P., Forsyth, N.R. (2025). Mesenchymal Stem Cells. In: Liem, N.T., Forsyth, N.R., Heke, M. (eds) Cell Therapy. Springer, Singapore. https://doi.org/10.1007/978-981-96-1261-1_3
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信