近日,東京–( BUSINESS WIRE)–SanBio Co., Ltd. (TOKYO:4592)(總部:東京,代表董事兼首席執行官:Keita Mori)特此宣布,其同種異體間充質干細胞制備人體干細胞加工產品“AKUUGO?顱內植入用懸浮液”(INN:vandefitemcel;以下簡稱“AKUUGO?”)在日本獲得了有條件和有時間限制的上市許可,用于干細胞治療改善創傷性腦損傷導致的慢性運動性麻痹。
全球首款:間充質干細胞治療慢性運動癱瘓獲批上市

創傷性腦損傷 (TBI) 是由交通事故或墜落等強烈外力作用于頭部,導致顱骨內腦組織受損而引起的。TBI癥狀的表現和時間在患者之間差異很大,并且根據受影響的大腦區域,患者可能會出現運動功能障礙或更高級的腦功能障礙等后遺癥。
- 研究表明,被破壞或受損的腦組織不會自然再生,進入TBI慢性期并出現運動性麻痹的患者將對其日常生活和社交生活產生終生影響,這表明存在巨大的未滿足醫療需求。
AKUUGO?已被證明可有效改善與TBI相關的慢性運動癱瘓,是全球首個也是唯一獲批用于此適應癥的同種異體細胞治療藥物。

AKUUGO?是一種同種異體細胞產品,通過培養從健康供體采集的骨髓間充質干細胞,并將人Notch-1胞內結構域基因瞬時轉染到培養細胞中以增強其再生神經細胞的能力而制成。
將AKUUGO?移植到腦部受損的神經組織中,預計會觸發FGF-2(一種蛋白質)和其他物質的釋放,進而促進受損神經細胞的自然再生能力并誘導神經細胞增殖和分化。基礎研究結果也表明,AKUUGO?對神經細胞具有保護作用、誘導血管生成,并具有免疫調節作用。
SanBio首席執行官Mori Keita評論如下:
“我們非常高興地宣布,經過24年的運營,我們的AKUUGO?獲得了有條件和有時限的批準,使我們能夠為日本的創傷性腦損傷患者提供新的治療選擇。AKUUGO?可直接作用于大腦,是創傷性腦損傷相關慢性運動麻痹患者的創新和重要選擇。我們希望通過AKUUGO?為盡可能多的創傷性腦損傷患者的生活帶來希望”。
AKUGO?的批準是基于SanBio在日本和美國進行的全球第二階段臨床試驗的結果。
東京大學神經病學教授Nobuhito Saito博士領導了這項臨床試驗,并發表了如下評論:
“腦外傷可影響大腦的各個區域,損傷的部位和程度決定了癥狀和后遺癥的持續時間和嚴重程度。急性期的康復治療可有效恢復一定程度的運動功能,但由于受損腦細胞不能再生,因此對于腦外傷引起的慢性運動障礙和其他后遺癥一直沒有有效的治療方法。AKUGO?的獲批可能會為腦外傷慢性后遺癥患者提供一種新的治療選擇,我期待著看到研究和分析取得進一步進展”。
匹茲堡大學神經外科教授兼神經創傷臨床試驗中心主任David O. Okonkwo博士評論如下:“慢性腦外傷患者終生殘疾,影響生活質量,尤其是運動障礙患者。腦外傷患者的生活也給照顧他們的人帶來了負擔”。
AKUGO?的獲批是一項突破,為慢性腦外傷運動障礙的治療揭開了新的篇章。
慶應義塾大學教授、SanBio的創始科學家Hideyuki Okano博士多年來一直支持公司的工作,他評論道:“AKUGO?的獲批是一項突破,為慢性腦外傷運動障礙的治療揭開了新的篇章”。

多年來一直支持公司發展的慶應義塾大學教授、SanBio的創始科學家Hideyuki Okano博士評論道:
“20多年來,SanBio一直在腦再生醫學領域開展研發工作。我很高興AKUUGO?被批準用于治療腦外傷導致的慢性運動性癱瘓,這是世界上第一個被批準的此類治療方法,我也很高興能為日本患者提供新的治療選擇”。
AKUGO?在日本獲得批準,比世界上其他任何地方都要早,這使我們更接近于實現我們的目標,即為全世界仍然因缺乏有效治療方案而飽受折磨的中樞神經系統疾病(尤其是腦部疾病)患者提供支持。
AKUUGO?產品概述
| 品牌 | AKUUGO?顱內植入用懸浮液 |
| 通用名 | Vandefitemcel |
| 適應癥和效果 | 腦外傷相關慢性運動性麻痹的改善 |
| 劑量和給藥 | 對于成年人,使用專用的輸送裝置組通過立體定向腦手術將5×106個活的人類(同種異體)骨髓間充質干細胞(300μL細胞懸浮液)植入到病變周圍的腦組織。 通過顱骨上的鉆孔,將細胞通過三條軌跡植入病灶周圍區域。向每條軌跡注入100μL細胞懸浮液,在距離最深位置5–6毫米的總共五個位置上各注入20μL溶液。植入速率應約為10μL/分鐘。按照以下步驟進行植入。1. 開始手術前,將專用輸送裝置中的導向器和止動器以及配有探針的插入器安裝到侵入性神經外科手術的頭部固定裝置上。2. 將顱內植入用細胞懸液解凍,用專用配制液清洗,用專用配制液調整細胞懸液濃度為1.67×106細胞/100μL。用專用配制液清洗固定有專用輸送裝置套管的微量注射器,再將配制好的細胞懸液注入微量注射器。 |
| 上市許可日期 | 2024年7月31日 |
| 批準條件 | |
| 1 | 鑒于該產品的生產記錄有限,本公司應根據預定計劃及時收集產品質量信息,并評估和報告試驗產品(臨床試驗產品)與擬商業化分銷產品的質量等效性/同質性。根據評估結果,本公司應申請部分變更已批準事項。在部分變更申請獲得批準之前,本公司不得發運該產品。 |
| 2 | 公司必須確保產品在配備齊全的急救設施內使用,由具備足夠的腦外傷診斷和治療知識和經驗以及腦立體定向手術技術的醫生使用。醫生還必須對產品的臨床試驗結果和不良事件有充分的了解。 |
| 3 | 公司必須對產品的所有使用情況進行上市后評估,直至公司在有條件和有時間限制的批準到期前重新申請產品上市批準。 |
| 4 | 在有條件和有時間限制的批準到期前,公司必須重新申請該產品的上市許可,并收集反映該產品作用機制的生物學特性信息,并采取必要措施,如改進其質量控制策略。 |
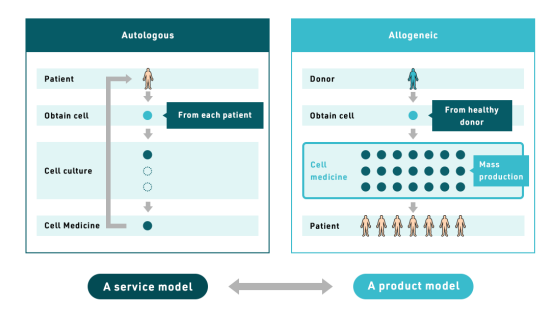
*關于異體細胞移植
再生醫療療法可分為自體細胞療法和異體細胞療法。自體細胞移植是采集并使用患者自身的細胞,但細胞處理過程耗時費力。而異體細胞移植則是從捐贈者處采集細胞并進行大量培養。由于異體細胞藥物可以批量生產,因此可以治療大量患者。
關于“AKUUGO?顱內植入懸浮液”
AKUUGO?顱內植入懸浮液(INN:vandefitemcel)是一種人類(同種異體)骨髓來源的改良間充質干細胞,通過改良和培養源自健康成人骨髓抽吸物的間充質干細胞而產生。將AKUUGO?移植到腦部受損的神經組織中,預計會觸發FGF-2(一種蛋白質)和其他物質的釋放,進而促進受損神經細胞的自然再生能力,并誘導神經細胞增殖和分化。
有條件和有時間限制的批準是基于SanBio全球第2期臨床試驗的結果。試驗的主要終點——治療后24周Fugle-Meyer運動量表(FMMS)評分相對于基線的平均變化——已經達到,AKUUGO?治療組報告比對照組提高了8.3分對照組為2.3,具有統計學顯著差異。研究最終分析結果已在美國神經病學學會年會上公布。我們正在推進針對多種適應癥的研發,包括與慢性腦梗塞相關的慢性效應。
關于SanBio集團(SanBio Co., Ltd和SanBio, Inc)
SanBio從事再生細胞業務——我們研究、開發、制造和銷售再生細胞藥物。
2024年7月,根據Sakigake指定計劃,我們獲得了主打產品AKUUGO?的有條件和有時間限制的批準,用于改善創傷性腦損傷導致的慢性運動障礙。
展望未來,我們將繼續將研發重點放在現有藥物無法滿足的重大未滿足醫療需求的中樞神經系統疾病上。該公司總部位于日本東京和加利福尼亞州奧克蘭。
免責說明:本文由杭吉泰迪干細胞整個發布,非經授權,請勿轉載。本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。



 掃碼添加官方微信
掃碼添加官方微信