間充質(zhì)干細(xì)胞(MSCs)因其多向分化潛能、免疫調(diào)節(jié)功能以及旁分泌活性,已經(jīng)成為腎病治療領(lǐng)域的一個(gè)研究熱點(diǎn)。然而,來(lái)自不同組織如骨髓、臍帶、脂肪等的MSCs在治療效果上表現(xiàn)出顯著差異,這種異質(zhì)性直接影響了它們?cè)谂R床應(yīng)用中的選擇和使用。
研究表明,即使在同一來(lái)源內(nèi),MSCs之間也可能存在較大的變異性,這不僅體現(xiàn)在不同組織來(lái)源之間,也存在于同一來(lái)源內(nèi)部的不同批次或個(gè)體之中。這種廣泛的變異性凸顯了對(duì)MSCs進(jìn)行全面表征及實(shí)施嚴(yán)格的質(zhì)量控制措施的重要性。
基于多年的科學(xué)研究積累,本文將系統(tǒng)地探討不同來(lái)源間充質(zhì)干細(xì)胞的生物學(xué)特性和其在腎病治療中的表現(xiàn)之間的關(guān)系。通過(guò)對(duì)現(xiàn)有臨床數(shù)據(jù)的綜合分析,我們可以更深入地理解不同來(lái)源MSCs的獨(dú)特優(yōu)勢(shì)與局限性,從而為個(gè)性化醫(yī)療提供科學(xué)依據(jù)。

骨髓、臍帶還是脂肪:哪種間充質(zhì)干細(xì)胞最適合腎病治療?
一、間充質(zhì)干細(xì)胞的來(lái)源與特性差異
1.骨髓來(lái)源間充質(zhì)干細(xì)胞(BM-MSCs)
- 優(yōu)勢(shì):分化潛能強(qiáng),分泌多種神經(jīng)營(yíng)養(yǎng)因子(如VEGF、HGF),在腎損傷修復(fù)中表現(xiàn)出良好效果。
- 局限:獲取需侵入性操作,細(xì)胞衰老快,增殖能力隨供體年齡下降。
- 應(yīng)用:多項(xiàng)研究證實(shí)其可改善急性腎損傷(AKI)和糖尿病腎病(DN)的腎功能。
2.脂肪來(lái)源間充質(zhì)干細(xì)胞(AD-MSCs)
- 優(yōu)勢(shì):取材便捷、儲(chǔ)量豐富,免疫原性低,旁分泌抗炎因子(如IL-10)能力突出。
- 局限:分化能力弱于BM-MSCs,長(zhǎng)期療效穩(wěn)定性待驗(yàn)證。
- 應(yīng)用:臨床試驗(yàn)顯示其可顯著降低狼瘡性腎炎(LN)患者尿蛋白,但單劑治療效果隨時(shí)間衰減。
3.臍帶/胎盤(pán)來(lái)源間充質(zhì)干細(xì)胞(UC-MSCs/PL-MSCs)
- 優(yōu)勢(shì):原始性高、增殖迅速,免疫原性最低,適合異體移植。
- 局限:規(guī)模化生產(chǎn)存在倫理爭(zhēng)議,特定生長(zhǎng)因子分泌量低于其他來(lái)源。
- 應(yīng)用:在IgA腎病中表現(xiàn)出穩(wěn)定的腎臟保護(hù)作用,延緩腎小球硬化進(jìn)程。
4.特性差異對(duì)治療效果的影響機(jī)制
- 歸巢能力:UC-MSCs高表達(dá)CXCR4,更易遷移至腎損傷部位,加速修復(fù)。
- 免疫調(diào)節(jié):AD-MSCs通過(guò)PD-L1/PD-1通路抑制T細(xì)胞活化,對(duì)自身免疫性腎病(如LN)更具優(yōu)勢(shì)。
- 旁分泌譜:BM-MSCs分泌的TGF-β1促進(jìn)纖維化,而UC-MSCs的HGF則抑制纖維化,適用于慢性腎病。
二、間充質(zhì)干細(xì)胞在不同腎病類型中的療效分化
1.糖尿病腎病
臍帶MSCs:福州總院曾進(jìn)行過(guò)一項(xiàng)臍帶間充質(zhì)干細(xì)胞移植對(duì)糖尿病腎病的臨床觀察。經(jīng)過(guò)為期三個(gè)月的治療后,觀察到了一系列顯著的生理指標(biāo)改善。具體而言:
- 患者的收縮壓(SBP)平均降低了18.1毫米汞柱(mmHg),而舒張壓(DBP)則下降了14.6mmHg。
- 此外,空腹血糖(FPG)水平平均減少了2.94毫摩爾/升(mmol/L),餐后兩小時(shí)血糖(2hPBG)也相應(yīng)地下降了5.92 mmol/L。
- 與此同時(shí),空腹C肽(0hCP)濃度上升了0.24納克/毫升(ng/ml),而餐后兩小時(shí)C肽(2hCP)增加了0.29 ng/ml。
骨髓MSCs:歐洲進(jìn)行了一項(xiàng)同種異體骨髓間充質(zhì)干細(xì)胞移植對(duì)中重度糖尿病患者的1b/2a期多中心隨機(jī)臨床試驗(yàn)。以評(píng)估成人同種異體骨髓基質(zhì)干細(xì)胞移植對(duì)中重度DKD患者的安全性、耐受性及治療效果。研究發(fā)現(xiàn):
- 干細(xì)胞組在維持保護(hù)腎功能(mGFR、eGFR)方面表現(xiàn)顯著優(yōu)于安慰劑組,尤其在12個(gè)月和18個(gè)月時(shí)。
- 此外免疫學(xué)分析提供了證據(jù),表明與安慰劑相比,接受細(xì)胞療法的患者循環(huán)調(diào)節(jié)性T細(xì)胞得到保留、自然殺傷 T細(xì)胞減少以及炎癥單核細(xì)胞亞群穩(wěn)定。
- 但在18個(gè)月隨訪中,干細(xì)胞組與安慰劑組在血糖、糖化血紅蛋白、總膽固醇、甘油三酯、C 反應(yīng)蛋白等代謝參數(shù)上,與基線相比的變化無(wú)統(tǒng)計(jì)學(xué)顯著差異。
脂肪/胎盤(pán) MSCs:目前脂肪以及胎盤(pán)來(lái)源的間充質(zhì)干細(xì)胞在治療糖尿病腎病上的臨床試驗(yàn)主要集中在動(dòng)物上。最近的臨床發(fā)現(xiàn),胎盤(pán)間充質(zhì)干細(xì)胞對(duì)糖尿病腎病大鼠及足細(xì)胞具有保護(hù)作用:
- 一方面,改善DKD大鼠腎小管損傷、腎小球系膜基質(zhì)沉積和足細(xì)胞損傷,通過(guò)增強(qiáng)腎組織自噬水平,上調(diào)SIRT1與 FOXO1 表達(dá)實(shí)現(xiàn),且自噬抑制劑會(huì)削弱其保護(hù)效果;
- 另一方面,對(duì)高糖誘導(dǎo)的MPC5足細(xì)胞損傷亦有改善作用,可增加足細(xì)胞自噬并上調(diào)SIRT1、FOXO1,下調(diào)SIRT1則會(huì)阻斷PL-MSCs對(duì)足細(xì)胞自噬的增強(qiáng)及損傷修復(fù)。
2.慢性腎病
臍帶MSCs:埃及開(kāi)羅大學(xué)醫(yī)學(xué)院進(jìn)行過(guò)一項(xiàng)臍帶間充質(zhì)干細(xì)胞衍生的細(xì)胞外囊泡治療40例CKD III期和IV期患者的臨床試驗(yàn)。研究表明:
- A組受試者的eGFR、血清肌酐水平、血尿素和UACR均顯著改善。治療組A患者的血漿TGF-β1和IL-10水平也顯著升高,血漿TNF-α水平顯著降低。
- 對(duì)照組B的受試者在研究期間的任何時(shí)間點(diǎn)均未表現(xiàn)出上述任何參數(shù)的顯著改善。
骨髓MSCs:國(guó)際期刊雜志《Cytotherapy》曾發(fā)表了一項(xiàng)骨髓間充質(zhì)干細(xì)胞治療慢性腎病的一項(xiàng)早期臨床試驗(yàn)。研究表明同種異體骨髓來(lái)源的間充質(zhì)干細(xì)胞輸注對(duì)慢性腎病患者而言似乎是安全且可耐受的。中期6個(gè)月研究表明,患者的腎功能穩(wěn)定或有所改善,重復(fù)分劑量MSC輸注可降低全身炎癥。
- 6個(gè)月時(shí),腎功能與基線相似 (eGFR32.1vs30.9mL/min/1.73m2 ),平均eGFR變化為1.2±4.7mL/min/1.73m2 (所有受試者)。不同劑量組之間的6個(gè)月eGFR變化沒(méi)有差異。
- 然而,促炎標(biāo)志物TNF-α在劑量組1(與組2相比)中在3個(gè)月和6個(gè)月時(shí)呈持續(xù)下降趨勢(shì)。
脂肪MSCs:中國(guó)臺(tái)灣新北市臺(tái)北醫(yī)學(xué)大學(xué)雙和醫(yī)院曾進(jìn)行過(guò)一項(xiàng)Ⅰ期臨床試驗(yàn),驗(yàn)證同種異體脂肪組織來(lái)源的間充質(zhì)干細(xì)胞ELIXCYTE?在慢性腎病中的應(yīng)用。12名的CKD患者,分低、中、高劑量組接受單劑靜脈輸注,48周評(píng)估顯示:
- 24周時(shí)58%(7/12)、48周時(shí)50%(6/12)患者腎小球?yàn)V過(guò)率(eGFR)增加,其中基線eGFR≥30 ml/min/1.73m2患者24周時(shí)eGFR均提升超20%,而<30 ml/min/1.73 m2組僅2例達(dá)此標(biāo)準(zhǔn),所有受試者蛋白尿無(wú)顯著減少。
3.狼瘡性腎炎
臍帶MSCs:南京鼓樓醫(yī)院在期刊《實(shí)用臨床醫(yī)藥雜志》上發(fā)表過(guò)一篇關(guān)于臍帶間充質(zhì)干細(xì)胞移植治療難治性狼瘡性腎炎的遠(yuǎn)期預(yù)后分析的臨床研究案例。研究表明:
- UC-MSC治療難治性LN具有良好的療效及遠(yuǎn)期預(yù)后,其中基線eGFR水平低是影響療效的危險(xiǎn)因素。
- 92例難治性LN患者隨訪3年,共45例患者獲得持續(xù)腎臟緩解,總緩解率為48.9%(45/92),其中完全緩解率為6.5%(6/92),部分緩解率為42.4%(39/92)。
骨髓MSCs:哈薩克斯坦阿斯塔納國(guó)家科學(xué)醫(yī)學(xué)中心過(guò)一項(xiàng)臨床試驗(yàn)。評(píng)估了骨髓間充質(zhì)干細(xì)胞(MSC)移植聯(lián)合高劑量免疫抑制療法(HIST)治療狼瘡性腎炎患者的療效和安全性。研究結(jié)果表明:
- 疾病活動(dòng)度:治療組SELENA-SLEDAI評(píng)分12個(gè)月內(nèi)從14.67±1.15顯著降至7.33±1.15(下降2倍),對(duì)照組維持15.0±0.87;
- 蛋白尿:每日蛋白尿量從2.48±0.77g/l降至1.06±0.56g/l;
- 抗體與炎癥:DNA抗體值從443.28±547.53U/ml降至187.8±146.60 U/ml,TNF-α顯著降低,補(bǔ)體水平升高。
脂肪MSCs:21年,伊朗馬什哈德醫(yī)科大學(xué)醫(yī)學(xué)院進(jìn)行了一項(xiàng)Ⅰ期同種異體脂肪間充質(zhì)干細(xì)胞移植治療難治性狼瘡性腎炎臨床試驗(yàn)。研究顯示,該療法安全性良好,未發(fā)生重大不良事件。
- 治療后1個(gè)月尿蛋白水平從基線中位數(shù)1800 mg/24h顯著降至1020mg/24h,3個(gè)月內(nèi)完全反應(yīng)(33.3%)和部分反應(yīng)(44.4%)率較高,但療效隨時(shí)間逐漸減弱;
- 系統(tǒng)性紅斑狼瘡疾病活動(dòng)指數(shù)(SLEDAI)中位數(shù)從基線16分顯著降至6個(gè)月時(shí)的6分,12個(gè)月隨訪略有回升。
4.急性腎損傷
臍帶MSCs:巴拿馬干細(xì)胞研究所2020年使用臍帶間充質(zhì)干細(xì)胞治療了一位急性腎損傷后繼發(fā)IgA腎病的50歲男性患者進(jìn)行了治療并進(jìn)行了6個(gè)月的隨訪。研究表明:
- 應(yīng)用hUC-MSCs后,患者數(shù)月內(nèi)獲顯著持續(xù)改善,且6個(gè)月隨訪時(shí)改善效果仍延續(xù)。
- 1個(gè)月血壓降至130/80mmHg;2個(gè)月血紅蛋白15.3g/dL、紅細(xì)胞壓積(HCT)44.4%,肌酐降至1.03 mg/dL;
- 6個(gè)月血壓穩(wěn)定在120/80mmHg,肌酐維持1.0mg/dL,且因血壓改善停用硝苯地平。
骨髓MSCs:中國(guó)人民解放軍總醫(yī)院第一醫(yī)學(xué)中心在行業(yè)期刊《中華醫(yī)學(xué)信息導(dǎo)報(bào)》上發(fā)表過(guò)了一篇干細(xì)胞治療急性腎損傷的研究新進(jìn)展的研究成果。文章介紹了:
- 研究人員在2008年開(kāi)展了骨髓間充質(zhì)干細(xì)胞用于急性腎損傷的Ⅰ期臨床研究,評(píng)價(jià)MSC在心臟直視手術(shù)后急性腎損傷患者中應(yīng)用的安全性和有效性。對(duì)16例急性腎損傷高危患者,使用干細(xì)胞移植。經(jīng)過(guò)6個(gè)月的隨訪,腎功能顯著改善,沒(méi)有觀察到嚴(yán)重不良反應(yīng)。說(shuō)明干細(xì)胞是一種安全的干預(yù)方法。
- 隨后在2017年開(kāi)展的干細(xì)胞用于急性腎損傷的Ⅱ期多中心隨機(jī)對(duì)照臨床研究,觀察骨髓間充質(zhì)干細(xì)胞加速急性腎損傷患者腎功能恢復(fù)的療效。156例急性腎損傷患者接受干細(xì)胞調(diào)理,結(jié)果發(fā)現(xiàn)骨髓間充質(zhì)干細(xì)胞安全、患者耐受性良好。
脂肪MSCs:目前脂肪以及胎盤(pán)來(lái)源的間充質(zhì)干細(xì)胞在治療急性腎損傷上的臨床試驗(yàn)主要集中在動(dòng)物上。佛山科學(xué)技術(shù)學(xué)院生命科學(xué)與工程學(xué)院的研究人員,曾對(duì)犬急性腎損傷進(jìn)行了脂肪間充質(zhì)干細(xì)胞靜脈注射的治療方法,探究其治療效果。
- 與模型組相比,治療組血清肌酐、尿素氮和促炎因子TNF-α水平顯著降低,腎小管損傷標(biāo)志物NGAL和KIM-1恢復(fù)至正常范圍,尿常規(guī)指標(biāo)改善;組織學(xué)分析顯示,治療組腎小管上皮細(xì)胞壞死程度明顯減輕,腎組織結(jié)構(gòu)得到修復(fù),表明AD-MSC治療通過(guò)抗炎和促進(jìn)組織修復(fù)機(jī)制有效緩解腎損傷并恢復(fù)腎功能。
三、療效差異的影響因素
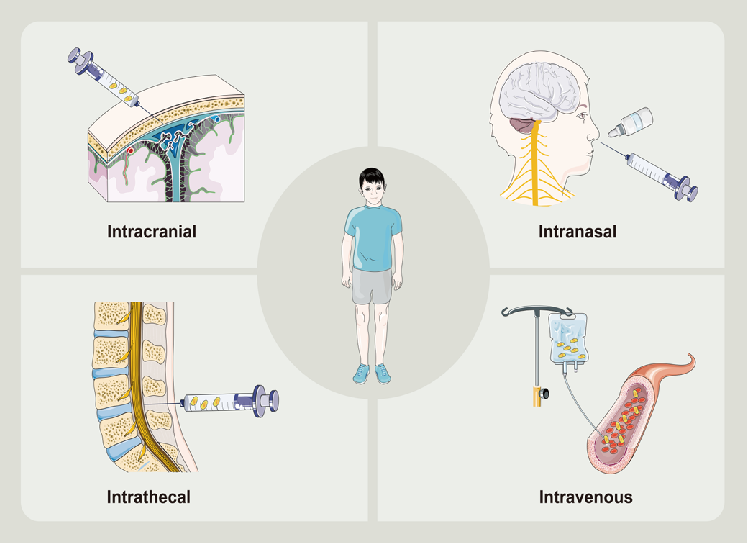
給藥途徑與劑量:給藥途徑和劑量是決定不同間充質(zhì)干細(xì)胞(MSCs)治療效果的關(guān)鍵因素之一。
- 靜脈輸注雖然是最常用的方法,但研究表明,MSCs在進(jìn)入血液循環(huán)后往往會(huì)在肺部被大量截留,這可能限制了它們到達(dá)目標(biāo)器官如腎臟的能力。
- 相比之下,動(dòng)脈內(nèi)注射或局部靶向輸注能夠顯著提高M(jìn)SCs在特定部位的分布效率,從而增強(qiáng)治療效果。
- 此外,關(guān)于劑量的選擇,重復(fù)輸注骨髓間充質(zhì)干細(xì)胞相較于單次高劑量給藥,通常能獲得更好的治療效果。因此,在設(shè)計(jì)治療方案時(shí),考慮采用分階段、多次輸注的方式可能是優(yōu)化療效的一個(gè)方向。
細(xì)胞活性與基因修飾:
- 基因編輯技術(shù)(如過(guò)表達(dá) GDNF)可增強(qiáng) MSCs 修復(fù)能力,提高存活率并促進(jìn)生長(zhǎng)因子分泌,加速組織修復(fù)。
- Miro1 蛋白介導(dǎo)的線粒體轉(zhuǎn)移機(jī)制可將健康線粒體輸送至受損腎細(xì)胞,恢復(fù)其功能。
疾病階段與個(gè)體差異:
- 早期干預(yù):糖尿病腎病早期(非終末期)治療效果更佳,因組織損傷較輕,MSCs 再生修復(fù)潛力更大。
- 個(gè)性化策略:需綜合考慮干細(xì)胞來(lái)源(自體 / 異體)、患者年齡(年輕患者自我修復(fù)能力強(qiáng),老年患者側(cè)重免疫調(diào)節(jié))、免疫狀態(tài)及遺傳背景,通過(guò)基因檢測(cè)優(yōu)化治療方案。
綜上所述,為了最大化MSCs的治療效果,必須全面考量給藥途徑、劑量、細(xì)胞活性、基因修飾、疾病階段及個(gè)體差異等因素,并據(jù)此設(shè)計(jì)個(gè)性化的治療方案。
結(jié)論
綜上所述,骨髓來(lái)源的間充質(zhì)干細(xì)胞(BMSCs)在抗纖維化和免疫調(diào)節(jié)方面表現(xiàn)尤為突出,這使得它們成為治療慢性腎病的重要候選。與此同時(shí),臍帶來(lái)源的間充質(zhì)干細(xì)胞以及脂肪來(lái)源的間充質(zhì)干細(xì)胞由于其易于獲取且具有較低的免疫原性,在臨床應(yīng)用中展現(xiàn)出更大的潛力。尤其是臍帶間充質(zhì)干細(xì)胞,因其非侵入性的采集方式和較高的細(xì)胞活力,被視為一種特別有前景的治療選項(xiàng)。
展望未來(lái),為了進(jìn)一步提升MSCs療法的有效性和安全性,有必要通過(guò)精準(zhǔn)醫(yī)學(xué)方法和基因工程技術(shù)來(lái)優(yōu)化治療方案。這意味著不僅要根據(jù)患者的特定病情選擇最合適的細(xì)胞來(lái)源,還要考慮如何通過(guò)基因修飾增強(qiáng)MSCs的功能,如過(guò)表達(dá)某些有益的生長(zhǎng)因子或提高線粒體轉(zhuǎn)移能力等。
此外,隨著對(duì)MSCs作用機(jī)制理解的深入,個(gè)性化醫(yī)療策略將能夠更好地滿足不同患者的需求,從而推動(dòng)干細(xì)胞療法逐步成為腎病治療的新標(biāo)準(zhǔn)。
- 相關(guān)閱讀:了解更多關(guān)于干細(xì)胞治療急性腎損傷的新聞資訊!
免責(zé)說(shuō)明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。
版權(quán)說(shuō)明:本文來(lái)自杭吉干細(xì)胞科技內(nèi)容團(tuán)隊(duì),歡迎個(gè)人轉(zhuǎn)發(fā)至朋友圈,謝絕媒體或機(jī)構(gòu)未經(jīng)授權(quán)以任何形式轉(zhuǎn)載至其他平臺(tái),轉(zhuǎn)載授權(quán)請(qǐng)?jiān)诰W(wǎng)站后臺(tái)下方留言獲取。



 掃碼添加官方微信
掃碼添加官方微信