卵巢早衰(POI)對女性的生活質量有著深遠的影響。由于對這種疾病的病因和復雜性缺乏充分認識,感染患者尚無適當的治療方法。
近年來,干細胞療法引起了再生醫學學者的關注,并為POI患者帶來了良好的治療效果。多種干細胞,如胚胎干細胞(ESC)、間充質干細胞(MSC)和誘導多能干細胞(iPSC)已被用于治療卵巢疾病。然而,它們潛在的保護機制仍然未知。毫無疑問,更好地了解干細胞的治療分子和細胞機制將有助于發現策略,以增加其對POI等多種疾病的臨床應用。
近期,“A Cell Press journal”雜志發表了一篇干細胞在治療卵巢早衰中的保護作用:現狀與作用機制的綜述文章。本文詳細描述了卵巢早衰的發表機制、干細胞治療卵巢早衰的機制,目前支持干細胞治療卵巢早衰的證據有哪些,并全面回顧了間充質干細胞治療卵巢早衰的臨床案例。因此,本次綜述將為干細胞治療卵巢早衰中的進一步臨床應用提供概念驗證。
干細胞在治療卵巢早衰中的保護作用:現狀和作用機制

卵巢早衰的發病機制特點
盡管POI發病機制的確切機制尚不清楚,但卵泡數量減少和激素分泌缺乏是最常見的機制之一。POI的特點是卵巢功能提前終止、卵泡發生受阻以及靜息原始卵泡池耗盡。卵泡發生是一個復雜的過程,受多種信號通路以及卵母細胞和周圍體細胞之間的串擾調節。在成年女性的生殖壽命中,原始卵泡發育為初級、次級和竇狀期卵泡。但是,只有少數卵泡被選擇用于排卵,并且大多數原始卵泡因細胞凋亡而丟失。因此,原始卵泡池是生育力和生殖健康的決定因素。如前所述,卵泡凋亡率增加和卵泡數量峰值減少是POI的標志。
然而,在POI女性中并未發現原始卵泡完全缺失,并且一些卵泡仍保留在這些患者的卵巢中。因此,激活這些休眠卵泡可以被認為是一種有前途的治療方法。為此,確定該過程中涉及的病理機制可以被視為新的治療靶點。卵巢早衰的發生涉及多種機制,包括卵巢炎癥、纖維化、顆粒細胞(GC)凋亡、自噬不足和過度氧化應激(圖1)。

表1:干細胞治療卵巢早衰的臨床前研究
| 干細胞 | 劑量 | 運輸方式 | 年 | 研究成果 | 機制 | 參考號 |
|---|---|---|---|---|---|---|
| BM-MSC-EV | 125μg溶解在 100 μL PBS 中 | IV | 2020年 | ↑ E2 和 AMH ↓ FSH ↑ 基底和竇卵泡數量 抑制 GC 凋亡 | 通過外泌體 mir-144 靶向 PTEN-PI3K/AKT 抑制 GC 凋亡 | 【202】 |
| 骨髓間充質干細胞 | 2×106 | IV | 2021年 | ↑ FSH 和 E2 恢復生育能力 ↑ 卵巢卵泡池 ↓ 卵巢細胞凋亡 ↑ 顆粒細胞增殖和次級卵泡發育 | 通過 TGF-β、Wnt/β-catenin 和 Hippo 途徑控制卵巢卵泡的凋亡、增殖和分化 通過上調 FOXO1、GDF-9 和 Fst 基因以及 Bax/Bcl- 細胞凋亡抑制來恢復卵泡發生過程2、半胱天冬酶3 | [71] |
| BM-MSC-EV | 150μg溶解于100 μL PBS | IV | 2021年 | ↓ FSH和LH ↑AMH和E2 ↓ GC凋亡 | 通過靶向p53的外泌體MiR-644-5p改善卵巢功能并減少GC凋亡 | 【204】 |
| AD-MSC | 1×106 | IP | ↑原始卵泡數 ↓閉鎖卵泡數 ↑AMH ↓卵泡凋亡 | Connexin43和pnnexin1的表達調控 | 【224】 | |
| AD-MSC-EV | 1×106 | IP | 2018年 | ↑ 卵泡數 ↓ GC 凋亡 | 通過上調 SMAD 抑制 GC 凋亡和 GC 增殖 | 【206】 |
| 男性SC | 2×106 | IV | 2017年 | ↑ 卵泡數量 ↓ GC 凋亡 ↑ 再生和卵巢功能 | 分泌 FGF2 的保護作用 | [141] |
| 男性SC | 1×106 | IV | ↑ AMH、FSHR 和 E2 | 不報告 | [39] | |
| 男性SC | 1×106 | IV | 2019年 | ↑ 卵泡數 ↓ GC 凋亡 | ↓ 促凋亡基因表達(如 Bax) ↑ 抗凋亡基因表達(如 Bcl-2) | [126] |
| 間充質干細胞 | 1×106 | IV | 2021年 | ↑ 卵巢大小和數量 ↑ 初級和次級卵泡 ↓ 閉鎖卵泡 ↑ E2 和 ↓ FSH | 通過 AKT 激活發揮抗凋亡和抗炎作用 | [80] |
| 間充質干細胞 | 1×106 | IV | 2019年 | ↑ 卵泡數和 ↓ 閉鎖卵泡 ↑ E2 和 ↓ FSH ↑IL-4 和 ↓ IFN-γ 和 IL-2 | 通過調節 Th1/Th2 細胞因子比率恢復卵巢功能和子宮內膜容受性 | [114] |
| 間充質干細胞 | 5×106 | IV | 2019年 | ↑ E2 和 AMH 卵泡生成恢復 ↑ 懷孕率 | 通過 NGF/TrkA 信號通路改善卵巢功能 | [131] |
| 間充質干細胞 | 2×106 | Orthotopically | 2016年 | ↑ E2 和 AMH ↓ FSH ↑ 竇卵泡數量 | TGF-β的表達和PCNA調節 | [144] |
| 間充質干細胞 | 低(0.25×106),中 (1 × 106)和高 (4 × 106) | IV | 2020年 | ↑ E2 和 AMH 恢復動情周期 ↓ GC 凋亡 | 未報道 | [95] |
| 間充質干細胞 | 1×106 | IV | 2022年 | ↑ FSH 和 E2 ↓ 卵泡閉鎖 抑制 T 細胞增殖 | 通過 PPAR 和膽固醇代謝途徑改善卵巢功能 | 【225】 |
| ID | 階段 | 地位 | 地點 | 細胞類型 | 劑量 | 路線 | 樣本量 | 主要結果 | 次要結果 |
|---|---|---|---|---|---|---|---|---|---|
| NCT02151890 | Ⅰ Ⅱ | 完全的 | 愛資哈爾大學 | 測量 OCT4 標記 | 不適用 | 腹腔鏡注射 | 人數 =40 | 懷孕 | 不適用 |
| NCT05138367 | 我 | 完全的 | 丁麗君,南京大學 | UCA-PSC 或 WJ-MSC | 1×107/400μL | 局部(注入卵巢組織) | n=20 | 卵巢血液灌注 和 竇卵泡直徑 | 卵巢血流指數 |
| NCT02043743 | Ⅰ Ⅱ | 完全的 | 埃爾拉亞德生育中心 | 骨髓間充質干細胞 | 3-5×106/毫升 | 局部(注入卵巢組織) | 人數 =60 | ↓ 血清 FSH 水平 & ↑ 血清 E2 和 AMH | 更年期癥狀消失 |
| NCT02644447 | Ⅰ Ⅱ | 完全的 | 中國科學院 | UC-MSC 和帶有可注射膠原蛋白支架移植的 UC-MSC | 10×106/毫升 | 局部(直接注射至雙側卵巢) | 人數 =23 | 安全性和耐受性 | 竇卵泡發育數量 及血清E2、AMH、FSH水平 及妊娠率 |
| NCT03816852 | 二 | 積極的 | 石諾生物科技有限公司 | 間充質干細胞 | 9×107/毫升 | 四號 | n=12 | 月經變化 | Kupperman 評分 & 卵泡發育 & 激素水平 |
| NCT03069209 | Ⅰ Ⅱ | 積極的 | 阿拉伯干細胞 | 骨髓間充質干細胞 | 不適用 | 四號 | 人數 =50 | 月經周期恢復 | |
| NCT03877471 | 我 | 積極的 | 中國科學院 | 胚胎干細胞衍生的MSC樣細胞 | 3組,每個卵巢低劑量(0.2×107)、中劑量(0.5×107)、高劑量(1.0×107)細胞注射 | 局部(注射至雙側卵巢 | 人數 =28 | 無法使用 | 懷孕、FSH 水平、卵泡功能和子宮內膜厚度增加 |
| NCT05308342 | 不適用 | 招聘 | 丁麗君,南京大學 | 間充質干細胞 | (5×106) 和 (10 × 106) 細胞 | 局部(注入卵巢組織) | 人數=66 | 卵泡發育率 | 卵巢血流指數變化與臨床妊娠率 |
| NCT04815213 | 我 | 招聘 | 約旦大學 | 骨髓間充質干細胞 | 20×106/子房 | 局部(注入卵巢組織) | n=10 | 治療中出現的不良事件的發生率 | 荷爾蒙概況、卵巢變化和子宮內膜變化 |
| NCT02696889 | 不適用 | 招聘 | 伊利諾伊大學芝加哥分校 | 骨髓干細胞 | 不適用 | 局部(注入卵巢組織) | n=3 | 提高診斷荷爾蒙水平 | 改善荷爾蒙水平、恢復月經和成功懷孕 |
| NCT00353197 | 不適用 | 招聘 | 哈達薩醫療組織 | hESC 系的衍生 | 不適用 | 不適用 | n=80 | 不適用 | 不適用 |
| NCT02603744 | Ⅰ Ⅱ | 未知 | 伊朗魯瓦揚研究所 | AD-MSCs | 3 組,其中(5 × 106), (10 × 106) 和 (15 × 106) 細胞 | 局部(注入卵巢組織) | n=9 | 卵巢腫塊 | 荷爾蒙狀況 & 竇卵泡數量 & 竇卵泡體積 & 月經復發率 & 懷孕率 |
| NCT03033277 | Ⅰ Ⅱ | 未知 | 中國科學院 | 間充質干細胞 | 不適用 | 局部(注入卵巢組織) | 人數 =320 | 成熟卵泡數 | 荷爾蒙概況、卵巢體積和懷孕率 |
| NCT01742533 | Ⅰ Ⅱ | 未知 | 深圳市北科生物科技有限公司 | UC-MSC 和 hCBMNC | 不適用 | 不適用 | 人數 =40 | 血清促卵泡激素水平 | 子宮和卵巢特征以及不良事件和嚴重不良事件的發生率 |
| NCT02062931 | Ⅰ Ⅱ | 未知 | 賽義德·巴克里 | BM-MSC 懸浮在富含血小板的血漿 (PRP) 中 | 3-5×106/毫升 | 局部(注射到卵巢組織和韌帶) | 人數 =60 | 血清 FSH 水平降低,血清 E2 和 AMH 水平升高 | 荷爾蒙評估、更年期癥狀的臨床消失和懷孕率 |
干細胞治療卵巢早衰的潛在機制
干細胞可能是治療管理卵巢早衰患者中缺失的一塊拼圖(圖1、圖2)。間充質干細胞在動物模型中的成功結果提高了我們對這些細胞的期望。MSC的功能可以歸因于多種機制,包括自我歸巢和分化到某個階段。激活休眠細胞并鼓勵它們重新進入細胞周期,是間充質干細胞的另一個特性。間充質干細胞能夠遷移到卵巢,并且研究表明卵巢生態位可以吸引來自不同來源的不同類型的干細胞。
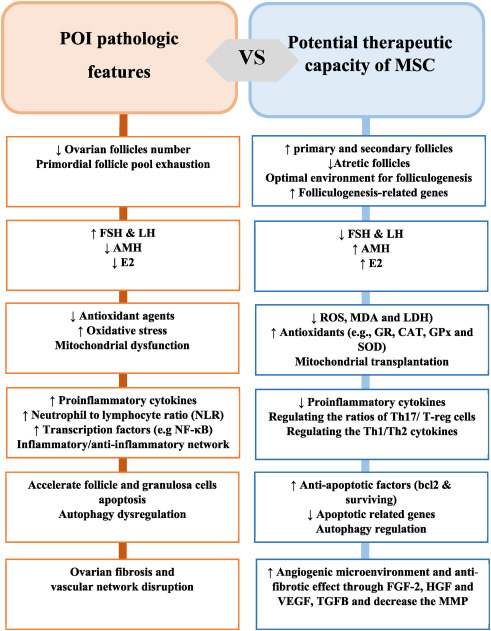
間充質干細胞通過細胞融合和旁分泌因子(如細胞因子、生長因子和激素)恢復受損細胞,并將其基因和細胞器(如線粒體)傳遞給受損細胞。線粒體移植作為一種有前途的治療策略,不僅被認為可以修復線粒體損傷,還可以調節靶細胞的存活、增殖和分化。最近,一些研究報道,線粒體從干細胞轉移到受損細胞可被視為組織損傷的治療策略。在這些條件下,受損細胞能夠從干細胞捕獲健康線粒體以產生ATP,并減少炎癥反應和細胞凋亡。
間充質干細胞可通過調節受損的環境和不足的生長因子替代、血管再生以及生殖細胞或卵泡的恢復來恢復卵巢功能。間充質干細胞在POI疾病中的各種治療機制是通過不同的信號通路介導的。
支持間充質干細胞治療卵巢早衰疾病的臨床前和臨床證據
卵泡發生和激素調節作用:研究表明,BM-MSC和AD-MSC等MSC可以恢復化療引起的卵巢損傷,并可以誘導卵泡發生的最佳環境。增加具有正常結構的卵泡數量是間充質干細胞的主要治療作用。間充質干細胞還可以挽救受損卵巢中的原始卵泡數量并促進卵泡發生。
抗氧化作用:有證據表明,MSC的抗氧化作用可以通過減少ROS、增強宿主抗氧化防御、免疫調節機制、線粒體功能改善以及包括VEGF、HGF和血紅素加氧酶-1 (HO-1) 在內的多種因子的分泌來證明(a具有強抗氧化和抗凋亡特性的應激誘導酶),以及PI3K/Akt、FOXO3a、MAPK 和核因子-紅細胞2相關因子2 (Nrf2)-ARE途徑的激活。間充質干細胞通過其強大的抗氧化和免疫調節作用似乎具有有吸引力的治療潛力(圖1,圖2)。
抗炎作用:間充質干細胞通過細胞間接觸和可溶性介質,可以調節免疫反應并最大限度地減少炎癥相關的組織損傷。據報道,間充質干細胞移植后可最大限度地減少炎癥對卵泡的不利影響并提高卵母細胞質量。MSC對POI的有益作用已顯示出PI3K/pAkt 和過氧化物酶體增殖物激活受體γ (PPAR-γ) 等多種途徑的參與。
對自噬的影響:間充質干細胞增強或抑制自噬途徑的能力仍不清楚。據報道,hUC-MSCs中表達的HO-1可以通過激活JNK/Bcl-2信號通路調節的自噬來恢復POI小鼠模型的卵巢功能。
抗凋亡作用:卵巢細胞中MSC的抗凋亡作用與某些因子(例如VEGF、HGF、表皮生長因子 (EGF) 和IGF-1)的產生、外泌體miRNA的分泌、細胞凋亡的調節有關相關基因,包括Bcl-2、Bax、Caspase3,以及ROS產生的下調。
血管生成和抗纖維化作用:間充質干細胞作為血管生成調節劑,通過分化為內皮細胞和血管平滑肌或釋放促血管生成因子,如VEGF、基質細胞衍生因子1 (SDF1)、 IGF、單核細胞趨化蛋白-1(MCP-1)和FGF-2(圖1、圖2)。VEGF和IGF-1與受體結合后,可以通過PI3K/Akt和GSK3β/β-catenin途徑修復卵巢血管,增強卵泡形成,改善受損卵巢的結構和功能。SDF1參與MSC向血管內皮細胞的分化。
干細胞治療卵巢早衰長期的影響
除了POI的短期影響外,過早停用雌激素還會影響作為雌激素作用主要靶點的各種器官。這些影響表現為各種疾病,如心血管疾病(CVD)、骨質疏松癥、代謝綜合征(MetS)和認知障礙。心血管疾病是導致POI患者預期壽命縮短的主要原因。
因此,這些患者的候選治療方案最好也能解決這些問題。雖然目前還沒有一項全面的研究來探討間充質干細胞對POI患者長期并發癥的治療效果,但由于間充質干細胞的獨特性質,我們認為間充質干細胞除了對卵巢功能有治療作用外,還可以被認為是治療這些患者上述長期并發癥的合適候選藥物。下文將討論我們的假設。
由于雌激素對膽固醇代謝、減少冠狀動脈收縮和動脈粥樣硬化斑塊的影響,POI女性雌激素水平低可能是增加這些患者心血管疾病風險的一個因素。
間充質干細胞是心臟修復的有效介質,通過刺激修復機制,如免疫調節作用、纖維化抑制、心臟干細胞增殖和心肌細胞分化以及促進細胞凋亡抵抗(圖1、圖2)。因此,間充質干細胞治療心臟病患者的可行性和安全性已在多項已完成和正在進行的臨床試驗中進行了測試,其結果表明間充質干細胞可以改善這些患者的相關臨床參數。
骨質疏松癥是一種全身性代謝性骨病,其特征是骨質量下降和微結構退化。研究表明骨質疏松癥與絕經后雌激素缺乏有直接關系。研究還表明,POI患者的峰值骨量 (PBM) 形成和骨礦物質密度 (BMD) 狀態受到低雄激素血癥和低雌激素血癥的影響。骨質疏松癥的主流治療是通過藥物干預刺激成骨或抑制進一步骨吸收。然而,此類治療無法逆轉現有的骨質流失,并且可能會產生副作用,包括頜骨壞死、癌癥、血栓栓塞事件和中風。間充質干細胞移植的臨床前研究通過成骨分化、血管生成誘導以及骨重塑、形成和吸收之間的協調提供了骨愈合的證據(圖1)。
代謝綜合征是一種復雜的臨床病癥,已成為一種威脅性的全球流行病。與正常人相比,受代謝綜合征影響的人更有可能患上糖尿病、癌癥、骨質流失、心血管并發癥和非酒精性脂肪肝 (NAFLD) 等疾病。目前的醫療實踐無法為診斷出患有這種綜合征的患者提供解決方案。研究發現MSC對多個代謝綜合征具有積極影響,并且已被證明是安全有效的。
間充質干細胞治療卵巢早衰患者中的臨床應用
基于間充質干細胞在POI動物模型中的良好治療效果和一些臨床前研究,在POI患者中進行了大量研究間充質干細胞治療卵巢功能不全的療效和安全性的臨床試驗。
第一項臨床研究表明,由于卵巢恢復現象,骨髓間充質干細胞移植可能成為POI女性的一種有前景的治療方法。使用骨髓間充質干細胞可使診斷為POI的女性實現卵泡再生、AMH水平升高并成功懷孕。
其他幾項研究報告了骨髓間充質干細胞在一些POI患者中的潛在用途。兩項針對10名和30名POI女性的研究報告了類似的方法,表明在自體間充質干細胞移植后恢復了月經并成功懷孕。
根據上述令人鼓舞的數據,除骨髓間充質干細胞之外的其他來源的干細胞也顯示出與解決卵巢功能不全有關的類似結果。
中國科學院動物研究所干細胞與生殖生物學國家重點實驗室在Cell Prolif 雜志上發表了一篇題為《人臍帶間充質干細胞異體移植治療卵巢早衰的臨床分析》的文章。研究人員移植注射GMP臨床級臍帶間充質干細胞(UCMSCs)到POI患者卵巢,長期隨訪發現臍帶間充質干細胞能夠有效地恢復卵巢功能,促進卵母細胞成熟。經體外受精(IVF)和胚胎移植后,4例患者在移植后成功受孕,嬰兒均發育正常。

最重要的是,研究結果表明,臍帶間充質干細胞移植在一定程度上通過增加卵泡發育和改善卵細胞收集,挽救了POI患者的卵巢功能。此外,閉經時間較短的患者似乎更有可能從治療中獲益,而基本的卵巢狀況(如術前胃竇卵泡)是影響干細胞治療結果的另一個重要因素。
間充質干細胞的良好安全性已在不同的臨床應用(例如不孕癥)中得到證明。盡管有限的小樣本試驗表明間充質干細胞在POI女性中一年多的安全性,但長期安全性和不良事件有限。
因此,進一步全面、更大規模的臨床研究對于建立標準化制劑并確保間充質干細胞治療生殖系統的安全性至關重要。
結論和未來展望
卵巢早衰不僅會影響女性的生育能力,還會影響她們的心理健康和其他器官的功能。盡管做出了許多努力,但迄今為止還沒有適當的治療方法。鑒于其免疫原性低、易于獲取以及體外大量復制的可能性,干細胞可以被認為是卵巢早衰患者新的有希望的治療候選者。
臨床前數據表明,干細胞可以通過其抗炎、抗氧化、抗凋亡、抗纖維化和血管生成等多種保護機制,遷移到受損的卵巢并改善卵巢功能。然而,干細胞在這種特殊疾病中的確切機制尚未被揭示,并且在臨床應用之前應解決一個瓶頸。
移植的間充質干細胞在正常和炎癥狀態下不同水平的生理免疫反應中的功能、適當的劑量和給藥方法、間充質干細胞的壽命和免疫調節活性的穩定性是一個尚未得到解答的重要問題。此外,將間充質干細胞與藥物方法或補充間充質干細胞特性的替代細胞類型結合使用可被視為其他潛在策略。目前,可以肯定的是,該研究提供了一個干預卵巢早衰切實可行的治療方法。
參考資料:https://doi.org/10.1016/j.heliyon.2023.e23271
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信