1型糖尿病(T1D)是一種以胰島β細胞自身免疫性破壞為特征的慢性代謝性疾病,2021年全球約有840萬患者,其中兒童和青少年占比超過50%。目前的治療方法包括胰島素治療和降糖藥物,可以控制病情,但無法治愈。近年來,干細胞技術的突破性進展為T1D的根治帶來了曙光——從細胞替代到免疫調控,從功能修復到病因干預,科學家們正通過多種治療方法重構糖尿病治療的范式。
邁向治療前沿:干細胞治療1型糖尿病的最新敘述性綜述
近日,一項發表于《World Journal of Pediatrics》上的重磅研究表明干細胞療法有望成為治療1型糖尿病(T1D)的一條新途徑,有助于β細胞再生,并減少對外源性胰島素的依賴[1]。
該研究是由迪拜大學醫學院聯合迪拜安曼曼哈頓巴希爾醫院婦幼醫院兒科開展的題為“Advancing toward a curative frontier: an updated narrative review on stem-cell therapy in pediatric type 1 diabetes”(邁向治療前沿:干細胞療法治療小兒1型糖尿病的最新綜述)的研究,為治療1型糖尿病帶來了新方向。
本綜述探討了干細胞療法作為T1D轉化和治愈方法的潛力,重點關注其在再生β細胞方面的潛力以及解決兒童群體特有的挑戰。
1型糖尿病的疾病特征與流行病學
1型糖尿病(T1D)是兒童期最常見的慢性疾病之一,其核心病理機制為免疫介導的胰腺β細胞破壞,導致胰島素絕對缺乏與慢性高血糖。全球2021年T1D患者約840萬,預計2040年將增至1740萬,其中兒科人群患病率上升尤為顯著。
超過半數三歲以下患兒以糖尿病酮癥酸中毒(DKA)為首發癥狀,而非典型多飲多尿,且疾病負擔存在地域差異:低收入國家10歲確診患兒的預期壽命僅13歲,而高收入國家可達65歲。此外,T1D不僅縮短預期壽命、降低生活質量,其長期并發癥(如心血管疾病、腎病、神經病變及視網膜病變)更對家庭與醫療系統造成沉重經濟壓力。
現有治療的局限與挑戰:當前T1D管理依賴外源性胰島素替代(皮下注射或泵輸注)及輔助藥物(二甲雙胍、GLP-1受體激動劑、SGLT2抑制劑),雖可控制血糖但無法根治疾病。例如,二甲雙胍雖減少胰島素用量卻難以改善HbA1c水平,而SGLT2抑制劑雖調控代謝卻增加酮癥酸中毒風險。胰腺或胰島移植雖能實現血糖正常化并減少并發癥,但僅限特定重癥患者,且需終身免疫抑制治療以對抗排斥反應,極大限制了其臨床應用。
干細胞治療1型糖尿病的潛力與未來方向
鑒于1型糖尿病(T1D)的患病率不斷上升,需要終身服藥,且傳統治療方法(尤其是在兒科人群中)存在潛在的副作用,我們撰寫本綜述的主要目的是提供關于干細胞療法作為1型糖尿病(T1D)治療變革性方法的潛力的最新、全面的見解。通過深入探討其在再生功能性β細胞方面的潛力,我們探討了最新的科學進展及其臨床應用面臨的障礙,包括安全性和有效性相關的挑戰,以及可能限制其應用的經濟和倫理障礙。
治療1型糖尿病的干細胞類型有哪些?
干細胞是存在于胚胎和成體組織中的未分化細胞,具有在生物體中發育成任何類型細胞的獨特能力,并可無限復制。
這些細胞可分為多種不同類型:自然產生的胚胎干細胞 (ESC)、圍產期干細胞和成體干細胞 (ASC);人工產生的誘導性多能干細胞 (iPSC);以及在癌癥中發現的表現出某些干細胞樣特征的病理細胞,即癌癥干細胞 (CSC) 。表1總結了干細胞在治療兒童1型糖尿病 (T1D) 中的應用類型及其挑戰。
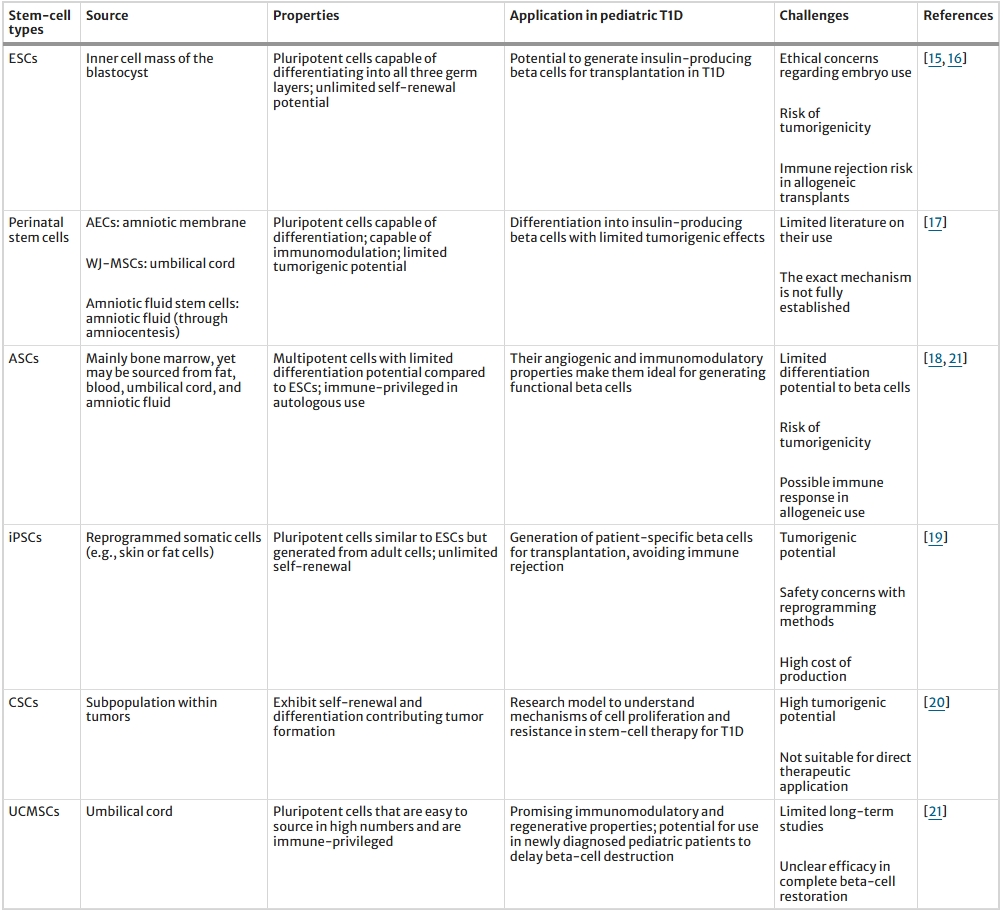
T1D1型糖尿病、ESC胚胎干細胞、AEC羊膜上皮細胞、WJ-MSC華通氏膠間充質干細胞、ASC成體干細胞、iPSC誘導性多能干細胞、CSC癌癥干細胞、UCMSC臍帶干細胞
1.胚胎干細胞(ESC):胚胎干細胞源自囊胚內細胞團(ICM),自20多年前首次分離后,成為研究多能性的金標準。
ESC在體外可無限自我更新并保留分化全能性,但其天然存在僅限胚胎植入前階段,后續有絲分裂伴隨定型過程導致多能性喪失。通過酶解ICM并在嚴格條件下培養,ESC系可長期維持未分化狀態,為再生醫學(如β細胞定向分化)提供理想種子細胞,但其倫理爭議與致瘤風險仍需審慎考量。
2.圍產期干細胞:圍產期干細胞介于ESC與成體干細胞之間,涵蓋羊膜上皮細胞(AEC)、華通氏膠間充質基質細胞(WJ-MSC)及羊水干細胞。
AEC可跨胚層分化,煙酰胺誘導下可生成葡萄糖響應性胰島素分泌細胞,但分化效率低且關鍵轉錄因子(如PDX-1)表達不足。WJ-MSC經蛋白酶消化分離,雖易受過度消化影響活力,但其高胰島素分化潛力、改善糖尿病動物高血糖的能力及巢蛋白表達特征,使其成為胰島再生的優選起點。羊水干細胞兼具免疫調節與分化功能,但保護內源性β細胞的作用僅限于高血糖前干預。
3.成體干細胞(ASC):成體干細胞以骨髓中的造血干細胞(HSC)和間充質干細胞(MSC)為代表,臨床應用已逾30年,成功治愈血液疾病患者。
MSC具免疫豁免性,可取自骨髓、脂肪、臍帶等多組織,體外擴增能力強(>80群體倍增),分化潛力接近多能干細胞。其血管生成與免疫調節特性,結合個性化醫療需求,使MSC成為功能性β細胞生產的理想候選,尤其適用于T1D的免疫微環境修復與組織再生。
4.誘導性多能干細胞(iPSC):iPSC通過重編程體細胞過表達多能性因子獲得,兼具ESC的無限增殖與三胚層分化能力,甚至可生成生殖細胞。
其優勢在于規避倫理爭議并提供自體細胞來源,但重編程效率、基因組穩定性及定向分化精準性仍需優化。iPSC衍生胰島細胞的研究為T1D的個體化治療開辟新路徑,尤其在異體移植排斥風險控制方面潛力顯著。
5.癌癥干細胞(CSC):癌癥干細胞是腫瘤中具有自我更新、多向分化及致瘤能力的特殊亞群,通過對稱分裂維持群體,獨特基因表達譜使其區別于普通腫瘤細胞。
盡管CSC研究主要聚焦腫瘤發生機制,但其異常激活的干細胞特性為理解細胞命運調控提供了逆向模型,間接推動正常干細胞分化策略的優化,但其直接應用受限于致瘤風險,目前尚未納入T1D治療探索。
干細胞治療1型糖尿病的當前臨床進展
正在進行的試驗:在許多疾病中,尤其是在兒科人群中,干細胞療法在改善預后和降低死亡率方面取得了巨大進展。據我們所知,目前尚無研究強調干細胞療法在兒科1型糖尿病(T1D)患者中產生胰島素的潛力。然而,多項正在進行的試驗已顯示出干細胞療法在成人1型糖尿病(T1D)患者中具有良好前景,這些結果有望在兒科人群中進行驗證。
VX-880:VX-880是一種在研的異基因干細胞來源、完全分化、可產生胰島素的胰島細胞療法,采用專有技術生產。VX-880目前正在評估其對患有低血糖意識受損和嚴重低血糖的1型糖尿病 (T1D) 患者的療效。
VX-880有望通過恢復胰島細胞功能(包括葡萄糖反應性胰島素的產生)來恢復人體調節血糖水平的能力。VX-880通過輸注至肝門靜脈輸送,需要長期免疫抑制治療以保護胰島細胞免受免疫排斥。
2024年6月,Vertex宣布正在進行的VX-880治療1型糖尿病的1/2期研究取得積極成果,并在美國糖尿病協會第84屆科學會議上發表。

結果初步發現,12名參與者中有11名減少或消除了對外部胰島素的需求。此外,所有接受全劑量治療的參與者都表現出胰島素分泌(以C肽衡量),沒有出現嚴重的低血糖癥,并且血糖控制得到改善,70%以上的時間內HbA1c值低于7%。由于現有美國食品藥品監督管理局 (FDA) 批準的胰島移植療法主要依賴于捐贈的胰腺,因此可用性可能有限,這使得干細胞衍生的胰島成為一種可擴展的治療替代方案。
同樣,2024年在中國進行的另一項研究表明,一名25歲的1型糖尿病女性不再需要注射胰島素,在移植源自她自身脂肪細胞并化學轉化為iPSC的產生胰島素的胰島細胞后75天內,血糖水平持續處于健康范圍內在一年的隨訪中,所有安全性和有效性結果均得到滿足,沒有出現移植相關異常的跡象。

探索1型糖尿病 (T1D) 干細胞治療的研究也表明,臍帶間充質干細胞 (UCMSC) 可能優于其他類型的MSC,例如來自骨髓的MSC,因為它們獲取簡單、無痛、成本低,而且從原始來源獲得的年輕細胞產量相對較高。UCMSC也具有治愈潛力,因為它們不需要完美的人類白細胞抗原 (HLA) 組織配型,移植物抗宿主病 (GVHD) 發生率較低,并且可以同種異體使用,尤其是在保留臍帶的兒科人群中。
目前正在兒科人群中進行的一項II期臨床試驗表明,臍帶細胞在成人群體中控制T1D方面具有良好的免疫調節特性。試驗納入了年齡在18至50歲之間新診斷的1型糖尿病 (T1D) 患者,并向他們輸入臍帶血,目的是調節疾病的自身免疫特性并阻止胰腺β細胞破壞而不是替換它們。這強調了臍帶細胞可作為T1D低成本治療方法的另一種機制。
總體而言,在新診斷為T1D的兒科患者中,有69%的患者在接受胰島素治療后會自發且暫時地恢復β細胞功能,但這一比例會隨著疾病的發展而下降,90%的患者在確診一年后不再屬于這一類別,這強調了采取緊急行動的必要性。這些研究共同表明,在不久的將來可以為T1D患者實施干細胞治療。
現干細胞治療兒童1型糖尿病面臨的挑戰
干細胞治療1型糖尿病考慮的問題之:安全性和有效性
多年來,個性化醫療在兒科人群中引起了廣泛關注,可根據基因圖譜、藥物反應和其他生理因素提供定制的管理策略。在針對1型糖尿病 (T1D) 等疾病的干細胞治療背景下,這些策略前景光明,但在安全性和有效性方面也面臨著獨特的挑戰。
療效不足與免疫調控的雙重困境:干細胞治療的核心挑戰在于功能性β細胞重建的延遲與不充分。盡管個性化醫療策略(如基因編輯)通過CRISPR-Cas9技術靶向擴增胰腺轉錄因子(如PDX-1)可改善分化效率,但臨床數據顯示,移植后患者仍依賴胰島素或口服降糖藥長達22.7個月。這種療效滯后主要歸因于干細胞分化的不完全性,且基因編輯可能意外誘導新抗原表達,觸發免疫排斥。
此外,免疫抑制療法雖能降低排斥風險(如59%患者實現短期胰島素獨立),但其在兒童中的長期安全性存疑:約52%患者出現中性粒細胞減少性發熱等不良反應,嚴重感染甚至導致3.5%的死亡率,凸顯療效與免疫平衡的精細化調控需求。
免疫抑制治療的兒童特異性風險:兒科患者免疫系統發育未成熟,對免疫抑制藥物的耐受性更差。研究顯示,自體干細胞移植雖可減少移植物抗宿主病(GVHD),但仍需低劑量免疫抑制劑維持,而機會性感染(如銅綠假單胞菌膿毒癥)仍是致命威脅。Meta分析指出,降低藥物劑量可減少感染風險,但可能犧牲移植物存活率。
此外,兒童生命周期長,需長期隨訪評估免疫抑制對生長發育、器官功能及繼發腫瘤的潛在影響,這對治療方案設計提出更高要求——需在避免過度抑制與維持移植物功能間取得精準平衡。
致瘤性風險與技術優化路徑:干細胞治療的核心安全隱患在于致瘤性。體外分化中β細胞的自發轉化(如c-Myc過表達誘導的惡性腫瘤)及臨床案例(如iPSC移植后注射部位腫塊伴OCT3/4/SOX2陽性)警示腫瘤發生風險。解決方案聚焦于技術革新:
- ①免疫屏蔽策略:封裝生物材料(如海藻酸鹽微囊)可物理隔絕免疫攻擊,避免長期免疫抑制;
- ②靶向分化優化:通過單細胞測序篩選高純度前體細胞,降低未分化細胞殘留;
- ③移植位點選擇:優先血管化區域(如腎包膜或腹直肌鞘)可提升移植物存活并減少免疫暴露。這些進展為平衡療效與安全性提供了新方向,但仍需大規模臨床驗證。
干細胞治療1型糖尿病考慮的問題之:經濟考慮
高昂成本與成本效益爭議:干細胞治療T1D的直接費用為15萬至40萬美元/患者,遠超傳統胰島素治療。盡管研究顯示術后三年可能通過減少胰島素依賴與并發癥管理實現成本效益(如質量調整生命年提升),但療效持久性存疑削弱了費用合理性。例如,若治療效果僅維持數年,重復治療將加劇經濟負擔,使醫保支付方與家庭陷入“短期高投入”與“長期收益不確定”的權衡困境,尤其在兒科人群長期生存周期中更為顯著。
醫療資源分配失衡與公平性挑戰:高昂成本加劇醫療不平等:低收入家庭難以承擔治療費用,而現有補償機制(如參與臨床試驗)無法覆蓋廣泛人群。基礎研究結果提示成本效益可能僅適用于高收入群體,可能不會擴展到低收入人群,進一步擴大全球醫療差距。此外,傳統糖尿病管理(如胰島素泵)本身的高昂費用已造成資源傾斜,干細胞治療若無法普適化,可能成為“奢侈品療法”,加劇社會健康分層。
干細胞治療1型糖尿病考慮的問題之:倫理問題
干細胞治療T1D的倫理爭議聚焦于風險-收益失衡與特殊人群保護:其致瘤潛力與長期療效不確定性可能導致患者承擔高昂經濟負擔(單次治療達15萬-40萬美元)與健康風險,而兒童作為主要受試群體引發更大倫理爭議——批評者認為,部分高風險試驗應優先在成人中開展以減少對未成年人的非必要暴露。
此外,盡管自體干細胞移植因規避胚胎破壞(如使用ASC替代ESC)降低了倫理爭議,但公眾對“細胞操縱”的普遍道德質疑仍可能阻礙治療接受度與研究推進,尤其是涉及胚胎來源干細胞(ESC)時,其“潛在生命”屬性持續挑戰倫理邊界。如何在科學突破與生命倫理間取得平衡,成為該領域臨床轉化的重要命題。
干細胞治療對兒童1型糖尿病的未來影響
干細胞治療為兒童1型糖尿病(T1D)的管理帶來了革命性希望,尤其針對傳統療法的局限性。兒童因認知能力與行為發展的不成熟,常難以理解病情管理的重要性,導致血糖波動頻繁(如高血糖與低血糖交替)及運動受限(父母因擔憂低血糖而減少孩子活動)。干細胞療法通過重建功能性胰島β細胞或調節免疫攻擊,可能實現內源性胰島素分泌的恢復,從而減少血糖監測與注射的日常負擔,并降低長期高血糖引發的認知功能損害風險。
例如,中國團隊通過自體干細胞移植使兒童患者在8天內停用胰島素,血糖穩定達正常水平,展現了早期干預的潛力。此外,整合醫學策略(如腸道菌群重建聯合免疫調節)在疾病早期可喚醒殘存β細胞,減少對免疫抑制的依賴,為兒童提供更安全的治療選擇。
未來應用干細胞療法或許能夠解決1型糖尿病(T1D)面臨的這些挑戰和障礙,盡管其長期療效和不良反應仍有待評估。在兒科人群中實施干細胞療法的潛在障礙包括他們的免疫系統仍在發育。在這種情況下,免疫反應可能會引發意想不到的并發癥,而這些并發癥可以通過傳統療法避免。此外,由于兒童無法提供知情同意,導致其照護者不得不在不確定的益處和風險之間權衡,因此也存在倫理困境。在臨床環境中使用干細胞療法之前,需要制定明確的指導方針。
未來研究和臨床前景
干細胞治療1型糖尿病的未來研究與臨床前景聚焦于技術優化、安全性提升及可及性拓展。隨著化學重編程技術(如中國團隊利用自體CiPS細胞實現患者15個月無胰島素依賴)和封裝技術(如ViaCyte的VC-02植入物結合CRISPR基因編輯規避免疫抑制)的突破,干細胞分化為功能性胰島β細胞的效率與移植存活率顯著提高。
未來研究需攻克分化精準性(如確保細胞響應血糖動態分泌胰島素)、降低致瘤風險(如優化基因編輯避免c-Myc等致癌因子激活)及免疫調控(如開發通用型細胞或生物材料屏蔽技術)。
此外,成本控制(單次治療15萬-40萬美元)與兒童特異性數據積累(如免疫系統發育影響療效評估)是臨床推廣的關鍵。跨學科整合(如AI輔助個性化方案)及國際合作將加速從“功能性治愈”向普惠性療法的轉化,最終實現1型糖尿病的根本性突破。
寫在最后:總而言之,干細胞療法作為一種潛在的1型糖尿病(T1D)治愈方法,前景廣闊,為再生功能性β細胞提供了突破性的可能性。這將解決潛在的自身免疫性破壞,并已在臨床前和早期臨床試驗中顯示出令人鼓舞的結果。然而,仍然存在一些擔憂,尤其是在分化效率、免疫排斥、致瘤性以及這些方法在兒科人群中的長期安全性方面。
盡管存在這些挑戰,但持續的研究對于改進這些療法、提高其安全性和有效性至關重要,最終為1型糖尿病(T1D)的胰島素依賴型療法提供可持續的替代方案,并顯著改善患兒及其家庭的生活質量。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。
主要參考資料:[1]Sulaiman, S., Alaarag, A., Rayyan, N. et al. Advancing toward a curative frontier: an updated narrative review on stem-cell therapy in pediatric type 1 diabetes. World J Pediatr (2025). https://doi.org/10.1007/s12519-025-00908-4



 掃碼添加官方微信
掃碼添加官方微信