近日,Gamida cell在美國移植和細胞治療學(xué)會(ASTCT)和國際血液和骨髓移植研究中心(CIBMTR)串聯(lián)會議上公布了兩款細胞療法的最新進展,包括:
●干細胞療法Omisirge的擴大準(zhǔn)入計劃(EAP)研究數(shù)據(jù)
●NK細胞療法GDA-201治療非霍奇金淋巴瘤的1期試驗數(shù)據(jù)
這些數(shù)據(jù)進一步證明了Gamida Cell的煙酰胺(NAM)技術(shù)通過增強細胞來開發(fā)潛在治愈療法的潛力。

全球首款同種異體干細胞移植療法新數(shù)據(jù)公布!1年總生存期達84.2%
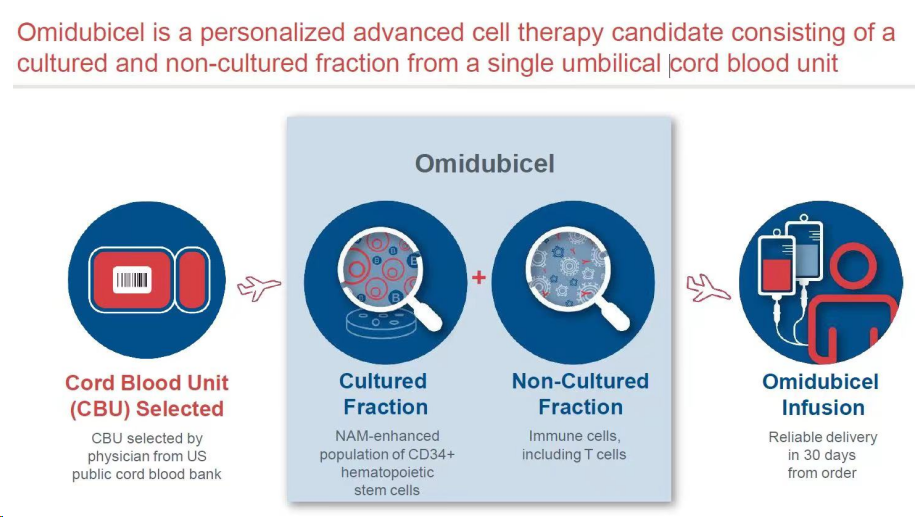
Omisirge是一款煙酰胺(NAM)修飾的同種異體臍帶血(UCB)來源的造血干細胞療法,于2023年4月17日被FDA批準(zhǔn)上市,用以降低12歲及以上成人和兒童血癌患者因干細胞移植所發(fā)生的感染。受此消息影響,Gamida股價在當(dāng)日暴漲50%,市值拉回9000萬美元。而Omisirge是首款獲批的現(xiàn)貨型細胞療法,也是全球首款基于大規(guī)模III期臨床獲批的現(xiàn)貨型干細胞移植療法。Omisirge以單次靜脈內(nèi)劑量給藥,由來自臍帶血的人類同種異體干細胞組成,這些干細胞與煙酰胺(維生素B3的一種形式)一起處理和培養(yǎng)。
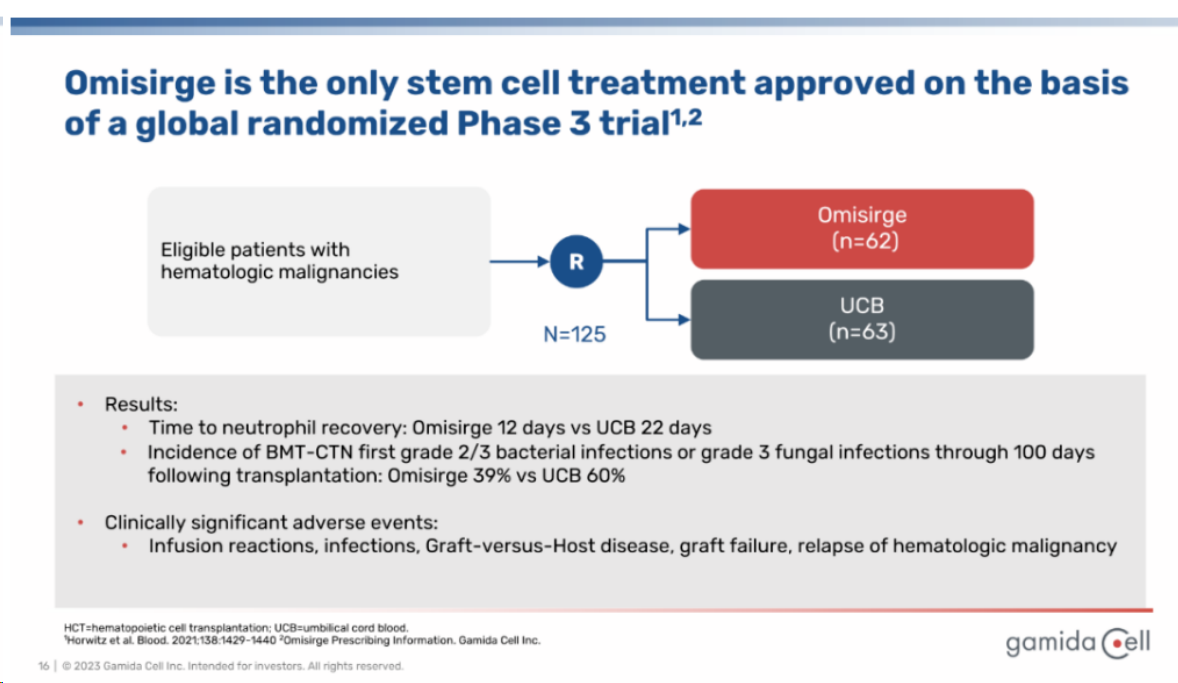
在近期公布的擴大準(zhǔn)入計劃(EAP)中,評估了29例接受Omisirge異基因造血干細胞移植(allo-HCT)的惡性血液病患者治療結(jié)果。該研究允許調(diào)理方案和支持性護理的機構(gòu)可變性,更密切地反映現(xiàn)實世界的環(huán)境,為患者提供在完成3期試驗招募后、Omisirge獲批前治療的機會。
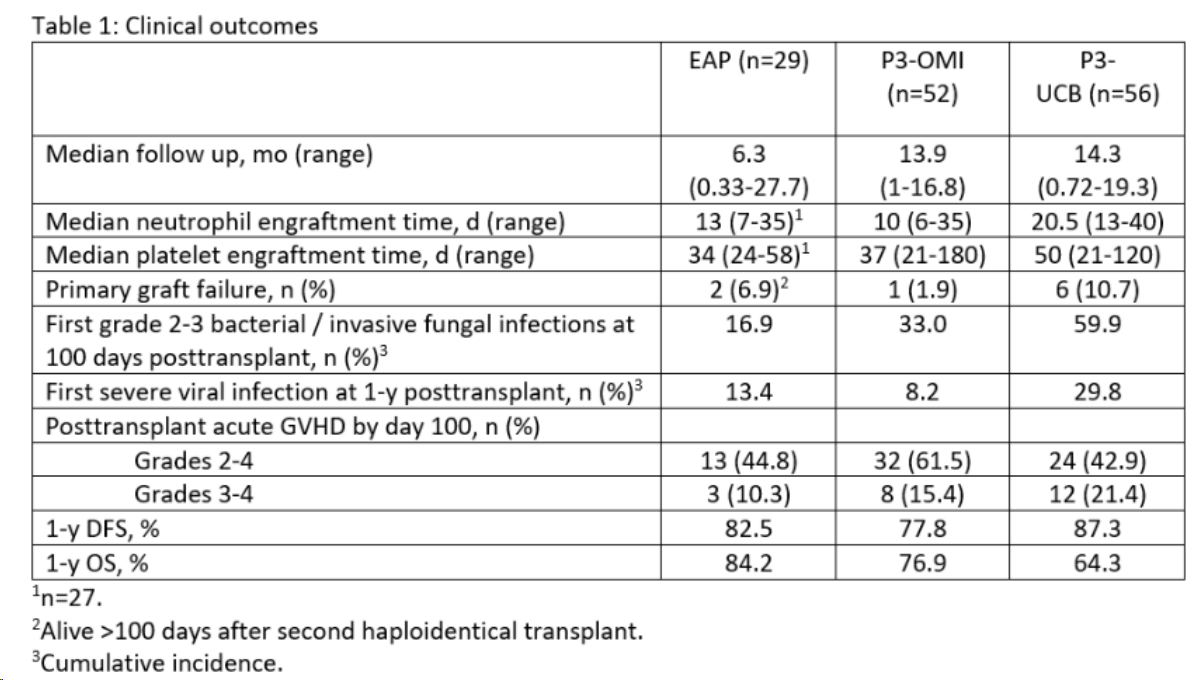
EAP組的數(shù)據(jù)顯示:中性粒細胞和血小板植入的中位時間分別為13天和34天。感染(移植后100天的一級2-3級細菌/侵襲性真菌感染)為16.9%、3-4級移植物抗宿主病為10.3%、無病生存期(DFS)為82.5%和1年總生存期(OS)為84.2%,除了DFS低于P3-UCB實驗的87.3%外,其余結(jié)果優(yōu)于先前的omidubicel 3期研究,這表明接受Omisirge移植的患者造血功能恢復(fù)迅速,移植后嚴(yán)重感染的發(fā)生率較低。
2019年,僅美國本土就約有8000名12歲及以上的血液惡性腫瘤患者接受了異體干細胞移植手術(shù),其中多數(shù)患者將造血或骨髓干細胞移植作為臨床治療首選,以恢復(fù)患者骨髓功能。然而,并非所有患者都能尋到適配供體,臍帶血等替代品往往成為了患者的“沙漠之水”。但由于臍帶含有較少的干細胞和祖細胞,可能需要更長的時間植入,增加患者的感染風(fēng)險,也延長了住院時間。
Omisirge獨特之處是,它屬于經(jīng)過大幅改良的同種異體(現(xiàn)貨型)臍帶血細胞療法。作為全球首款現(xiàn)貨型干細胞移植療法,從機制上來講,Omisirge可使用離體培養(yǎng)來擴增和增強可移植的造血干細胞,從而實現(xiàn)更快的植入和潛在的降低移植相關(guān)并發(fā)癥的風(fēng)險。在臨床方面,Omisirge與其他用于移植并發(fā)癥的生長因子和免疫抑制藥物相比,提供了更加精準(zhǔn)和個性化的造血干細胞移植預(yù)后管理方法。
冷凍保存的NK細胞療法GDA-201
GDA-201是一在NK細胞擴增過程中加入NAM(煙氨酸)制得的NK細胞產(chǎn)品,用于治療血液病和實體瘤。在臨床前研究中,NAM-NK表現(xiàn)出更好的細胞毒性以及更高的歸巢受體的表達,增殖能力和存活期得到增強。
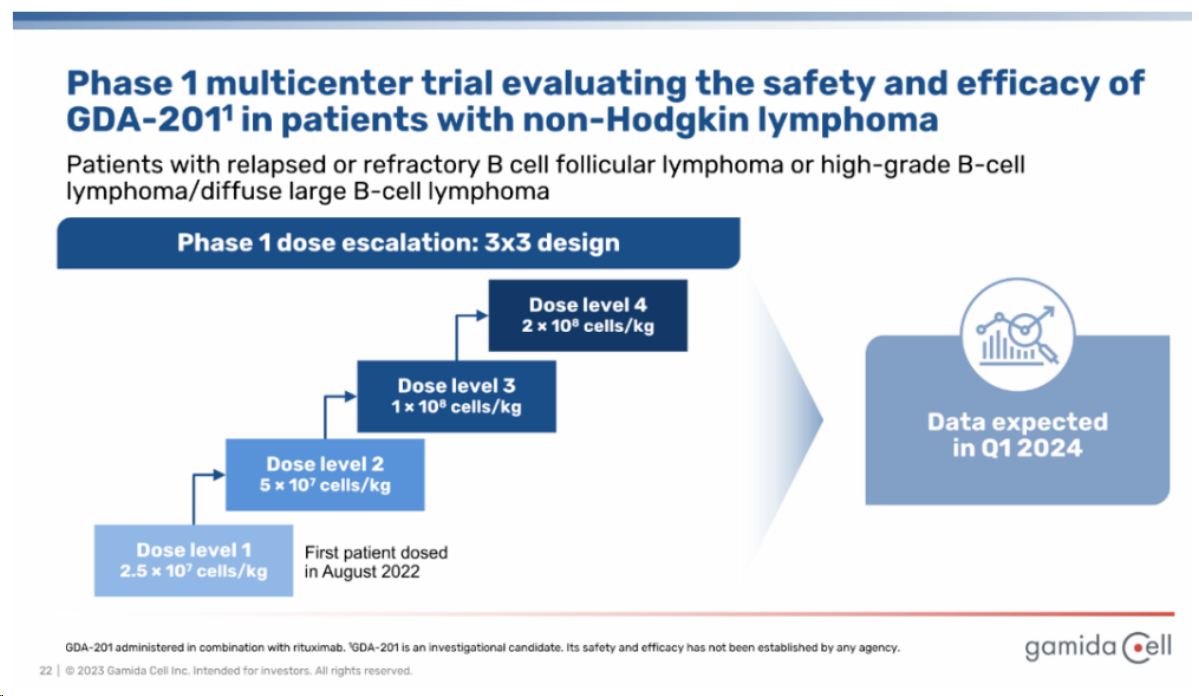
在這項正在進行的針對復(fù)發(fā)/難治性B細胞CD20陽性非霍奇金淋巴瘤患者的同種異體冷凍保存NK細胞療法候選藥物GDA-201的多中心1期研究中,提供了前12名患者的初步數(shù)據(jù)。患者接受了包括CAR-T細胞治療和造血干細胞移植在內(nèi)的6種預(yù)先治療。
患者分為四個劑量組(2.5×107,5 x107,1×108和2×108細胞/千克),并與利妥昔單抗聯(lián)合用藥。沒有輸注反應(yīng)、劑量限制性毒性或相關(guān)的嚴(yán)重不良事件。7名患者腫瘤負荷下降。使用淋巴瘤療效評價標(biāo)準(zhǔn)Lugano進行的療效評估顯示,3名患者完全緩解(CR 42.9%),2名患者部分緩解(ORR 71.4%),2名患者病情穩(wěn)定。兩名患者報告了細胞因子釋放綜合征(分別為1級和2級),尚無免疫效應(yīng)細胞相關(guān)神經(jīng)毒性綜合征或移植物抗宿主病病例。該研究第四隊列患者的最高劑量水平為2×108個細胞/kg,目前正在進行治療和評估。完整結(jié)果預(yù)計將于2024年第一季度公布。
Gamida cell擁有其專有的NAM技術(shù),旨在擴大靶細胞的數(shù)量并增加其功能,以增強靶細胞在開發(fā)為細胞治療候選藥物時的內(nèi)在特性。其一方面可以抑制培養(yǎng)細胞的快速分化,從而提高干細胞和祖細胞在細胞培養(yǎng)過程中的擴增;另一方面可減少細胞特征的變化,從而提高在培養(yǎng)條件下擴增的造血干細胞的功能,包括它們在骨髓中的遷移、歸巢和定植。
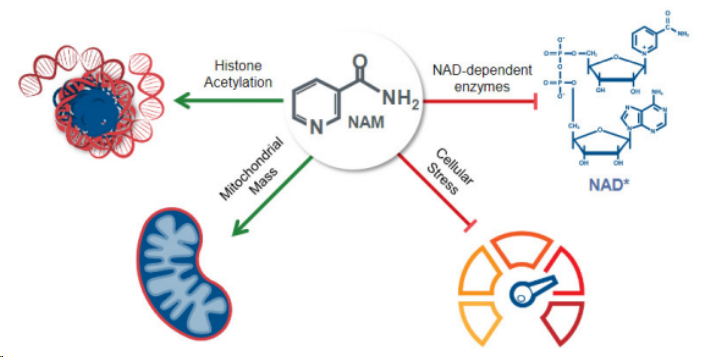
研究表明,與正常NK細胞相比,以NAM擴增的NK細胞增殖更快,壽命更長,尤其擅長產(chǎn)生炎癥分子,并將其他免疫細胞招募到腫瘤中。此外,當(dāng)與靶向抗體組合時,NAM-NK顯示出增強的抗體依賴性細胞毒性(ADCC)。
我國干細胞療法未來可期
間充質(zhì)干細胞(MSC)是再生醫(yī)學(xué)中常用的干細胞類型,其廣泛存在于其他組織中,包括脂肪組織、牙髓、腎臟、肺、肝臟以及圍產(chǎn)組織中(胎盤和臍帶等)。科學(xué)家們發(fā)現(xiàn)從臍帶中分離培養(yǎng)的間充質(zhì)干細胞可對人體組織和器官有修復(fù)和再生的能力,且不受醫(yī)學(xué)倫理的困擾。所有的新生兒臍帶組織中都含有大量的干細胞,讓采集變得簡易可行。同時,在儲存方面,干細胞易于分離,純度高,無污染。擴增時培養(yǎng)體系統(tǒng)一,便于質(zhì)控。可制成種子細胞凍存,細胞損耗小。
時至今日,在全球范圍內(nèi)臍帶、胎盤間充質(zhì)干細胞已經(jīng)開展了上千項臨床研究,治療的疾病多為現(xiàn)階段多發(fā)性及疑難治療的疾病,包括關(guān)節(jié)炎、中風(fēng)、肝臟疾病、糖尿病、心血管疾病等。據(jù)Precedence Research數(shù)據(jù),2021年全球干細胞治療市場規(guī)模為98.7億美元,預(yù)計到2030年將達到314.1億美元左右,并有望在2022年至2030年的預(yù)測期內(nèi)以13.73%的復(fù)合年增長率(CAGR)增長。
在當(dāng)下世界各國你追我趕的激烈競爭中,國內(nèi)干細胞已經(jīng)從過去的跟跑、并跑,迅速進入領(lǐng)跑世界再生醫(yī)學(xué)的國際第一方陣。尤其是在近兩年來,國內(nèi)干細胞再生醫(yī)學(xué)技術(shù)已經(jīng)進入高度成熟期和市場井噴期,繁花時代正在來臨,中盛溯源、霍德生物、啟函生物、睿健醫(yī)藥、呈諾醫(yī)學(xué)、艾爾普再生醫(yī)學(xué)等多家企業(yè)均有產(chǎn)品在2023年成功進入臨床階段。
放眼全局,2023年國內(nèi)共有31款干細胞藥物臨床試驗申請獲CDE受理(搜索關(guān)鍵詞“干細胞”),而今年(截止2024年到2月26日),CDE已受理了6款干細胞療法的IND申請。以臍帶來源的MSC間充質(zhì)干細胞產(chǎn)品為主,覆蓋癌癥、血液病、免疫系統(tǒng)疾病、心血管疾病、骨和軟骨病、神經(jīng)病學(xué)和中樞神經(jīng)系統(tǒng)疾病、皮膚病、糖尿病等多個領(lǐng)域。

而縱觀國內(nèi)干細胞藥物注冊的蓬勃發(fā)展,也可以看到得益于政府出臺的積極政策,監(jiān)管路徑日益清晰。尤其自2015年至今,從國家到各省、市地方政府都相繼出臺了一系列支持干細胞技術(shù)研發(fā)與轉(zhuǎn)化的政策及技術(shù)指導(dǎo)文件。2023年10月,我國首個人源干細胞國標(biāo)在第四屆中國干細胞與再生醫(yī)學(xué)協(xié)同創(chuàng)新平臺大會上公布《生物樣本庫多能干細胞管理技術(shù)規(guī)范》(標(biāo)準(zhǔn)編號:GB/T42466-2023)使得我國干細胞研究和應(yīng)用的規(guī)范化、標(biāo)準(zhǔn)化再上一個臺階,涵蓋采集和接收、復(fù)蘇和培養(yǎng)、冷凍與儲存、質(zhì)量控制等多個方面。
隨著近年新技術(shù)的不斷突破與國家政策、監(jiān)管制度日趨完善,我國干細胞療法相較過去幾十年中已經(jīng)取得了巨大進步。但與此同時,由于干細胞相關(guān)產(chǎn)品在細胞來源、類型、制備工藝等方面差異較大,其治療機制和體內(nèi)活性等相較傳統(tǒng)藥物更加復(fù)雜,所以干細胞在成藥上也仍然面臨一些挑戰(zhàn),包括干細胞的安全性、誘導(dǎo)效率、臨床轉(zhuǎn)化工藝探索、研發(fā)成本高等,都在一定程度上限制了干細胞治療的發(fā)展。在干細胞新技術(shù)的迭代,未來必將沖破這些局限性,成為解決眾多臨床未盡之需的重要主力軍。
參考資料:
1.https://www.biospace.com2.https://tandem.confex.com/tandem/2024/meetingapp.cgi/Paper/229513.https://tandem.confex.com/tandem/2024/meetingapp.cgi/Paper/234194.各企業(yè)官網(wǎng)
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構(gòu)成任何臨床診斷建議!杭吉干細胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請及時跟本公眾號聯(lián)系,我們將在第一時間處理。



 掃碼添加官方微信
掃碼添加官方微信