人腦的自我修復(fù)能力非常有限,這給缺血性中風(fēng)等損傷后的恢復(fù)帶來(lái)了巨大的挑戰(zhàn)。基于干細(xì)胞的療法已成為增強(qiáng)中風(fēng)后恢復(fù)的有希望的策略。基于大量臨床前證據(jù),目前正在進(jìn)行臨床試驗(yàn),以證明干細(xì)胞療法對(duì)中風(fēng)患者的有效性。然而,干細(xì)胞移植促進(jìn)神經(jīng)修復(fù)的機(jī)制仍未完全了解。關(guān)鍵問(wèn)題包括:這些效應(yīng)主要由以下機(jī)制驅(qū)動(dòng):(1) 刺激內(nèi)源性修復(fù)過(guò)程的營(yíng)養(yǎng)因子分泌,(2) 直接神經(jīng)細(xì)胞替換,還是 (3) 兩種機(jī)制的結(jié)合。
從癱瘓到復(fù)健!神經(jīng)干細(xì)胞移植技術(shù)5大機(jī)制如何促進(jìn)中風(fēng)后的大腦修復(fù)?
鑒于此,近日,瑞士蘇黎世大學(xué)神經(jīng)科學(xué)中心在“Stem Cell Reports”發(fā)表了一篇“How neural stem cell therapy promotes brain repair after stroke”(神經(jīng)干細(xì)胞療法如何促進(jìn)中風(fēng)后的大腦修復(fù))的文獻(xiàn)[1]。

該綜述探討了神經(jīng)干細(xì)胞移植治療中風(fēng)的最新進(jìn)展,重點(diǎn)介紹了腦修復(fù)機(jī)制的研究見解。揭示干細(xì)胞介導(dǎo)的腦再生的根本機(jī)制,有可能改進(jìn)治療策略并推進(jìn)一系列神經(jīng)系統(tǒng)疾病的治療。
從高效再生到有限修復(fù):機(jī)體器官修復(fù)能力的異質(zhì)性及其對(duì)中樞神經(jīng)系統(tǒng)疾病治療的啟示
受損器官的修復(fù)和再生是任何生物賴以生存的基本原則。 一般來(lái)說(shuō),這是通過(guò)兩個(gè)相互依存的過(guò)程來(lái)實(shí)現(xiàn)的:
(1)死亡的組織必須由新生成的細(xì)胞取代,然后(2)新細(xì)胞必須分化并以復(fù)雜的模式組織起來(lái),以恢復(fù)受損器官的原有結(jié)構(gòu)和功能。在人體中,不同器官的修復(fù)特性可能有很大差異。一些組織,如皮膚和肝臟,具有很強(qiáng)的內(nèi)源性細(xì)胞替代和模式修復(fù)能力。相比之下,包括中樞神經(jīng)系統(tǒng)(CNS)在內(nèi)的其他組織只顯示出較低的再生潛力。這對(duì)患有腦部疾病和腦損傷的病人來(lái)說(shuō)尤其棘手。
缺血性卒中的流行病學(xué)與急性病理進(jìn)程:嚴(yán)重腦損傷最常見的原因是缺血性卒中,全球每年影響超過(guò)1370萬(wàn)人,且25歲以上人群中每四人就有一人會(huì)在其一生中經(jīng)歷一次卒中。
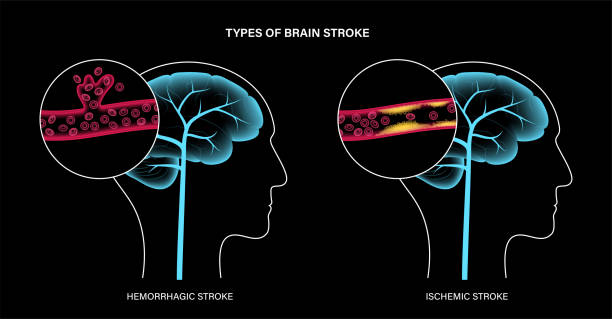
其發(fā)病核心機(jī)制為腦供血?jiǎng)用}被血栓或斑塊阻塞,導(dǎo)致局部缺血缺氧。若未能及時(shí)通過(guò)溶栓或取栓恢復(fù)血流,每小時(shí)將損失相當(dāng)于3.6年自然衰老的神經(jīng)元,且梗死核心區(qū)細(xì)胞在數(shù)小時(shí)內(nèi)不可逆死亡。這一病理級(jí)聯(lián)反應(yīng)凸顯急性期再灌注治療的緊迫性。
炎癥介導(dǎo)的繼發(fā)損傷與內(nèi)源性修復(fù)的動(dòng)態(tài)平衡:梗死周邊“半暗帶”作為功能可逆區(qū)域,在卒中后迅速啟動(dòng)小膠質(zhì)細(xì)胞激活及外周免疫細(xì)胞浸潤(rùn),釋放促炎因子并破壞細(xì)胞外基質(zhì),加劇繼發(fā)性損傷。星形膠質(zhì)細(xì)胞于數(shù)天后活化,形成膠質(zhì)瘢痕的同時(shí)分泌神經(jīng)修復(fù)信號(hào),揭示炎癥反應(yīng)的雙刃劍特性。盡管慢性期(數(shù)周至3年)伴隨血管新生、軸突重塑等內(nèi)源性修復(fù),但功能恢復(fù)高峰集中于卒中后3個(gè)月內(nèi),強(qiáng)調(diào)早期干預(yù)與時(shí)間窗管理的臨床重要性。
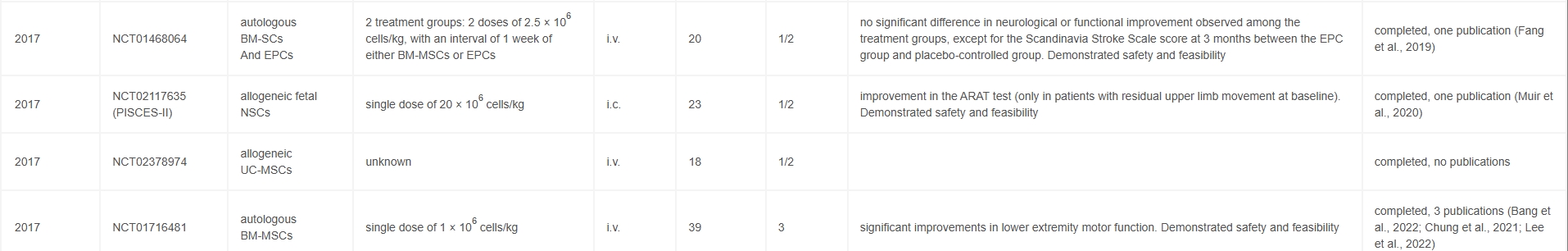
現(xiàn)臨床治療現(xiàn)狀與挑戰(zhàn):目前,急性缺血性卒中患者的唯一治療選擇是通過(guò)再灌注治療恢復(fù)血流(圖1)。唯一獲批的治療藥物是重組人組織型纖溶酶原激活劑阿替普酶。盡管大量隨機(jī)對(duì)照試驗(yàn)和25年以上的臨床應(yīng)用表明,靜脈注射阿替普酶可降低急性缺血性卒中患者的致殘率,但由于再灌注治療僅在神經(jīng)組織尚未完全喪失的急性期有效,其相對(duì)短暫的治療時(shí)間窗限制了該藥物的廣泛應(yīng)用。
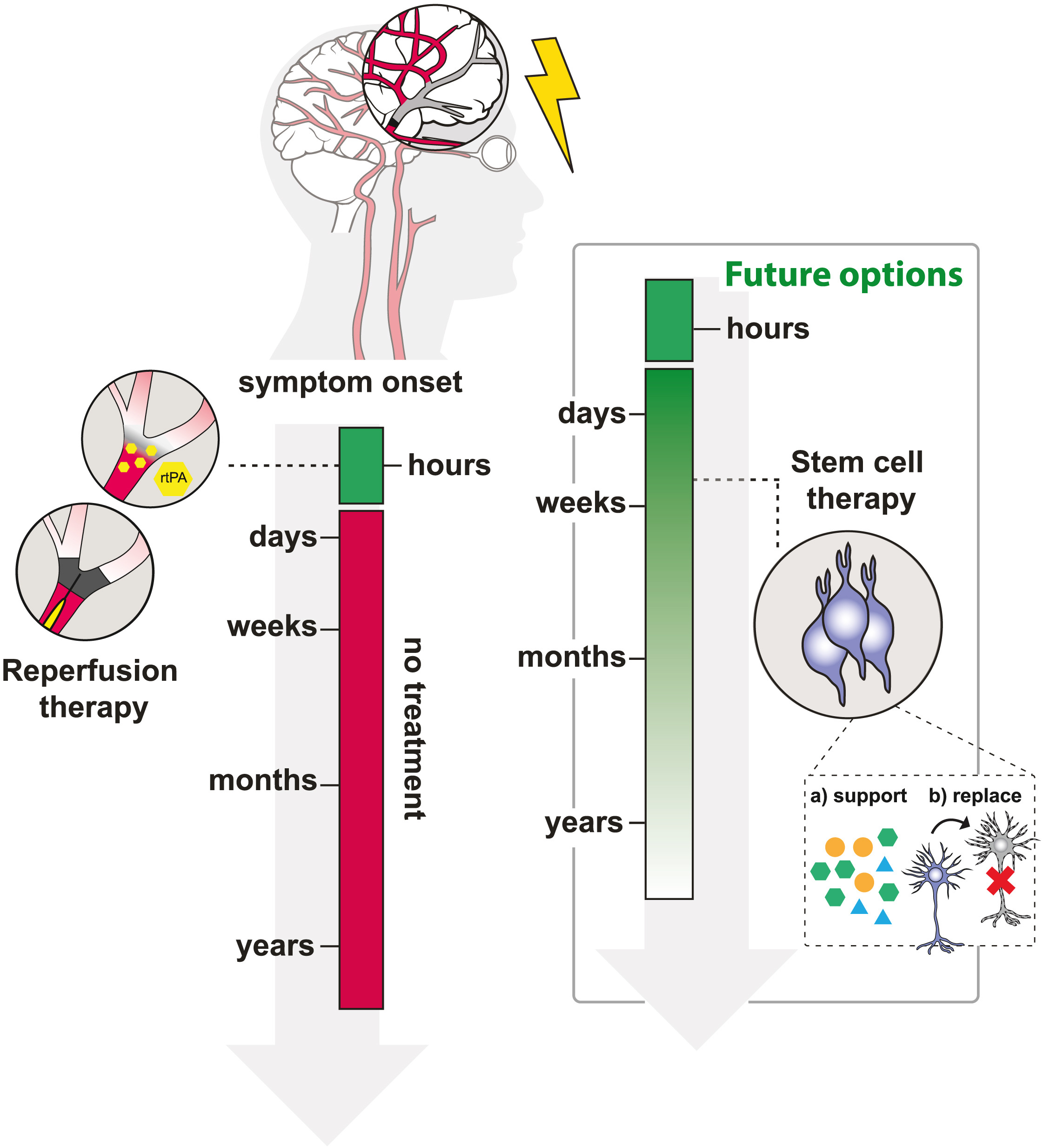
左圖:目前,中風(fēng)治療僅限于再灌注療法,即通過(guò)機(jī)械或酶促(rtPA)技術(shù)去除血凝塊。然而,這種方法僅在癥狀出現(xiàn)后的一段較短時(shí)間內(nèi)有效。右圖:細(xì)胞療法或?qū)槲磥?lái)提供一種有希望的選擇,它有可能延長(zhǎng)治療時(shí)間窗,并改善超出再灌注治療時(shí)間范圍的患者預(yù)后。
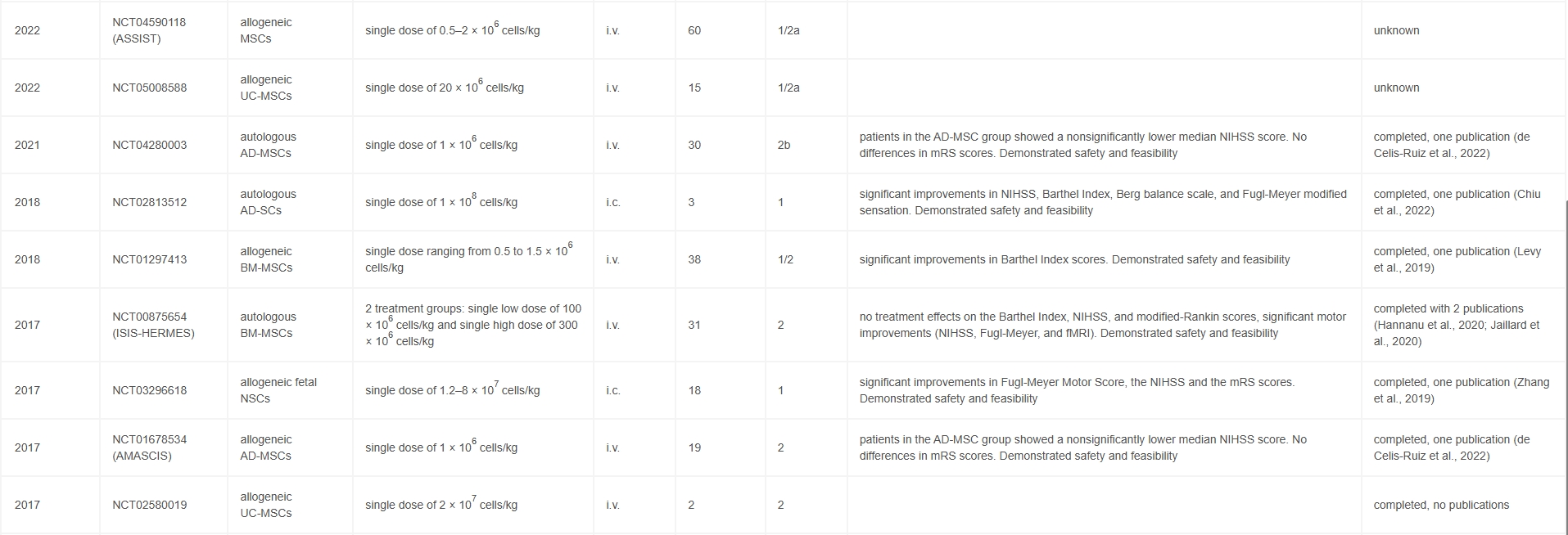
干細(xì)胞療法正在成為一種有前途的新型中風(fēng)治療模式,這也得到了中風(fēng)治療學(xué)術(shù)產(chǎn)業(yè)圓桌會(huì)議的認(rèn)可。值得注意的是,中風(fēng)的細(xì)胞療法已經(jīng)達(dá)到轉(zhuǎn)化階段,共有30項(xiàng)(正在進(jìn)行或已完成)臨床試驗(yàn)和人體治療結(jié)果。細(xì)胞療法治療中風(fēng)的安全性已得到證實(shí),進(jìn)一步證實(shí)了這種方法的潛力。然而,這些療法的療效仍需在人體上得到證實(shí),并且需要開展更多工作來(lái)優(yōu)化干細(xì)胞在臨床實(shí)踐中的應(yīng)用。
本綜述匯集了各種臨床前研究的證據(jù),重點(diǎn)關(guān)注干細(xì)胞,特別是神經(jīng)干細(xì)胞和祖細(xì)胞(NSC和NPC),如何促進(jìn)中風(fēng)后的大腦修復(fù),并研究驅(qū)動(dòng)基于干細(xì)胞的大腦再生的機(jī)制。
目前間充質(zhì)干細(xì)胞治療腦卒中的臨床現(xiàn)狀
既往隨機(jī)臨床試驗(yàn)主要集中于自體間充質(zhì)干細(xì)胞(MSCs)的應(yīng)用,因其具有強(qiáng)大的自我更新能力且易于從多種組織獲取(MSCs天然存在于所有間充質(zhì)組織中,包括骨髓、脂肪組織、臍帶和牙髓等)。
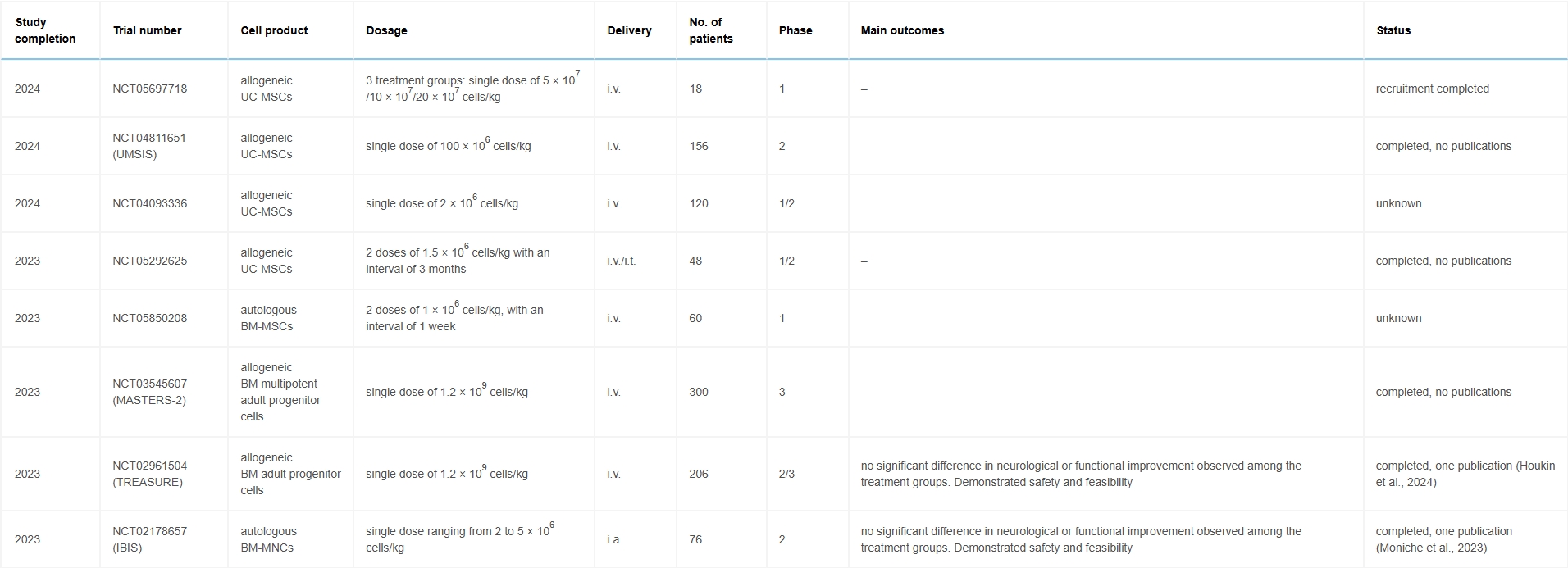
多項(xiàng)Ⅰ期和Ⅱ期臨床試驗(yàn)探索了不同來(lái)源的MSCs(表1),結(jié)果一致表明其安全性良好且耐受性優(yōu)異。
代表性研究包括:
2017年期間,柳葉刀神經(jīng)病學(xué)期刊上發(fā)表了一篇“多能成體祖細(xì)胞治療急性缺血性卒中(MASTERS)的安全性和有效性:一項(xiàng)隨機(jī)、雙盲、安慰劑對(duì)照的2期試驗(yàn)”的文章。

最后結(jié)果表明:對(duì)于急性缺血性卒中患者,多能成體祖細(xì)胞治療安全且耐受性良好。盡管多能成體祖細(xì)胞治療在90天時(shí)未觀察到神經(jīng)系統(tǒng)結(jié)果的顯著改善,但仍計(jì)劃開展進(jìn)一步的臨床試驗(yàn),以評(píng)估該療法在卒中后更早時(shí)間窗(<36小時(shí))的療效。
2022年期間,一項(xiàng)評(píng)估同種異體脂肪組織來(lái)源的間充質(zhì)干細(xì)胞治療急性缺血性卒中 (AMASCIS) 的最終結(jié)果:一項(xiàng)II期、隨機(jī)、雙盲、安慰劑對(duì)照、單中心、試點(diǎn)臨床試驗(yàn)發(fā)表在“Cell Transplantation”期刊雜志上。
結(jié)果表明:綜上所述,AMASCIS IIa期先導(dǎo)臨床試驗(yàn)結(jié)果提示,在缺血性卒中發(fā)作后的前2周內(nèi)靜脈注射AD-MSCs,在24個(gè)月的隨訪中是安全的。盡管各治療組間的療效終點(diǎn)均未達(dá)到統(tǒng)計(jì)學(xué)顯著水平,但與安慰劑組相比,AD-MSC治療組的NIHSS評(píng)分呈現(xiàn)改善趨勢(shì)。
2024年期間,評(píng)估自體間充質(zhì)基質(zhì)細(xì)胞腦內(nèi)移植安全性與耐受性的Ⅰ/Ⅱ期開放標(biāo)簽研究RAINBOW。盡管這些研究顯示出良好的安全性,但療效信號(hào)仍不一致。
迄今為止,僅在2024年期間開展過(guò)一項(xiàng)Ⅱ/Ⅲ期試驗(yàn)——TREASURE研究,該研究評(píng)估了靜脈注射骨髓源性多潛能成體祖細(xì)胞對(duì)缺血性卒中患者的療效。

雖然TREASURE證實(shí)了該療法的安全性及耐受性,但未觀察到臨床結(jié)局的顯著改善,使得MSCs及其他成體干細(xì)胞/祖細(xì)胞在缺血性卒中中的治療潛力尚未得到驗(yàn)證。
近年來(lái),神經(jīng)干細(xì)胞(NSC)作為一種多模式中風(fēng)治療方案,引起了越來(lái)越多的關(guān)注。除了產(chǎn)生神經(jīng)保護(hù)和再生生長(zhǎng)因子外,NSC還具有獨(dú)特的分化能力,能夠分化成多種神經(jīng)細(xì)胞類型,有可能替代在缺血事件中丟失或受損的細(xì)胞。這種雙重能力使NSC成為應(yīng)對(duì)中風(fēng)康復(fù)多方面挑戰(zhàn)的有希望的候選者。
什么是神經(jīng)干細(xì)胞/祖細(xì)胞
神經(jīng)干細(xì)胞/祖細(xì)胞(NSCs/NPCs)的特性與功能:神經(jīng)干細(xì)胞(NSCs)憑借其定向分化為神經(jīng)元、星形膠質(zhì)細(xì)胞及少突膠質(zhì)細(xì)胞的能力,成為神經(jīng)修復(fù)領(lǐng)域的重要候選。其核心特性包括持續(xù)的自我更新能力,以及通過(guò)放射狀膠質(zhì)祖細(xì)胞介導(dǎo)的中樞神經(jīng)系統(tǒng)發(fā)育期細(xì)胞生成(如神經(jīng)元與膠質(zhì)細(xì)胞)。
神經(jīng)祖細(xì)胞(NPCs)作為NSCs的衍生群體,雖保留多系分化潛能,但譜系限制性更高且自我更新能力顯著降低,需通過(guò)形態(tài)特征、基因表達(dá)譜及時(shí)空分布進(jìn)行鑒定。兩者均嚴(yán)格限定于神經(jīng)譜系分化,避免非神經(jīng)細(xì)胞生成,為精準(zhǔn)修復(fù)提供基礎(chǔ)。
來(lái)源挑戰(zhàn)與臨床轉(zhuǎn)化策略:NSCs在成體中樞神經(jīng)系統(tǒng)中僅存于特定神經(jīng)源性微環(huán)境(如海馬齒狀回顆粒下層、側(cè)腦室腦室下區(qū)),但因倫理和樣本可及性限制(依賴胚胎或尸檢組織),原代NSCs應(yīng)用受限。
當(dāng)前研究聚焦于通過(guò)胚胎干細(xì)胞(ESCs)或誘導(dǎo)多能干細(xì)胞(iPSCs)定向分化為外源性NSCs/NPCs,其分化方案因培養(yǎng)條件與目標(biāo)應(yīng)用而異。為確保臨床安全性,需構(gòu)建均質(zhì)、穩(wěn)定且低致瘤性的細(xì)胞群,同時(shí)優(yōu)化擴(kuò)增與分化流程,以滿足再生醫(yī)學(xué)對(duì)細(xì)胞治療產(chǎn)品的嚴(yán)格標(biāo)準(zhǔn)。
神經(jīng)干細(xì)胞移植治療缺血性中風(fēng)的臨床試驗(yàn)進(jìn)展
在缺血性中風(fēng)中探索神經(jīng)干細(xì)胞(NSCs)的最早大規(guī)模臨床試驗(yàn)之一。
2020年,神經(jīng)神經(jīng)外科精神病學(xué)雜志刊發(fā)了一篇“人類神經(jīng)干細(xì)胞腦內(nèi)植入與中風(fēng)后運(yùn)動(dòng)恢復(fù):多中心前瞻性單臂研究(PISCES-2)”。這項(xiàng)研究提供了關(guān)于立體定向腦內(nèi)注射人類神經(jīng)干細(xì)胞(hNSCs)的可行性和耐受性的初步數(shù)據(jù)。

該試驗(yàn)已完成1期(NCT01151124)和2期(NCT03629275),證明hNSCs可安全地遞送至腦內(nèi)。值得注意的是,部分殘留上肢運(yùn)動(dòng)功能的患者顯示出功能改善,盡管這些改善的程度因個(gè)體而異。
在迄今為止探索的細(xì)胞類型中,神經(jīng)干細(xì)胞(NSCs)和神經(jīng)前體細(xì)胞(NPCs)在中風(fēng)治療中最具潛力。在臨床前中風(fēng)模型中,關(guān)于NSC/NPC介導(dǎo)的組織修復(fù)機(jī)制(包括神經(jīng)保護(hù)、神經(jīng)發(fā)生和炎癥調(diào)節(jié))的研究已取得顯著進(jìn)展。然而,許多問(wèn)題仍未解決,尤其是在遞送方法的優(yōu)化、細(xì)胞存活以及功能整合方面。
人類神經(jīng)干細(xì)胞及前體細(xì)胞的腦修復(fù)機(jī)制 ?
當(dāng)前學(xué)界持續(xù)爭(zhēng)論的核心問(wèn)題是:人類神經(jīng)前體細(xì)胞(NPCs)/神經(jīng)干細(xì)胞(NSCs)主要通過(guò)旁分泌信號(hào)(”旁觀者效應(yīng)”)、直接細(xì)胞替代作用,還是兩者協(xié)同發(fā)揮其治療效益(圖2)。
臨床前研究已證實(shí),NSCs/NPCs分泌的保護(hù)性因子有助于卒中后腦再生。然而,前沿研究手段揭示了移植細(xì)胞在卒中動(dòng)物模型中如何主動(dòng)參與神經(jīng)回路重建的新機(jī)制。總體而言,旁分泌信號(hào)與直接細(xì)胞替代的相對(duì)貢獻(xiàn)可能隨卒中后時(shí)間推移而動(dòng)態(tài)變化。
在急性期至亞急性期(數(shù)日至數(shù)周),移植細(xì)胞主要發(fā)揮旁分泌效應(yīng),通過(guò)調(diào)節(jié)炎癥反應(yīng)、保護(hù)易損組織、修復(fù)血管系統(tǒng)及促進(jìn)內(nèi)源性修復(fù)過(guò)程實(shí)現(xiàn)治療作用。隨著組織微環(huán)境趨于穩(wěn)定及炎癥消退,其作用機(jī)制可能逐漸轉(zhuǎn)向直接細(xì)胞替代。
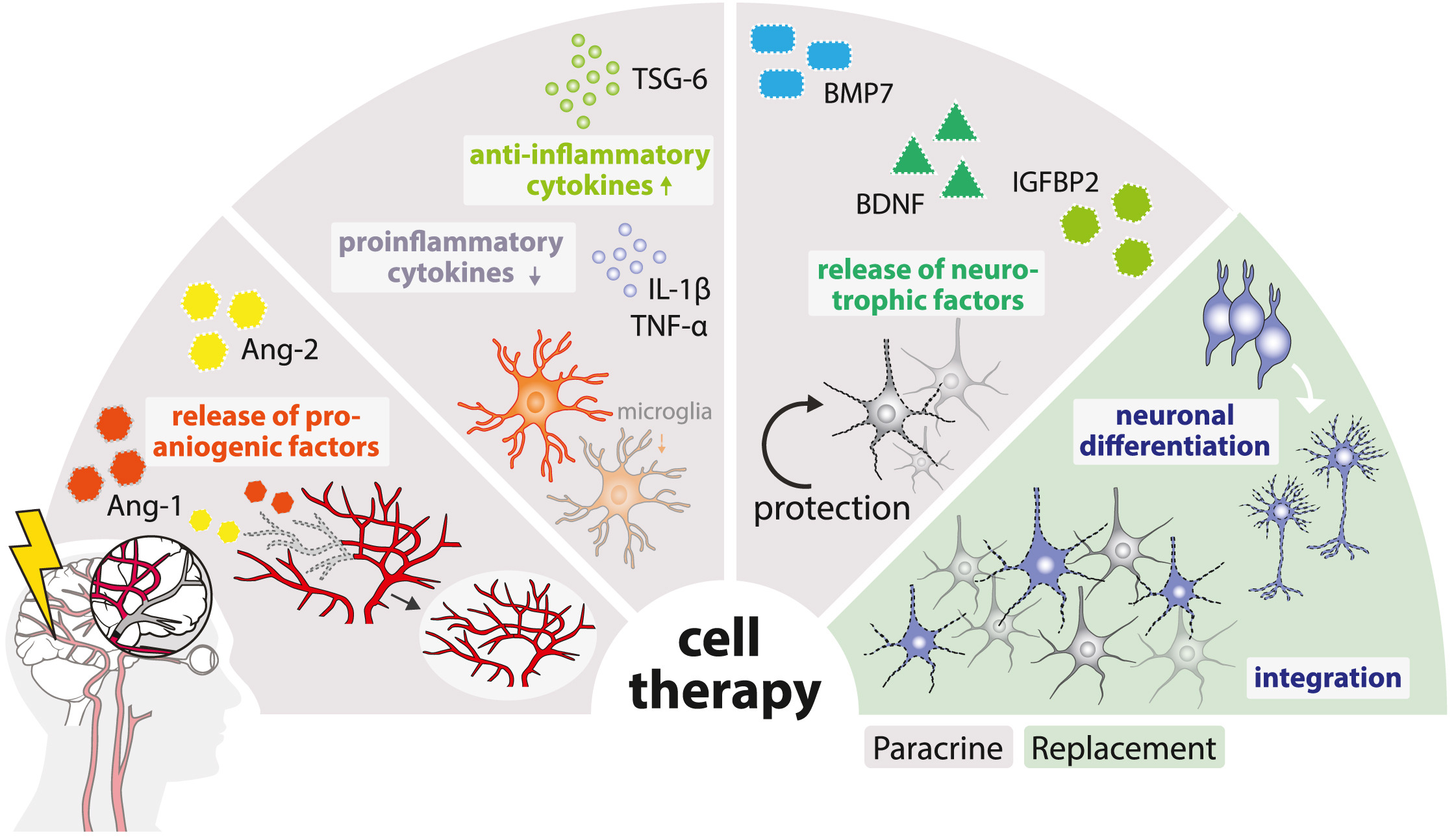
(1)干細(xì)胞可釋放營(yíng)養(yǎng)因子(例如 BMP6 或 BDNF)以防止神經(jīng)元細(xì)胞死亡,
(2)干細(xì)胞可通過(guò)釋放抗炎細(xì)胞因子(例如 TSG-6)和抑制促炎細(xì)胞因子(例如 IL-1β 或 TNF-α)來(lái)抑制炎癥反應(yīng),
(3)干細(xì)胞可通過(guò)釋放促血管生成因子和上調(diào) Ang-1/-2 等來(lái)促進(jìn)血管生成,
(4)干細(xì)胞可分化為神經(jīng)元以替代受損細(xì)胞并支持神經(jīng)回路重建
在后續(xù)章節(jié)中,我們將詳細(xì)探討這些機(jī)制如何在卒中恢復(fù)的各個(gè)階段逐步展開。
01、旁分泌作用
支持“旁觀者”假說(shuō)的臨床前觀察結(jié)果是,在移植細(xì)胞完全分化為特定神經(jīng)細(xì)胞之前就可以檢測(cè)到功能改善,這表明早期治療益處可能來(lái)自移植的NSC/NPC分泌的因子,而不是它們整合到受損組織中。
事實(shí)上,在各種缺血性中風(fēng)動(dòng)物模型中的研究已經(jīng)反復(fù)證實(shí)旁觀者效應(yīng)是干細(xì)胞治療的基本機(jī)制。這些旁分泌機(jī)制涉及釋放生物活性分子,如生長(zhǎng)因子、細(xì)胞因子和細(xì)胞外囊泡,它們調(diào)節(jié)炎癥、促進(jìn)神經(jīng)保護(hù)、增強(qiáng)血管生成并刺激受損大腦中的內(nèi)源性修復(fù)過(guò)程。
02、促進(jìn)血管生成與恢復(fù)血管完整性
血管生成在缺血性卒中后的神經(jīng)再生與功能恢復(fù)中起關(guān)鍵作用。腦微血管系統(tǒng)的血管新生可促進(jìn)損傷腦區(qū)的血流與營(yíng)養(yǎng)供應(yīng),而血管內(nèi)皮生長(zhǎng)因子(VEGF)、成纖維細(xì)胞生長(zhǎng)因子2(FGF2)等調(diào)控因子主導(dǎo)缺血后的血管生成及成熟過(guò)程。動(dòng)物實(shí)驗(yàn)表明,局部移植神經(jīng)或非神經(jīng)來(lái)源的細(xì)胞可恢復(fù)血管完整性并改善血腦屏障功能。
神經(jīng)干細(xì)胞/前體細(xì)胞(NSC/NPC)移植能顯著增強(qiáng)星形膠質(zhì)細(xì)胞終足及血管壁的VEGF免疫反應(yīng)性,并促進(jìn)缺血組織周圍增殖性血管的生長(zhǎng)。其他促血管生成因子(如血管生成素Ang-1和Ang-2)亦可由干細(xì)胞釋放,介導(dǎo)血管新生。此外,NSC分泌的小細(xì)胞外囊泡能促進(jìn)小鼠大腦中動(dòng)脈閉塞后的腦血管生成及神經(jīng)功能恢復(fù),但其機(jī)制尚待闡明。
血管生成與神經(jīng)功能恢復(fù)的關(guān)聯(lián):盡管血管生成增強(qiáng)與卒中后神經(jīng)功能改善密切相關(guān),但需同步恢復(fù)神經(jīng)血管單元及血腦屏障的完整性方能實(shí)現(xiàn)療效。
臨床前研究表明,NPC移植可通過(guò)穩(wěn)定血腦屏障發(fā)揮急性期神經(jīng)保護(hù)作用:移植的NPC能降低卒中動(dòng)物模型中升高的基質(zhì)金屬蛋白酶(MMP)-9水平,并防止緊密連接蛋白ZO-1降解。針對(duì)NPC源性細(xì)胞外囊泡的研究進(jìn)一步揭示,其可通過(guò)抑制核因子κB(NF-κB)通路減少ABCB1及MMP-9活化,從而避免基底膜破壞。
這些機(jī)制共同支持血管系統(tǒng)的修復(fù),為神經(jīng)再生提供結(jié)構(gòu)及功能基礎(chǔ)。
03、炎癥反應(yīng)的調(diào)控機(jī)制
腦缺血后,促炎信號(hào)迅速激活常駐免疫細(xì)胞,加速中性粒細(xì)胞、單核/巨噬細(xì)胞及T細(xì)胞亞型等炎癥細(xì)胞向損傷區(qū)浸潤(rùn),加劇腦損傷。研究表明,干細(xì)胞可通過(guò)間接方式調(diào)節(jié)缺血后的炎癥反應(yīng)及免疫應(yīng)答。在MCAO模型中,NPC移植動(dòng)物缺血區(qū)ED1+活化巨噬細(xì)胞的浸潤(rùn)可持續(xù)至術(shù)后8周,但伴隨握力與偏癱前肢功能的顯著改善。進(jìn)一步研究發(fā)現(xiàn),與未治療組相比,NPC腦內(nèi)移植可減少缺血區(qū)活化小膠質(zhì)細(xì)胞數(shù)量,并下調(diào)促炎細(xì)胞因子(TNF-α、IL-6、IL-1β)及免疫細(xì)胞趨化因子(MCP-1、MIP-1α)表達(dá)。
干細(xì)胞外泌體的抗炎作用:神經(jīng)干細(xì)胞(NSC)源性細(xì)胞外囊泡(EVs)可調(diào)控小膠質(zhì)細(xì)胞活化及表型極化。靜脈注射后,EVs選擇性富集于缺血腦區(qū),抑制小膠質(zhì)細(xì)胞促炎反應(yīng),降低TNF-α、IL-1β等炎性因子生成。聯(lián)合NSC與EVs治療可進(jìn)一步增加抗炎因子IL-10表達(dá),協(xié)同減輕小鼠卒中后神經(jīng)炎癥。這些發(fā)現(xiàn)提示,EVs可能通過(guò)遞送生物活性分子實(shí)現(xiàn)跨細(xì)胞調(diào)控。
系統(tǒng)注射干細(xì)胞的免疫調(diào)節(jié)假說(shuō):近期提出的“生物反應(yīng)器假說(shuō)”認(rèn)為,靜脈輸注的干細(xì)胞通過(guò)外周免疫調(diào)控而非直接入腦發(fā)揮作用。動(dòng)物模型顯示,NPCs可滯留于淋巴結(jié)或脾臟,抑制促炎T細(xì)胞活化并促進(jìn)調(diào)節(jié)性T細(xì)胞擴(kuò)增,從而限制免疫細(xì)胞穿越血腦屏障。此類外周免疫重編程可能阻斷小膠質(zhì)細(xì)胞過(guò)度活化及繼發(fā)性組織損傷。
星形膠質(zhì)細(xì)胞的雙重角色與NPCs的調(diào)控:星形膠質(zhì)細(xì)胞活化是神經(jīng)炎癥的重要特征;急性期膠質(zhì)增生利于修復(fù),但慢性期形成的瘢痕組織阻礙神經(jīng)再生。
研究發(fā)現(xiàn),移植至CNS損傷區(qū)的NPCs可分化出類似宿主反應(yīng)性星形膠質(zhì)細(xì)胞的表型,通過(guò)轉(zhuǎn)錄調(diào)控抑制局部炎癥。缺血核心區(qū)的炎性/纖維化信號(hào)與周圍神經(jīng)微環(huán)境共同調(diào)節(jié)移植NPCs的分化方向,使其在抑制纖維化的同時(shí)保護(hù)健康神經(jīng)元。這種動(dòng)態(tài)調(diào)控機(jī)制為優(yōu)化細(xì)胞治療策略提供了新思路。
04、神經(jīng)保護(hù)機(jī)制的多維作用
干細(xì)胞通過(guò)上調(diào)促生存因子(如BDNF、NGF)激活內(nèi)源性神經(jīng)發(fā)生與突觸重塑,在卒中模型中展現(xiàn)顯著神經(jīng)保護(hù)效應(yīng)。光化學(xué)遺傳技術(shù)激活小鼠神經(jīng)前體細(xì)胞(NPCs)可誘導(dǎo)促再生基因表達(dá)增強(qiáng),而NPC移植治療能改善年輕及老齡動(dòng)物的皮層卒中后運(yùn)動(dòng)功能。BDNF作為活動(dòng)依賴性神經(jīng)營(yíng)養(yǎng)因子,通過(guò)促進(jìn)軸突發(fā)芽和延伸加速神經(jīng)環(huán)路重建,其動(dòng)態(tài)釋放機(jī)制與功能恢復(fù)密切相關(guān)。
關(guān)鍵營(yíng)養(yǎng)因子的協(xié)同作用:誘導(dǎo)多能干細(xì)胞來(lái)源的NPCs(iPSC-NPCs)與缺血微環(huán)境交互作用時(shí),分泌IGFBP2、BMP7等關(guān)鍵因子,協(xié)同調(diào)控神經(jīng)保護(hù)與再生。IGFBP2在卒中后海馬區(qū)特異性上調(diào),可能參與維持神經(jīng)干細(xì)胞活性;BMP7則驅(qū)動(dòng)運(yùn)動(dòng)功能恢復(fù)。最新研究發(fā)現(xiàn),缺血小鼠梗死核心區(qū)IGFBP5水平升高,該蛋白可能通過(guò)調(diào)控修復(fù)性血管生成發(fā)揮作用。
內(nèi)源性神經(jīng)發(fā)生的激活:在大鼠大腦中動(dòng)脈閉塞(MCAO)模型中,NPC移植組同側(cè)腦區(qū)BrdU(溴脫氧尿苷)-DCX(雙皮質(zhì)素)雙陽(yáng)性細(xì)胞數(shù)量顯著增加,且與移植細(xì)胞無(wú)直接關(guān)聯(lián),提示NPCs可能通過(guò)激活腦室下區(qū)內(nèi)源性神經(jīng)干細(xì)胞增殖并遷移至梗死區(qū)。
這些發(fā)現(xiàn)證實(shí)干細(xì)胞可通過(guò)旁分泌信號(hào)激活宿主自身修復(fù)潛能。內(nèi)源性神經(jīng)發(fā)生在中風(fēng)恢復(fù)中的作用已被廣泛討論;然而,這些新形成的神經(jīng)元是否與功能恢復(fù)相關(guān)仍有待闡明。
05、細(xì)胞替代的機(jī)制
細(xì)胞替代通過(guò)移植神經(jīng)干細(xì)胞(NSCs)或神經(jīng)祖細(xì)胞(NPCs)分化為成熟神經(jīng)元,重建受損的神經(jīng)回路。例如,移植的NSCs在小鼠中風(fēng)模型中分化為GABA能神經(jīng)元,通過(guò)神經(jīng)連接蛋白、神經(jīng)調(diào)節(jié)蛋白等信號(hào)通路與宿主組織整合,形成功能性突觸連接,促進(jìn)長(zhǎng)期功能恢復(fù)。
然而,早期行為改善(如移植后1周)并非依賴神經(jīng)元直接替代,而是源于旁分泌效應(yīng)或宿主休眠回路的重激活,如神經(jīng)營(yíng)養(yǎng)因子釋放、突觸可塑性增強(qiáng)等。這表明,細(xì)胞替代的長(zhǎng)期效果需依賴移植細(xì)胞的結(jié)構(gòu)整合,而短期恢復(fù)更多涉及微環(huán)境調(diào)節(jié)機(jī)制。
結(jié)論和未來(lái)方向
中樞神經(jīng)系統(tǒng)(CNS)的再生潛力有限,這對(duì)缺血性中風(fēng)患者構(gòu)成了重大挑戰(zhàn)。盡管潛力巨大,但中風(fēng)細(xì)胞療法在臨床試驗(yàn)中卻未能證實(shí)療效。然而,專注于神經(jīng)干細(xì)胞(NSCs)類型(例如NPCs和NSCs),而非間充質(zhì)干細(xì)胞或其他成體干細(xì)胞,或許更有前景。
我們進(jìn)一步相信,了解基于干細(xì)胞的腦修復(fù)的精確機(jī)制,可以帶來(lái)更好的細(xì)胞治療產(chǎn)品和更高的轉(zhuǎn)化成功率,因?yàn)榭梢葬槍?duì)特定疾病確定一些重要參數(shù),例如最佳細(xì)胞類型、理想的應(yīng)用途徑或移植時(shí)機(jī)。因此,這些參數(shù)的差異必然會(huì)導(dǎo)致近期臨床試驗(yàn)結(jié)果的不一致。
多年來(lái),大量涉及將不同類型的細(xì)胞移植到各種缺血模型中的研究,揭示了腦修復(fù)的機(jī)制見解。雖然一些研究主要關(guān)注旁觀者效應(yīng),但近期使用鼻咽癌(NPC)和神經(jīng)干細(xì)胞(NSC)移植的研究表明,宿主和移植組織之間會(huì)形成特定的突觸連接并進(jìn)行信息交換。然而,這種功能整合是否真的有助于腦再生,仍需進(jìn)一步證實(shí)。
我們認(rèn)為,進(jìn)一步研究尚未確定的基于細(xì)胞的腦再生機(jī)制,將有助于發(fā)現(xiàn)理想的治療干細(xì)胞類型,這在開展更大規(guī)模的臨床試驗(yàn)之前是必要的。
文章來(lái)源:
[1]https://www.cell.com/action/showCitFormats?doi=10.1016%2Fj.stemcr.2025.102507&pii=S2213-6711%2825%2900111-0
免責(zé)說(shuō)明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問(wèn),請(qǐng)隨時(shí)聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信