1型糖尿病是一種自身免疫性疾病,患者的胰島β細(xì)胞被自身免疫系統(tǒng)破壞,導(dǎo)致胰島素分泌不足。長(zhǎng)期以來(lái),1型糖尿病患者依賴外源性胰島素注射來(lái)控制血糖水平。然而,近年來(lái),干細(xì)胞治療為1型糖尿病的治療帶來(lái)了新的希望。2024年,干細(xì)胞治療1型糖尿病取得了顯著的進(jìn)展,本文將概述這些最新研究成果。
糖尿病是一種常見的代謝性疾病,主要表現(xiàn)為長(zhǎng)期血糖水平升高,分為1型、2型和妊娠糖尿病三種類型。其中,2型糖尿病是最常見的類型,約占糖尿病患者總數(shù)的90-95%,而1型糖尿病僅約占5-10%。
盡管1型糖尿病在糖尿病患者中的比例相對(duì)較小,但它通常發(fā)病于兒童和青少年時(shí)期,對(duì)患者的生活質(zhì)量和長(zhǎng)期健康影響尤為顯著。由于其發(fā)病機(jī)制特殊、治療難度大,一直是醫(yī)學(xué)研究的重點(diǎn)領(lǐng)域之一。

目前,傳統(tǒng)的治療方法主要依賴外源性胰島素注射來(lái)控制血糖,但存在諸多不足。包括血糖控制精度不夠、患者需終身依賴、可能引發(fā)多種并發(fā)癥和低血糖事件。胰島移植雖有進(jìn)展,但供體短缺使其難以廣泛應(yīng)用。
在這一背景下,科研人員將目光投入向干細(xì)胞,通過干細(xì)胞的自我更新并分化成多種不同類型的細(xì)胞的潛能,成為這一瓶頸的希望所在。以下是今年干細(xì)胞治療1型糖尿病的最新研究進(jìn)展盤點(diǎn)。
盤點(diǎn)2024年干細(xì)胞治療1型糖尿病的最新研究進(jìn)展
2024年2月21日,武漢科技大學(xué)天佑醫(yī)院內(nèi)分泌科在國(guó)際期刊雜志《細(xì)胞和組織儲(chǔ)存》發(fā)表了一篇關(guān)于《間充質(zhì)基質(zhì)細(xì)胞治療1型糖尿病的療效:系統(tǒng)評(píng)價(jià)》的文獻(xiàn)綜述。[1]

本次研究通過截至2023年7月,在PubMed、Web of Science、Embase和Cochrane Library數(shù)據(jù)庫(kù)中檢索了有關(guān)間充質(zhì)基質(zhì)細(xì)胞對(duì)T1D的影響的文章。通過引文手動(dòng)搜索其他相關(guān)研究。評(píng)估了HbA1c、FBG、PBG、胰島素需求和C肽。使用ROB 2.0和ROBINS-I工具評(píng)估偏倚風(fēng)險(xiǎn)。納入了6項(xiàng)隨機(jī)對(duì)照試驗(yàn)(RCT)和8項(xiàng)非隨機(jī)對(duì)照試驗(yàn)(nRCT)。
- 盡管研究存在異質(zhì)性,但14項(xiàng)研究中有10項(xiàng)表明,與對(duì)照組相比,至少一種血糖結(jié)果顯著降低或反應(yīng)改善。而其余四項(xiàng)研究未顯示顯著改善。
- 大多數(shù)研究表明,干細(xì)胞移植后FBG、PBG、HbA1c 和胰島素需求顯著下降,而C肽水平增加。
本系統(tǒng)評(píng)價(jià)代表了對(duì)干細(xì)胞是否有助于改善1型糖尿病患者的血糖控制的最新評(píng)估。本評(píng)價(jià)的優(yōu)勢(shì)在于其嚴(yán)謹(jǐn)?shù)姆椒ㄕ摚鞔_的資格標(biāo)準(zhǔn)和在綜合數(shù)據(jù)庫(kù)中的廣泛搜索。文獻(xiàn)檢索采用了全面的策略,涵蓋了與本評(píng)價(jià)目標(biāo)相關(guān)的所有相關(guān)方面。
2024年6月21日,福泰制藥(Vertex)在美國(guó)糖尿病協(xié)會(huì)第84屆科學(xué)會(huì)議上宣布了其用于治療1型糖尿病(T1D)的細(xì)胞療法VX-880的Ⅰ/Ⅱ期臨床試驗(yàn)取得積極結(jié)果。[2]

本次臨床數(shù)據(jù)的公布也讓全球5億糖尿病患者看到了擺脫胰島素的希望。
- 在A階段和B階段中,所有用VX-880治療的患者都有超過第90天的隨訪數(shù)據(jù),并證明了胰島細(xì)胞植入和葡萄糖響應(yīng)性胰島素產(chǎn)生;
- 所有患者的血糖控制指標(biāo)均有改善,包括HbA1c下降、血糖時(shí)間范圍內(nèi)上升、胰島素使用減少或消除;
- VX-880通常耐受性良好;
- C部分同時(shí)給藥正在進(jìn)行中。
在最新的VX-880 I/II期臨床試驗(yàn)A和B部分患者的長(zhǎng)期數(shù)據(jù)中,有三分之一的患者在接受Vertex候選藥物治療后達(dá)到了胰島素獨(dú)立。要知道,在VX-880治療之前,所有入組患者均患有長(zhǎng)期T1D,無(wú)內(nèi)源性胰島素分泌,平均每天需要34.0單位的胰島素,并且在治療前一年有反復(fù)嚴(yán)重低血糖事件(SHE)的病史篩選。
A部分和B部分的所有患者現(xiàn)已接受超過90天的隨訪,并在第90天的混合膳食耐受試驗(yàn) (MMTT) 中證明了胰島細(xì)胞植入和內(nèi)源性葡萄糖反應(yīng)性胰島素產(chǎn)生。所有患者的所有指標(biāo)均表現(xiàn)出血糖控制得到改善,包括HbA1c降低、連續(xù)胰島素監(jiān)測(cè)時(shí)間范圍改善以及減少或消除外源性胰島素的使用。

其中,兩名患者在VX-880輸注后隨訪12個(gè)月(至少)達(dá)到了研究終點(diǎn),即在90天至12個(gè)月期間消除了嚴(yán)重低血糖事件(SHE)。
- 第一位患者在治療270天后實(shí)現(xiàn)了胰島素獨(dú)立,并持續(xù)到隨訪的第24個(gè)月,該患者患有1型糖尿病(T1D)將近42年,每天接受34個(gè)單位的外源胰島素。
- 第二位患者在第180天開始不再使用胰島素,并持續(xù)了12個(gè)月的隨訪。該患者患 T1D長(zhǎng)達(dá)19年,每天接受45.1個(gè)單位的胰島素。該患者在第15個(gè)月時(shí)不得不重新開始胰島素治療,但每日劑量大大降低,僅為4個(gè)單位。
- 第三位患者在治療180天后就不再需要胰島素了。
迄今為止,所有服用VX-880的患者總體耐受性良好。大多數(shù)不良事件 (AE)為輕度或中度,沒有與VX-880治療相關(guān)的嚴(yán)重不良事件。
除了胰島素獨(dú)立性外,I/II期研究的新數(shù)據(jù)還顯示,VX-880在90天時(shí)誘導(dǎo)了研究A部分和B部分所有參與者的胰島細(xì)胞移植。而現(xiàn)在這些患者能夠產(chǎn)生內(nèi)源性葡萄糖反應(yīng)性胰島素,并在各種指標(biāo)(包括HbA1c和時(shí)間范圍)上表現(xiàn)出更好的血糖控制。
2024年7月30日,美國(guó)再生研究中心在國(guó)際期刊《國(guó)際分子科學(xué)雜志》上發(fā)表了一篇關(guān)于《接受干細(xì)胞教育者治療后1型糖尿病患者外周血胰島素產(chǎn)生細(xì)胞 (PB-IPC) 葡萄糖轉(zhuǎn)運(yùn)蛋白2 (GLUT2) 表達(dá)增加》的臨床研究成果。[3]

本次研究招募了近期發(fā)病的T1D受試者(n=9,年齡從11到38歲,3名女性和6名男性)并檢測(cè)他們的PB-IPC水平。
1.C肽水平升高,胰島素劑量減少
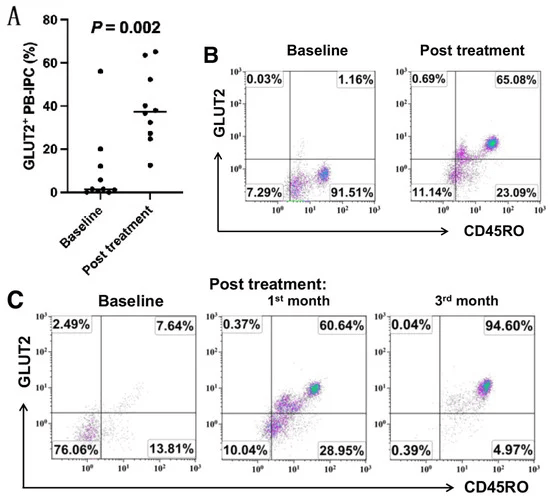
- 流式細(xì)胞術(shù)分析顯示,在接受干細(xì)胞教育療法治療一個(gè)月后,近期發(fā)病的T1D患者GLUT2 + CD45RO + PB-IPC的百分比顯著增加。(圖1A.B)
- 臨床數(shù)據(jù)顯示,接受干細(xì)胞教育者療法治療后的第一個(gè)月,T1D患者的C肽水平較基線水平顯著升高,血糖控制得到改善,糖化血紅蛋白 (HbA1C) 和總胰島素劑量減少。
- 流式細(xì)胞術(shù)顯示該糖尿病前期受試者的 GLUT2+PB-IPC百分比較低,為7.64%。接受干細(xì)胞教育者療法后,GLUT2+PB-IPC百分比在第一個(gè)月的隨訪中增加到60.64%,在第三個(gè)月的隨訪中增加到94.6% (圖1C)。
該受試者在隨訪期間保持正常的血糖控制,HbA1c為5.2%。這表明干細(xì)胞教育者療法可以預(yù)防1型糖尿病 (T1D) 的發(fā)展。
2.長(zhǎng)期1型糖尿病患者來(lái)源的PB-IPC中GLUT2的表達(dá)上調(diào)
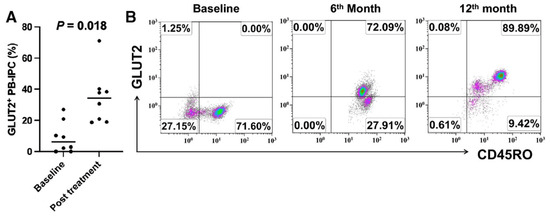
受試者HU2003自1歲起被診斷患有1型糖尿病,至今已有58年,但接受干細(xì)胞教育者治療后:
- GLUT2+CD45RO+PB-IPC比例從治療前基線的0%上升至第六個(gè)月的72.09%,第12個(gè)月隨訪時(shí)上升至89.89%。
- 每日胰島素總劑量減少約30–40%,血糖控制得到改善。(圖2)
綜上所述,流式細(xì)胞術(shù)顯示,在干細(xì)胞教育者療法治療后,其PB-IPC上GLUT2表達(dá)明顯上調(diào),IL-1β陽(yáng)性細(xì)胞水平明顯下調(diào),從而改善1型糖尿病的臨床結(jié)果。
2024年9月25日,天津市第一中心醫(yī)院沈中陽(yáng)、王樹森研究組,北京大學(xué)昌平實(shí)驗(yàn)室鄧宏魁研究組在國(guó)際權(quán)威期刊《細(xì)胞》發(fā)表題為《1型糖尿病患者腹部前直肌鞘下化學(xué)誘導(dǎo)多能干細(xì)胞來(lái)源的胰島移植》的臨床研究論文。[4]
在這項(xiàng)突破性研究中采用了一種創(chuàng)新的化學(xué)重編程技術(shù)。這種方法使用特定的化學(xué)小分子,而非傳統(tǒng)的基因操作,來(lái)誘導(dǎo)成熟細(xì)胞重返多能狀態(tài)。該技術(shù)因其安全性和效率而備受關(guān)注,并于2024年榮獲未來(lái)科學(xué)大獎(jiǎng)”生命科學(xué)獎(jiǎng)”。

該項(xiàng)技術(shù)的首例受益者是一名25歲的女性患者。本研究報(bào)道了該患者臨床治療達(dá)到1年的有效性和安全性臨床終點(diǎn)的數(shù)據(jù)。在證明安全性的基礎(chǔ)上,本研究獲得了臨床有效性的關(guān)鍵數(shù)據(jù):在證明安全性的基礎(chǔ)上,本研究獲得了臨床有效性的關(guān)鍵數(shù)據(jù):
1.血糖恢復(fù)正常,外源胰島素需要量持續(xù)下降
- 在移植后恢復(fù)了內(nèi)源自主性、生理性的血糖調(diào)控,移植75天后完全穩(wěn)定地脫離胰島素注射治療,目前療效已穩(wěn)定持續(xù)1年以上。(圖3A)
- 在移植前三個(gè)月內(nèi),患者通過CGM監(jiān)測(cè)的空腹血糖 (FBG) 為210±59(平均值±SD) mg/dL。移植后,F(xiàn)BG逐漸下降。在實(shí)現(xiàn)胰島素獨(dú)立后,患者的FBG維持在糖尿病診斷閾值以下(126mg/dL)(圖3B)。
- CGM 數(shù)據(jù)顯示,與基線測(cè)量值相比,患者的血糖在范圍內(nèi)時(shí)間 (TIR) 獲得了顯著改善。在1年終點(diǎn)時(shí),患者的TIR已>98%達(dá)8個(gè)月,與基線TIR 43.18%相比有顯著改善(圖3C)。
- 患者的HbA1c值從基線時(shí)的7.57%下降到第75天訪視時(shí)的6.50%。在第120天訪視時(shí),患者的 HbA1c 值下降至5.37%并在此后維持在非糖尿病范圍(<5.7%)。(圖3D)
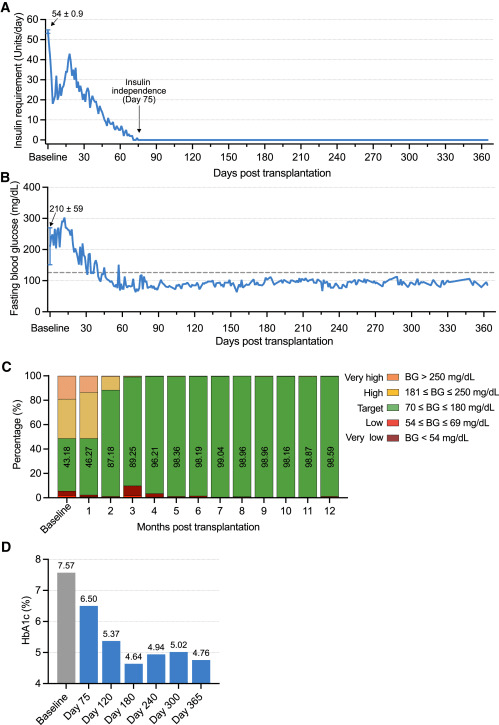
FBG、TIR和HbA1c的改善以及胰島素獨(dú)立的實(shí)現(xiàn)表明患者在CiPSC-胰島移植后血糖控制得到恢復(fù)。
2.患者內(nèi)源性、葡萄糖反應(yīng)性胰島素分泌得到恢復(fù)
- CiPSC-胰島移植后,患者空腹血清C肽水平(基線時(shí)檢測(cè)不到)迅速升高,到移植后第二周達(dá)到59.6–102.6 pmol/L 的水平。從第28天的隨訪開始,患者的空腹C肽水平進(jìn)一步升高。在停止胰島素治療后,空腹C肽達(dá)到穩(wěn)定水平,在第120天的隨訪中,C肽分泌物的進(jìn)餐反應(yīng)性進(jìn)一步改善。(圖4A)
- 從第180天起,患者的糖耐量進(jìn)一步改善,在隨后的OGTT中表現(xiàn)相對(duì)穩(wěn)定(圖4B和D)
- 第180、270和365天的OGTT測(cè)試顯示C肽峰值分別為 1,847.0、1,439.9 和 2,472.6 pmol/L,而C肽峰值相對(duì)于空腹C肽值的倍數(shù)變化分別為3.5、2.8和3.4(圖4D)。
這些數(shù)據(jù)表明,自第180天就診以來(lái),與第75天相比,移植物對(duì)口服葡萄糖的反應(yīng)產(chǎn)生了更強(qiáng)的胰島素分泌。
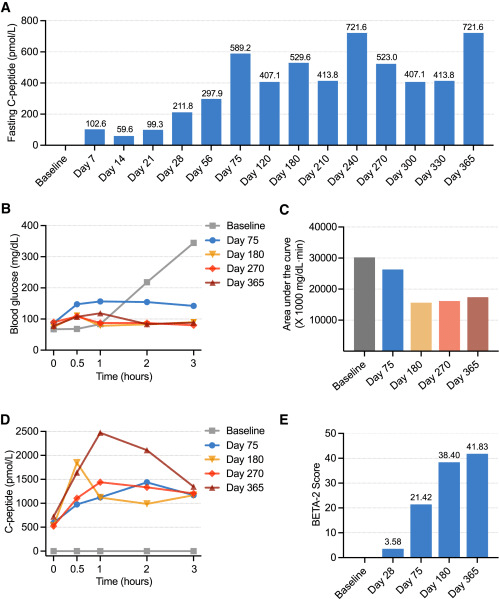
這些結(jié)果表明移植的CiPSC胰島具有良好的移植物功能,并且患者內(nèi)源性、葡萄糖反應(yīng)性胰島素分泌得到恢復(fù)。
3.安全性良好
T2W-FS和T1W-FS圖像均顯示在1年的隨訪期間移植部位沒有形成畸胎瘤的證據(jù)。
綜上所述,干細(xì)胞移植75天后,患者完全擺脫了胰島素注射治療,這一效果持續(xù)超過一年。更重要的是,患者的各項(xiàng)糖尿病相關(guān)指標(biāo)均達(dá)到正常人水平,實(shí)現(xiàn)了1型糖尿病的臨床功能性治愈。這一成果標(biāo)志著干細(xì)胞治療在1型糖尿病領(lǐng)域取得了突破性進(jìn)展。
2024年11月4日,福泰制藥(Vertex)發(fā)布了一項(xiàng)重大聲明。VX-880的1/2期試驗(yàn)正在轉(zhuǎn)為3期關(guān)鍵試驗(yàn),共招募50人。[5]

VX-880是一種基于干細(xì)胞的療法。這種療法通過干細(xì)胞體外誘導(dǎo)完全分化生成胰島細(xì)胞,這些細(xì)胞能夠產(chǎn)生胰島素,然后被移植到患者體內(nèi)以恢復(fù)正常的血糖調(diào)節(jié)功能,用于治療伴有嚴(yán)重低血糖事件和伴有低血糖意識(shí)障礙的1型糖尿病(T1D)患者。
這是1型糖尿病 (T1D) 的重大突破。這是全球首個(gè)首次針對(duì)部分1型糖尿病患者的干細(xì)胞療法進(jìn)入3期臨床試驗(yàn)。如果3期臨床試驗(yàn)結(jié)果繼續(xù)顯示出積極的效果,VX-880有望成為首個(gè)獲批用于治療1型糖尿病的干細(xì)胞療法,為患者提供一種全新的治療選擇。
干細(xì)胞在治療1型糖尿病中的作用機(jī)制
- 分化為胰島素分泌細(xì)胞:干細(xì)胞具有多能性,可以分化成胰島β細(xì)胞,這些細(xì)胞能夠產(chǎn)生胰島素。例如,通過化學(xué)重編程多能干細(xì)胞(CiPS細(xì)胞)分化而來(lái)的胰島細(xì)胞可以移植到患者體內(nèi),恢復(fù)胰島素的正常分泌功能。
- 免疫調(diào)節(jié)作用:干細(xì)胞還具有免疫調(diào)節(jié)功能,能夠調(diào)節(jié)免疫反應(yīng),糾正1型糖尿病患者的自身免疫問題。這種機(jī)制有助于防止胰島β細(xì)胞的進(jìn)一步破壞,從而維持胰島素的穩(wěn)定分泌。
- 促進(jìn)胰腺再生:干細(xì)胞移植可以促進(jìn)胰腺的再生,增加胰島β細(xì)胞的數(shù)量,從而提高胰島素的分泌能力。這為糖尿病干預(yù)提供了新的選擇。
- 改善血糖控制:通過上述機(jī)制,干細(xì)胞治療可以顯著改善患者的血糖控制能力。患者在移植后能夠完全脫離胰島素注射治療,并且血糖水平長(zhǎng)期穩(wěn)定。
結(jié)論
2024年,干細(xì)胞治療1型糖尿病取得了顯著的進(jìn)展。化學(xué)重編程技術(shù)、干細(xì)胞封裝技術(shù)等方法,為1型糖尿病的治療提供了新的思路和手段。這些研究成果不僅在理論上驗(yàn)證了干細(xì)胞治療的可行性,還在臨床實(shí)踐中展示了其巨大的應(yīng)用潛力。相信在不久的未來(lái),隨著研究的深入和技術(shù)的進(jìn)步,干細(xì)胞治療有望成為1型糖尿病的重要治療手段,為患者帶來(lái)新的希望和治療選擇。
相關(guān)閱讀:想要了解更多關(guān)于干細(xì)胞治療1型糖尿病的新聞咨詢請(qǐng)點(diǎn)擊這里!
參考資料:
[1]Liu, J., Yang, Y. & Qi, Y. Efficacy of mesenchymal stromal cells in the treatment of type 1 diabetes: a systematic review. Cell Tissue Bank 25, 663–676 (2024). https://doi.org/10.1007/s10561-024-10128-1
[2]https://news.vrtx.com/press-releases
[3]Zhao, Y.; Veysman, B.; Antolijao, K.; Zhao, Y.; Papagni, Y.; Wang, H.; Ross, R.; Tibbot, T.; Povrzenic, D.; Fox, R. Increase in the Expression of Glucose Transporter 2 (GLUT2) on the Peripheral Blood Insulin-Producing Cells (PB-IPC) in Type 1 Diabetic Patients after Receiving Stem Cell Educator Therapy. Int. J. Mol. Sci. 2024, 25, 8337. https://doi.org/10.3390/ijms25158337
[4]Transplantation of chemically induced pluripotent stem-cell-derived islets under abdominal anterior rectus sheath in a type 1 diabetes patientWang, Shusen et al.Cell, Volume 187, Issue 22, 6152 – 6164.e18
[5]https://news.vrtx.com/press-releases
免責(zé)說(shuō)明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。
版權(quán)說(shuō)明:本文來(lái)自杭吉干細(xì)胞科技內(nèi)容團(tuán)隊(duì),歡迎個(gè)人轉(zhuǎn)發(fā)至朋友圈,謝絕媒體或機(jī)構(gòu)未經(jīng)授權(quán)以任何形式轉(zhuǎn)載至其他平臺(tái),轉(zhuǎn)載授權(quán)請(qǐng)?jiān)诰W(wǎng)站后臺(tái)下方留言獲取。



 掃碼添加官方微信
掃碼添加官方微信